6.2: Cationes en Adición Electrofílica
- Page ID
- 78692
Muchas de las reacciones de los alquenos comienzan con un paso de protonación. El catión que se forma entonces se somete a un segundo paso en el que se combina con el contraión del ácido.
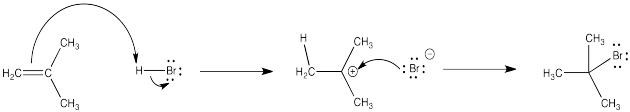
En el primer paso, el enlace π del alqueno es el nucleófilo y el protón es el electrófilo. En la segunda etapa, el bromuro es el nucleófilo y el catión es el electrófilo.
Si estás familiarizado con la sustitución alifática nucleofílica, ya sabrás que la presencia de un intermedio catiónico señala algunas complicaciones potenciales en esta reacción.
Un tema es el problema del control estereoquímico. Un carbocatión es plano trigonal, porque el carbono con la carga positiva solo tiene tres grupos unidos a él. Debido a que el catión es plano trigonal, el ion bromuro que se combina con él puede acercarse desde cualquier lado. Puede provenir desde arriba o por debajo del plano trigonal.
Ese hecho puede que no surta ningún efecto. Sin embargo, si el alqueno (y el catión que forma) es proquiral, lo que significa que tiene el potencial de formar un nuevo centro quiral durante esta reacción, entonces hay una elección de qué enantiómero hacer.
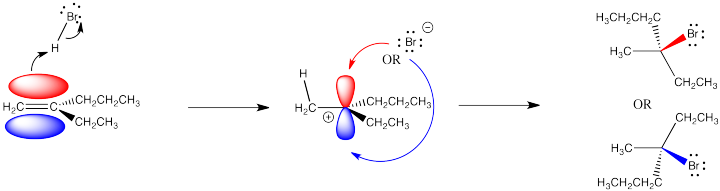
Un carbocatión proquiral es fácil de reconocer porque el carbono catiónico tiene tres grupos diferentes unidos a él. El cuarto grupo agregado, el nucleófilo, resultaría en cuatro grupos diferentes unidos a ese carbono, convirtiéndolo en un centro quiral. Para reconocer un alqueno proquiral, se puede visualizar cómo sería el alqueno después de que se haya producido la reacción: ¿habrá cuatro grupos diferentes?
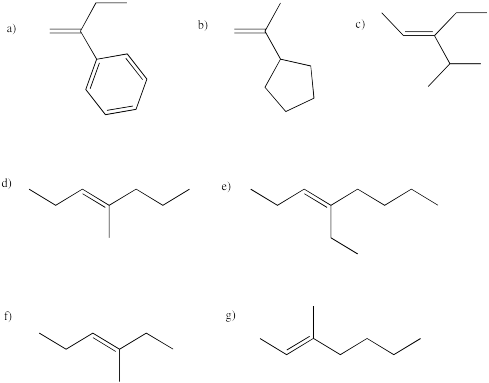
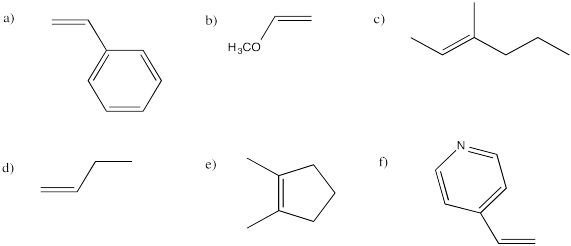
¿Cuáles de los siguientes alquenos son proquirales?
- Contestar
-
a, e, f, g son proquirales.
La adición del nucleófilo a una cara del alqueno dará como resultado un estereocentro con configuración R. Esa cara se llama la cara re. Añadirlo al otro conducirá a la formación de la configuración S. Esa cara se llama la cara si.
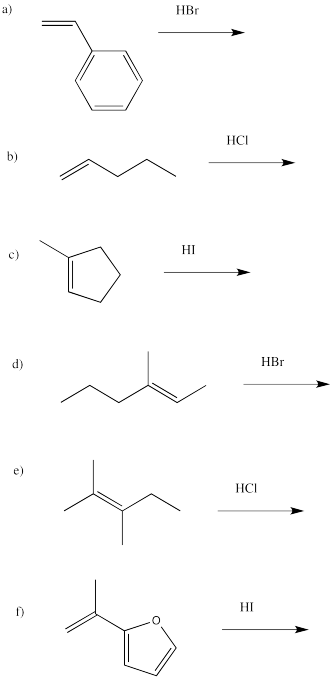
En los siguientes alquenos, identificar si estamos mirando la cara re o la cara si en términos del producto que obtendríamos a través de la adición de HBr.
- Contestar a
-
a) re
- Respuesta b
-
b) si
- Respuesta c
-
c) re
- Respuesta d
-
d) si
- Respuesta e
-
e) bien; si el Br agrega en un extremo del doble enlace es re, pero en el otro es si
- Respuesta f
-
f) re
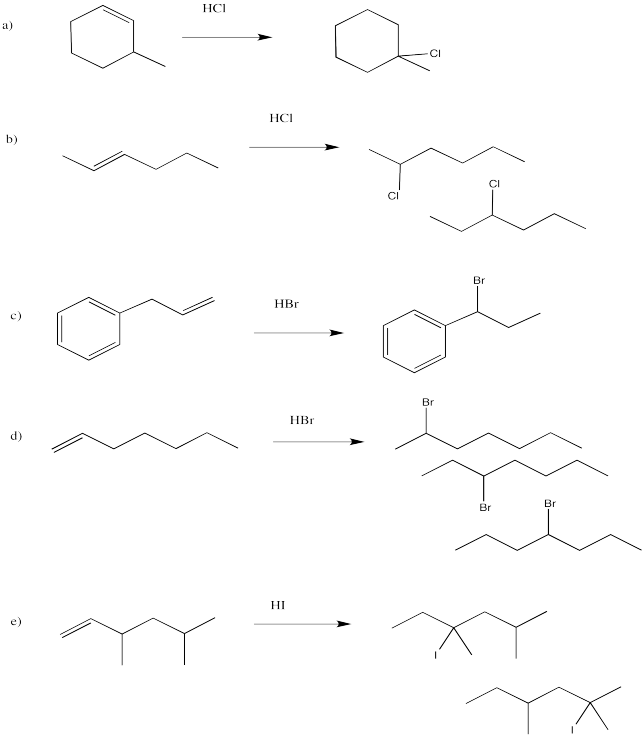
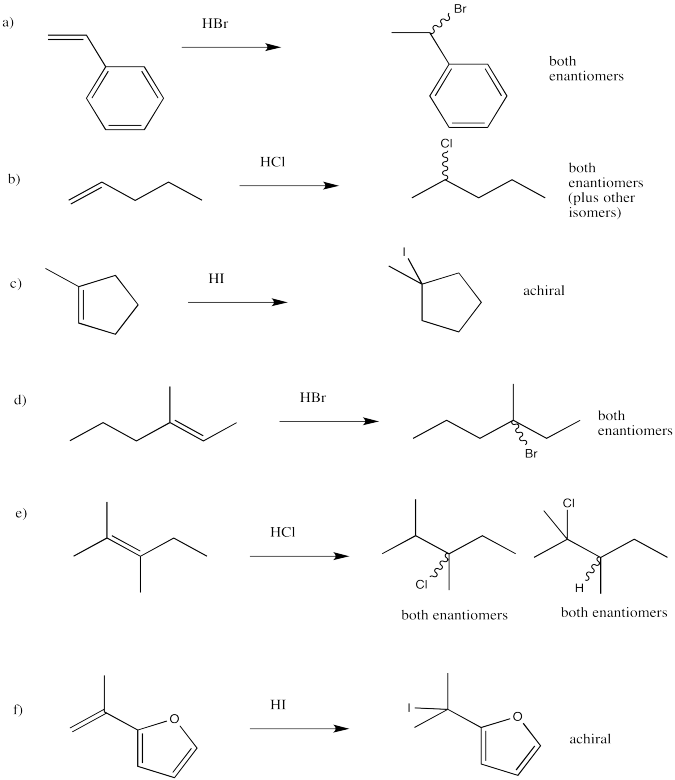
Dibujar los productos de las siguientes reacciones, prestando atención a la estereoquímica.
- Contestar
-
Además del problema de la estereoquímica, las adiciones electrofílicas de alquenos también presentan posibles complicaciones regioquímicas. Al igual que en las sustituciones nucleofílicas alifáticas, la formación de un catión a menudo abre la puerta a un rápido reordenamiento mediante cambios de 1,2-hidruro Puede haber un desplazamiento de hidruro o puede haber muchos de ellos seguidos.
Estos cambios de hidruro ocurren con bastante facilidad. La superposición de un átomo de hidrógeno con el orbital p vacío del catión adyacente conduce a un salto corto de un carbono al siguiente.
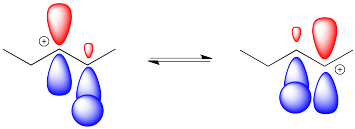
Un desplazamiento de hidruro de un carbono secundario al siguiente, como se ilustra en el ejemplo anterior, es termodinámicamente bastante neutro. Debido a que la barrera es baja, sucede rápidamente, pero no hay una fuerza impulsora para que el hidruro se desplace de una manera u otra. En cambio, ambos cationes resultan. Hay una mezcla.
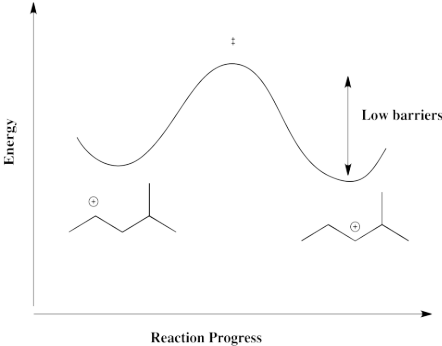
Sin embargo, en un caso en el que el catión puede formarse en una posición más estable, tal como una posición tertaria, existe una fuerza impulsora para que la reacción vaya en una dirección. La barrera sería demasiado alta para que vuelva.
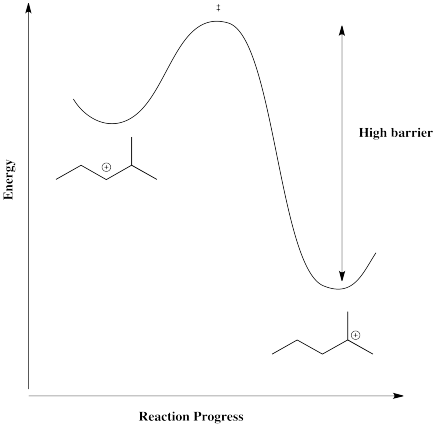
Como resultado, cuando el contraión se combina con el catión, puede hacerlo en una posición alejada del doble enlace original.
Dibujar los productos de las siguientes reacciones, prestando atención a la regioquímica.
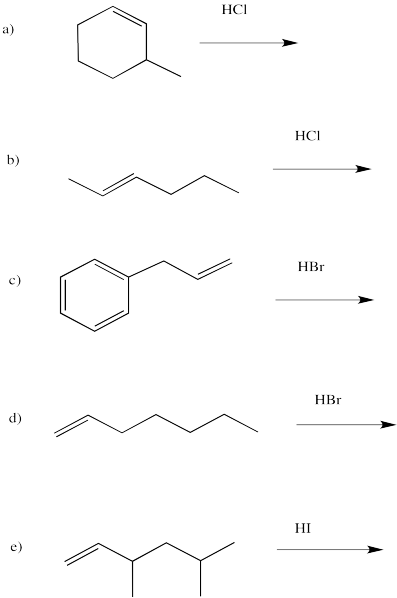
- Contestar
-