6.3: Participación de Solventes en la Adición Electrofílica
- Page ID
- 78703
Los alquenos pueden donar sus electrones a electrófilos fuertes y los carbocationes resultantes se combinan con el contraión del electrófilo para experimentar una reacción de adición general. Sin embargo, puede haber algunos casos en los que el contraión no se combine con el carbocatión.
Las hidrobromaciones del tipo que hemos visto solo ocurren bajo ciertas condiciones. Otras condiciones pueden llevar a otros productos. Por ejemplo, un disolvente como el agua también puede participar en la reacción.
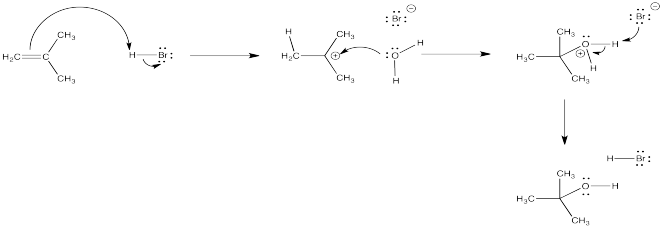
El catión a base de oxígeno (o ion oxonio) que resulta puede perder fácilmente su carga a través de la pérdida de un protón. Como resultado, una molécula de agua se suma al alqueno en general. El alqueno se convierte en un alcohol. Esta reacción se llama una “hdración catalizada por ácido” de un alqueno.
Explicar cómo la hidratación de un alqueno en presencia de ácido es una reacción catalítica.
- Contestar
-
Si el ácido se regenera al final de la reacción, no es un reactivo. Es un catalizador. Hace que la adición de agua al doble enlace ocurra mucho más rápidamente que si el agua actuara sola, ya que el agua nunca lograría protonar el alqueno.
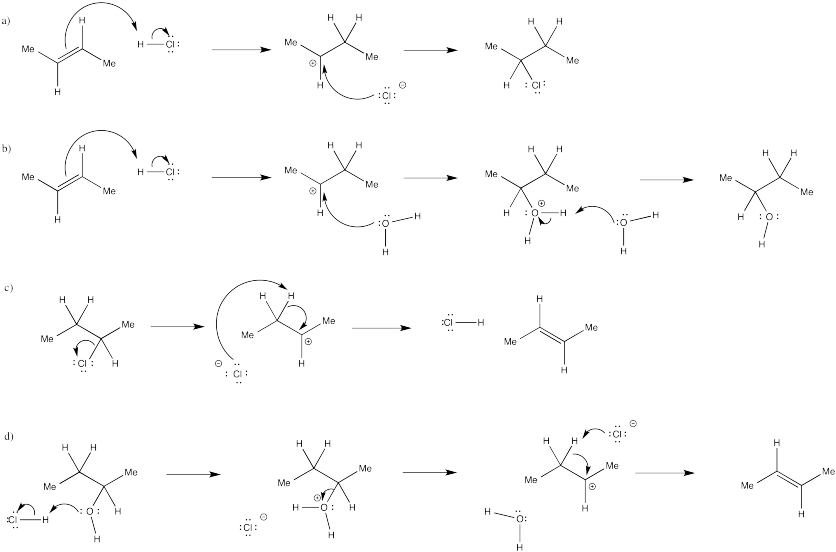
En muchos casos, las mezclas de equilibrio de múltiples productos pueden resultar de la adición de ácidos a los alquenos. Mostrar mecanismos, con flechas curvas, para las siguientes reacciones.
- La conversión de 2-buteno a 2-clorobutano con HCl acuoso.
- La conversión de 2-buteno a 2-butanol con HCl acuoso.
- La conversión de 2-clorobutano a 2-buteno con HCl acuoso.
- La conversión de 2-butanol a 2-buteno con HCl acuoso.
- Contestar
-
Por otro lado, en ausencia de algún disolvente, el ión bromuro aún podría tener cierta competencia en el segundo paso. “La reacción pura (pura significa “" sin disolvente "” de un alqueno con una pequeña cantidad de ácido puede resultar en polimerización.” El alqueno, que actuó como nucleófilo en el primer paso, también puede actuar como nucleófilo en el segundo paso.
Es importante recordar que en cualquier reacción, millones de moléculas están involucradas. Incluso si una molécula de alqueno reacciona con ácido en el primer paso de una reacción, todavía hay muchas otras moléculas de alqueno alrededor para actuar como nucleófilo en la segunda etapa.

Proporcionar un mecanismo para la polimerización que se muestra arriba. Supongamos que hay cuatro moléculas de 2-metilpropeno y una molécula de bromuro de hidrógeno para comenzar.
- Contestar
-

Las reacciones en cadena implican una etapa de iniciación, en la que se genera una especie reactiva; etapas de propagación, en las que la especie reactiva reacciona para formar una nueva especie reactiva; y una etapa de terminación, en la que la especie reactiva reacciona para formar una molécula estable. Etiquete cada uno de los pasos en su mecanismo a partir de la pregunta anterior.

