6.7: Adición concertada a alquenos
- Page ID
- 78725
Los alquenos se pueden tratar con ácidos acuosos o, mucho más eficientemente, con sales mercúricas acuosas, seguido de borohidruro de sodio, para producir alcoholes. En esos casos, el grupo hidroxilo se encuentra en diferentes lugares. El tratamiento con ácido a menudo resulta en una mezcla de alcoholes en la que los grupos OH se encuentran en las posiciones más sustituidas de la estructura, independientemente de la posición del alqueno original. Oximercuración - desmercuración da como resultado que el hidroxilo se fije en el extremo más sustituido del primer enlace C=C.
Esas reacciones generalmente se denominan reacciones de hidratación porque dan como resultado la adición general de H-OH a través del doble enlace.
- Las reacciones de hidratación colocan un OH en un extremo y un H en el otro extremo de un doble enlace anterior.
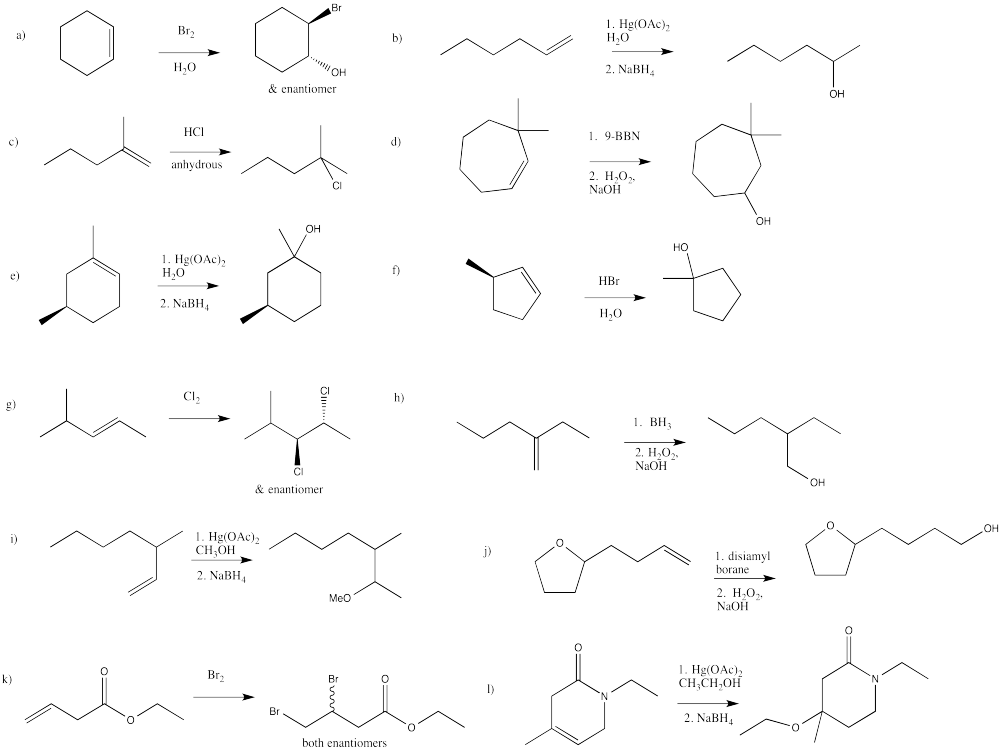
Hidroboración - oxidación es una secuencia de reacciones de dos etapas que también da como resultado la hidratación de un doble enlace. Sin embargo, esta reacción es complementaria a la oximercuración-desmercura.
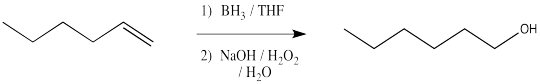
En lugar de dejar un grupo OH en el extremo más sustituido del doble enlace, el grupo hidroxi se coloca en el extremo menos sustituido del doble enlace.
Modifiquemos un poco esa afirmación. En realidad, el esquema de reacción anterior apenas muestra el producto principal. El producto menor tiene el grupo hidroxi en la posición más sustituida del doble enlace. Estos dos productos pueden encontrarse en diferentes proporciones, tal vez incluso tan cerca como 55:45, pero siempre predomina el producto menos sustituido. Pronto veremos métodos de hidroboración más eficientes, llevando a relaciones por encima de 95:5, o casi en su totalidad el producto menos sustituido.
El producto de adición sin hidrógeno (es decir, adición del grupo OH) en el extremo más sustituido del alqueno se denomina producto de adición de Markovnikov. El producto de adición sin hidrógeno en el extremo menos sustituido del alqueno se denomina producto de adición anti-Markovnikov.
- La oximercuración - la desmercuración da como resultado la hidratación de Markovnikov.
- La hidroboración - la oxidación da como resultado una hidratación anti-Markovnikov.
Esta selectividad es importante en aplicaciones sintéticas. Utilizamos productos naturales todo el tiempo como productos farmacéuticos, vitaminas y otras aplicaciones de salud y belleza, pero no siempre podemos obtener estos compuestos directamente de la naturaleza, por varias razones. Podría ser que el organismo necesite ser asesinado para poder cosechar sus productos, o que no haya suficiente de la fuente en la naturaleza para satisfacer la demanda. Frecuentemente es más económico producir compuestos comercialmente útiles a partir de materias primas químicas convenientes. A lo largo del último siglo y medio, esas materias primas han venido del alquitrán de hulla y, más tarde, del petróleo. Actualmente, se está avanzando rápidamente para desarrollar materias primas químicas a partir de fuentes como el aceite vegetal y de algas (es decir, aceite de algas marinas).
Estas materias primas son solo compuestos que se pueden convertir sintéticamente en productos farmacéuticos, así como en plásticos, pinturas, recubrimientos y otros materiales. Frecuentemente, los materiales de partida para estos procesos contienen enlaces C=C que pueden ser funcionalizados a través de la adición electrófila. Así, la adición electrofílica y las reacciones relacionadas se encuentran entre las más importantes del mundo, económicamente hablando. Es muy valioso poder controlar el resultado de estas reacciones para hacer que los procesos sean más eficientes, produciendo menos subproductos derrochadores.
- La regioselectividad, o control sobre dónde ocurre una reacción, es muy importante.
- Las adiciones de Markovnikov versus anti-Markovnikov disponibles en hidratación son buenos ejemplos de control regioquímico.
Enumerar las ventajas y desventajas de producir materiales basados en
- petróleo
- aceite vegetal
- algas
- cosechar los compuestos deseados directamente de la naturaleza
Nuevamente, nos vamos a centrar en la primera de las dos reacciones en esta secuencia. Esa parte es donde se decide la colocación del nuevo sustituyente. Después de la adición del borano, se forma un alquilborano. El isómero principal es el resultado de la adición anti-Markovnikov.

Parece bastante claro en este punto que esta reacción debe proceder como otras adiciones electrofílicas a los alquenos. Los electrones π donan al electrófilo. En este caso eso es boro, que es fuertemente ácido Lewis porque carece de octeto. El boro termina en el extremo menos sustituido del doble enlace.

Ese resultado sin duda se vería favorecido sobre este:
Ese boro empieza a parecer menos electrofílico y más nucleofílico. Podemos imaginar fácilmente un nucleófilo hidruro siendo entregado al carbocatión.

Hasta ahora, la imagen de cómo funciona la reacción de alquilboración encaja bastante bien dentro de nuestro marco de adición electrófila. Desafortunadamente, hay algunos problemas con este modelo.
En primer lugar, tal vez el 55% de la boración se lleva a cabo en un sentido Markovnikov, pero el otro 45% se agrega para formar un producto anti-Markovnikov. Ciertamente el catión secundario se ve favorecido sobre el primario, pero si la reacción avanza a través de un carbocatión, entonces el primario no debería suceder en absoluto.
Algo anda mal con nuestro modelo.
Otro agujero se rompe en el argumento cuando miramos los resultados de estudios estereoquímicos. Podríamos, por ejemplo, tomar el siguiente hexeno marcado con deuterio y tratarlo con borano. Podríamos ver los productos a través de espectroscopia de RMN 1H, y si pudiéramos ver la constante de acoplamiento entre los dos protones que se muestran en la estructura, entonces conoceríamos su disposición relativa en el espacio. Conoceríamos su estereoquímica.
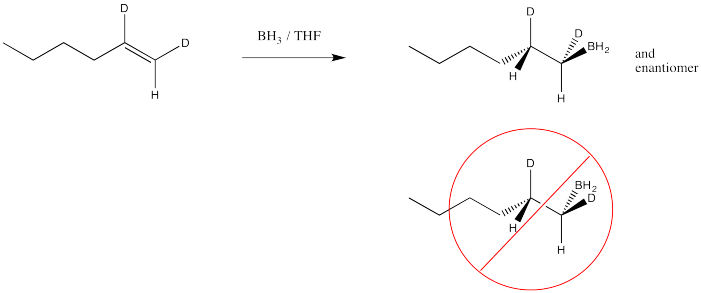
Si hiciéramos ese experimento, entonces veríamos que el hidrógeno y el boro del borano se agregan a la misma cara del alqueno. No obtenemos adición de boro a una cara e hidrógeno a la otra. Este tipo de adición se llama adición syn; es lo opuesto a la adición anti.
- La hidroboración da como resultado una adición sin al alqueno.
Mostrar cómo un intermedio catiónico y los cambios conformacionales permitirían tanto syn como anti adición de borano al propeno.
- Responder
-
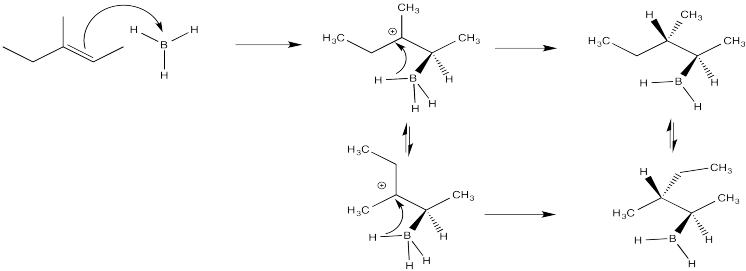
Ese resultado significa que, aunque algunos elementos de nuestro mecanismo pueden reflejar la realidad, al menos tenemos un problema con el tiempo. ¿Cómo se puede entregar el hidruro antes de que la conformación tenga la oportunidad de cambiar? Tiene que suceder bastante rápido. ¿Y si sucede al mismo tiempo que la donación de bonos π al boro?
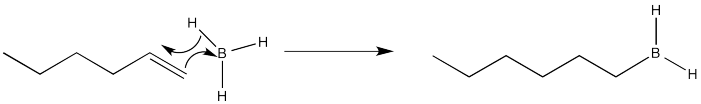
Esta reacción se describiría mejor como una adición concertada. Se agregan dos grupos a los dos extremos del doble enlace al mismo tiempo. Durante el estado de transición, se estarían rompiendo dos bonos y dos se estarían formando al mismo tiempo.
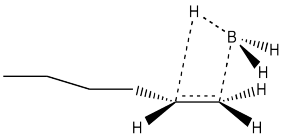
Podemos mejorar aún más nuestro modelo de cómo funciona la alquilboración si consideramos que el disiamilborano y el 9-BBN son mucho más eficientes que el borano en términos de regioselectividad. Estos reactivos pueden producir una adición cercana al 100% anti-Markovnikov. Explique cómo con la ayuda de dibujos.
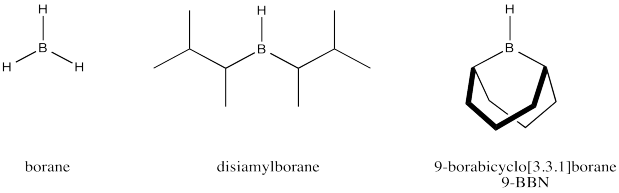
- Responder
-
El hacinamiento es más severo en la estructura de la izquierda que en la estructura de la derecha. La estructura de la derecha, que representa una aproximación al estado de transición de la reacción, es más favorable que la otra.

La reacción posterior en esta serie implica la eliminación del boro y el reemplazo con un grupo hidroxilo. El mecanismo de esta reacción puede no valer la pena memorizar porque no encaja bien dentro de las categorías que hemos visto hasta ahora.
Lo importante que hay que saber es que el oxígeno termina exactamente en el mismo lugar que el boro. No hay cambio en la estereoquímica en esa posición. En general, el hidrógeno y el grupo hidroxi experimentan efectivamente adición sin, aunque se agregan en diferentes etapas.
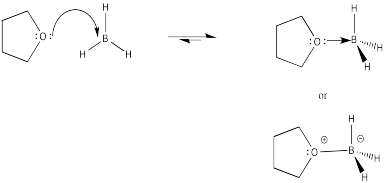
El borano se usa frecuentemente en THF porque el borano por sí solo no es muy estable; es bastante pirofórico, estallando en llamas al entrar en contacto con el aire. En THF, el borano forma un equilibrio con un complejo Lewis-ácido-base. Mostrar esta reacción de equilibrio.
- Responder
-
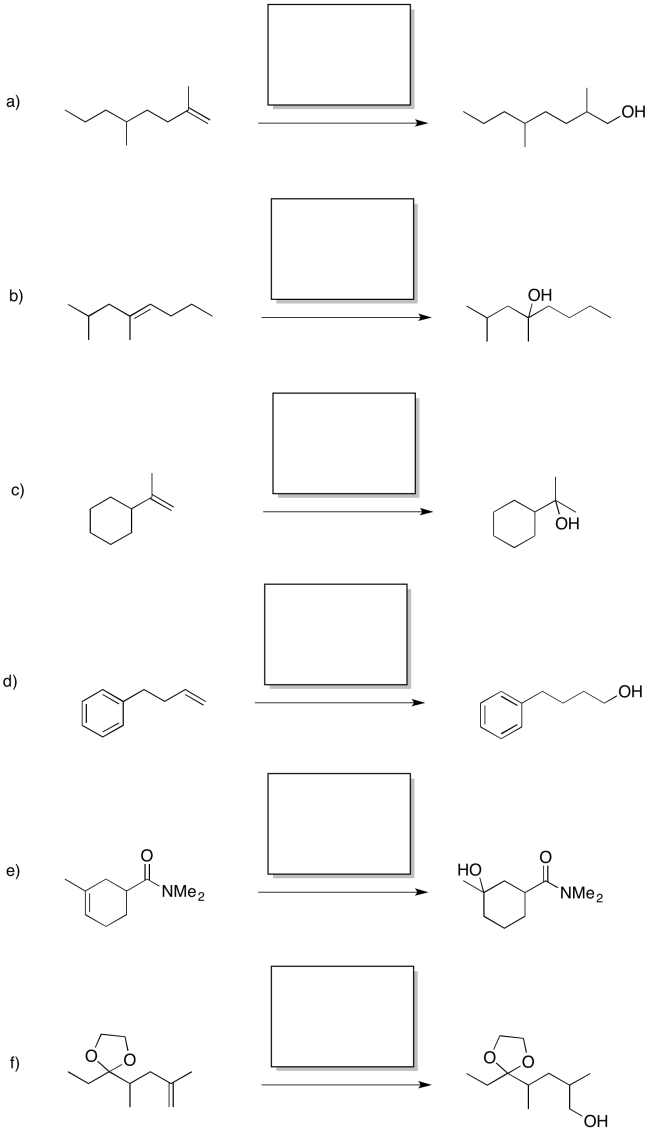
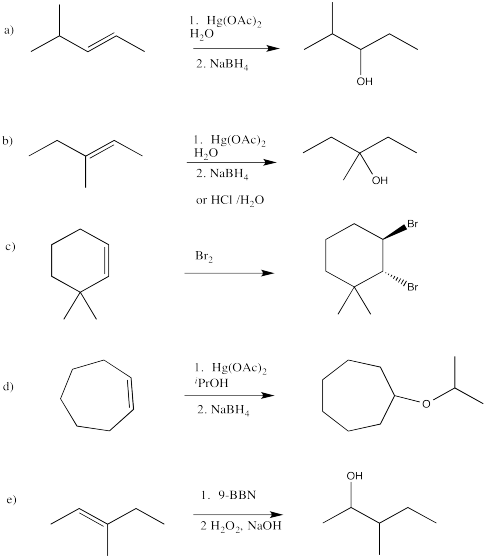
Proporcionar reactivos para las siguientes reacciones
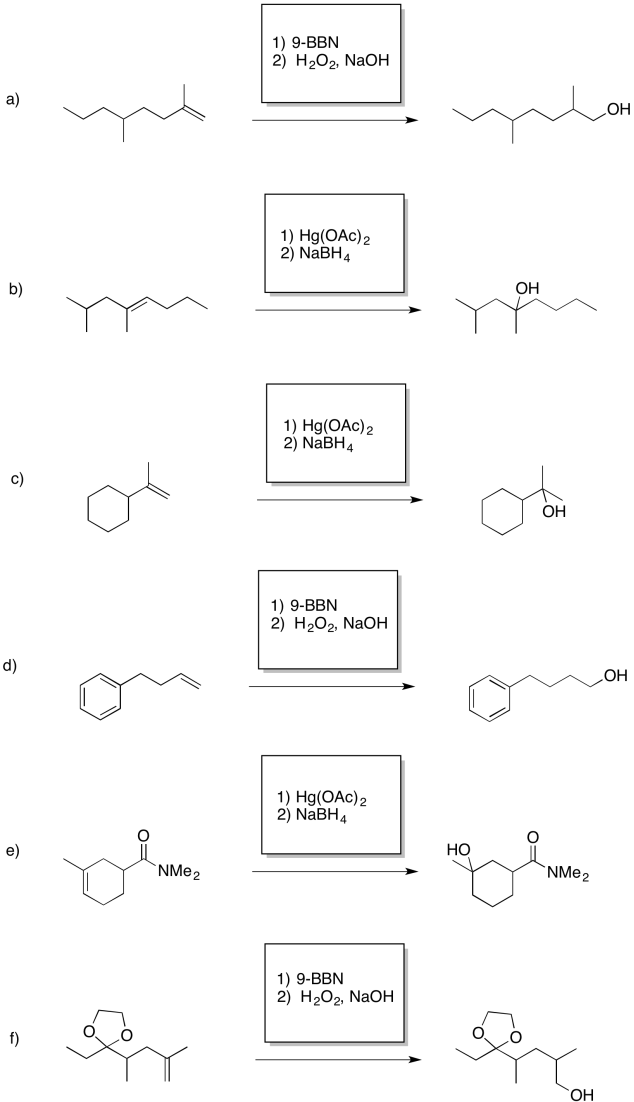
- Responder
-
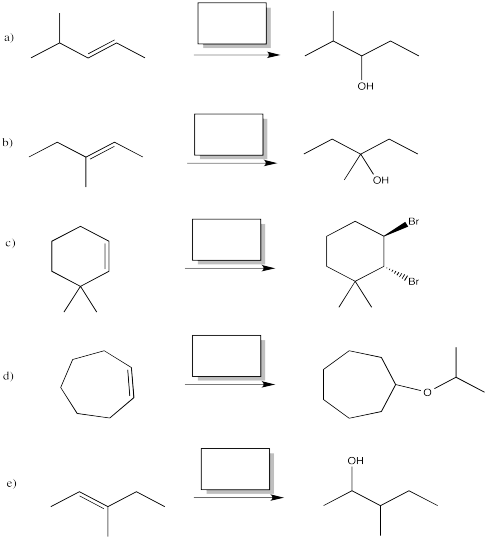
Proporcionar reactivos para las siguientes reacciones
- Responder
-
Mostrar productos de las siguientes reacciones.
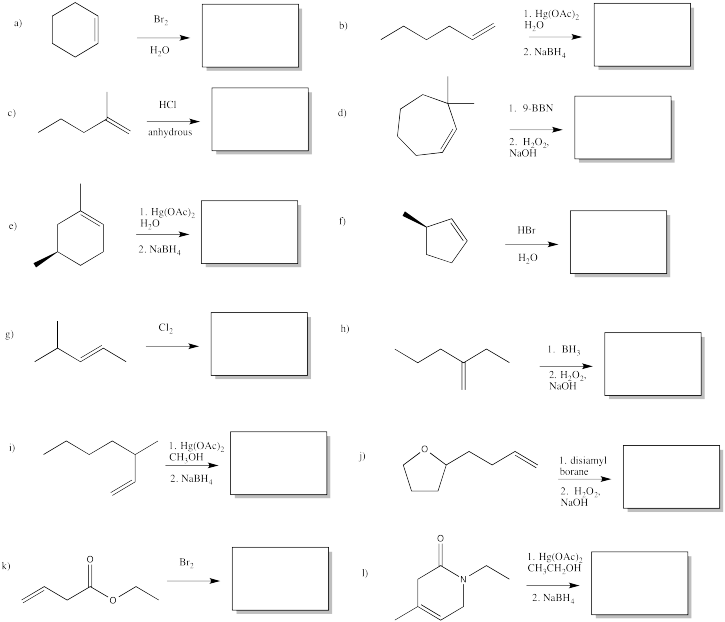
- Responder
-