6.8: Epoxidación
- Page ID
- 78681
La epoxidación es la adición de un solo átomo de oxígeno a través de un doble enlace C=C.
Anteriormente, vimos que los alquenos pueden donar sus electrones pi a electrófilos como “Br +”. En el ion bromo que resulta, un par solitario en el bromo puede donar de nuevo al carbocatión incipiente, lo que lleva a un intermedio más estable.

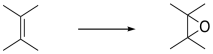
También hemos visto que la adición a los alquenos a veces se puede concertar, sucediendo de una vez, en lugar de un paso a la vez. Por ejemplo, en la hidroboración, el boro y el hidrógeno se suman al doble enlace al mismo tiempo.
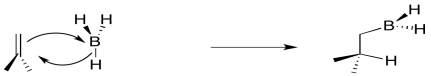
El boro está sumando ligeramente por delante del hidrógeno. La interacción inicial es la donación del enlace pi al boro ácido de Lewis. Sin embargo, tan pronto como la carga positiva comienza a acumularse sobre el carbono y la carga negativa comienza a acumularse sobre el boro, el hidruro se dona inmediatamente. No se permite tiempo para que el intermedio cargado se forme completamente antes de proceder.
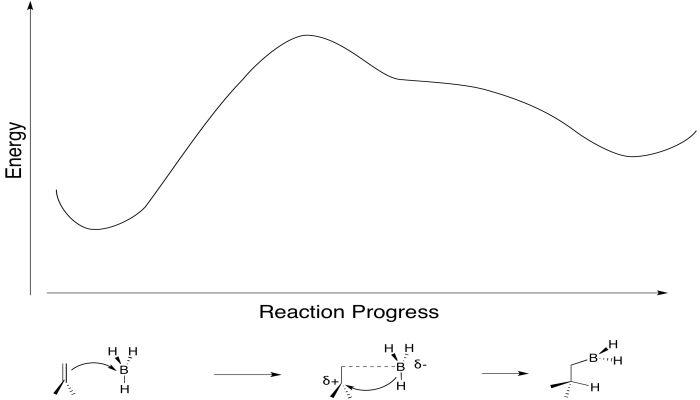
En serio, eso es lo que le está pasando al bromo, también. A medida que el alqueno comienza a donar sus electrones pi al bromo y comienza a acumular carga positiva, el par solitario del bromo es atraído de nuevo al alqueno. En consecuencia, el intermedio que imaginamos con una carga positiva completa sobre el carbono y ninguna carga sobre el bromo existe de manera demasiado fugaz para ser considerado un intermedio en absoluto. En cuanto empieza a formarse, ya se está convirtiendo en otra cosa.
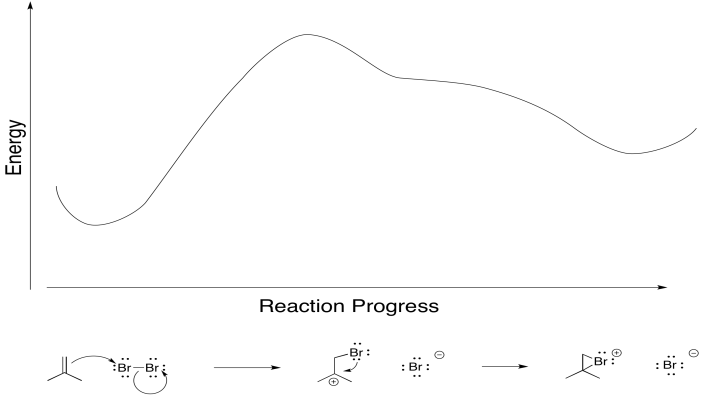
Ese tipo de adición concertada ocurre con algunos otros electrófilos, también. Si un átomo es electrófilo, pero también tiene un par solitario para donar, ese estado de transición cíclica puede llevar al producto en un solo paso.
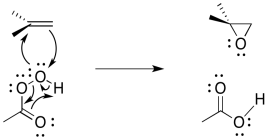
La epoxidación de alquenos es otro ejemplo de este tipo de reacción. Una epoxidación es la transferencia de un átomo de oxígeno de un compuesto peroxi a un alqueno. Los peróxidos contienen enlaces O-O, que son relativamente débiles y reactivos.

Para simplificar un poco, basta con mirar la reacción desde el punto de vista del alqueno. Es sólo recoger un átomo de oxígeno, porque el peróxido tenía uno extra.
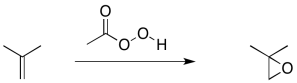
Cuando se transfiere el átomo de oxígeno, forma un epóxido (a veces llamado oxirano). Es un anillo de tres miembros que contiene dos carbonos y un oxígeno.
- La epoxidación da como resultado la transferencia de un átomo de oxígeno de un peróxido a un alqueno.
- Los peróxidos son compuestos que contienen enlaces O-O débiles.
Como en una bromación, el electrófilo es engañoso. Se trata de un átomo de oxígeno, que de manera más natural pensamos como un nucleófilo. Sin embargo, así como Br 2 contiene un átomo unido a un buen grupo lábil (Br -), también lo hacen los tipos de compuestos de oxígeno utilizados en la epoxidación. La mayoría de las veces, estos son “peroxiácidos”, ácidos carboxílicos que contienen un oxígeno extra.

Al igual que en la bromación, tan pronto como el alqueno comienza a donar al electrófilo, una pareja solitaria puede donar de nuevo, para que no se tenga que formar un catión inestable.
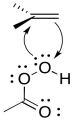
Se cree que todo el mecanismo está concertado, con base en una serie de líneas de evidencia experimental. Es necesario lograr una serie de cosas; además de la donación de oxígeno, el grupo de salida debe irse, y se debe transferir un protón.
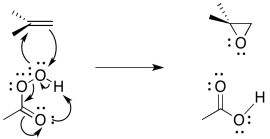
El mecanismo de reacción puede limpiarse ligeramente porque se piensa que es un ejemplo de reacción pericíclica. Reacciones pericílicas que involucran frecuentemente tres pares de electrones que se mueven en círculo. Al igual que los tres pares de electrones en un anillo de benceno, se piensa que esta estructura es inusualmente estable.
Aparte de los peroxiácidos, muchos otros peróxidos pueden estar involucrados en epoxidaciones, así como algunos óxidos metálicos. En algunos casos, la reacción es extremadamente lenta, pero funciona mejor en presencia de un catalizador.
Predecir los productos de las siguientes reacciones.
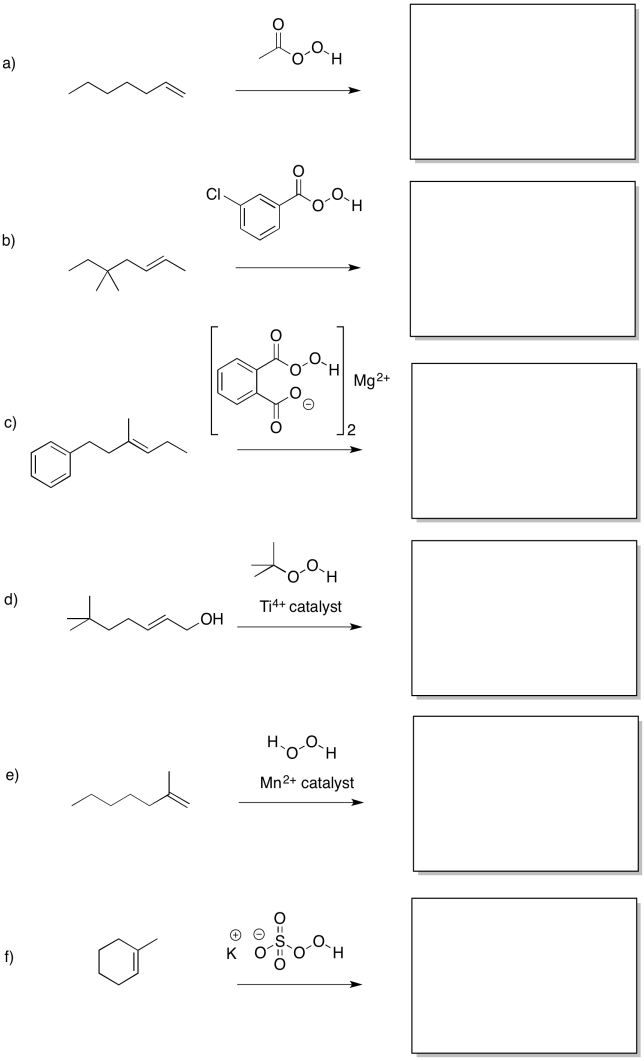
- Responder
-

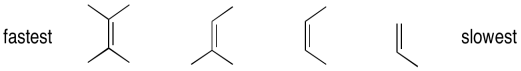
Las reacciones de epoxidación muestran una selectividad casi contraintuitiva. A diferencia de las reacciones de hidrogenación, que generalmente son más fáciles con alquenos menos sustituidos, las epoxidaciones son mucho más rápidas con alquenos más sustituidos. En el caso de las hidrogenaciones, la selectividad puede entenderse como una combinación de factores estéricos (el alqueno debe unirse a un catalizador) así como factores termodinámicos (los alquenos más sustituidos son más estables, por lo que son menos propensos a reaccionar). Sin embargo, en epoxidaciones, cuanto más rico en electrones es el alqueno, más fácilmente se puede inducir a reaccionar con el peróxido. Los alquenos más sustituidos son generalmente más ricos en electrones que aquellos que están sustituidos solo con hidrógenos pobres en electrones.
Predecir los productos de las siguientes reacciones.
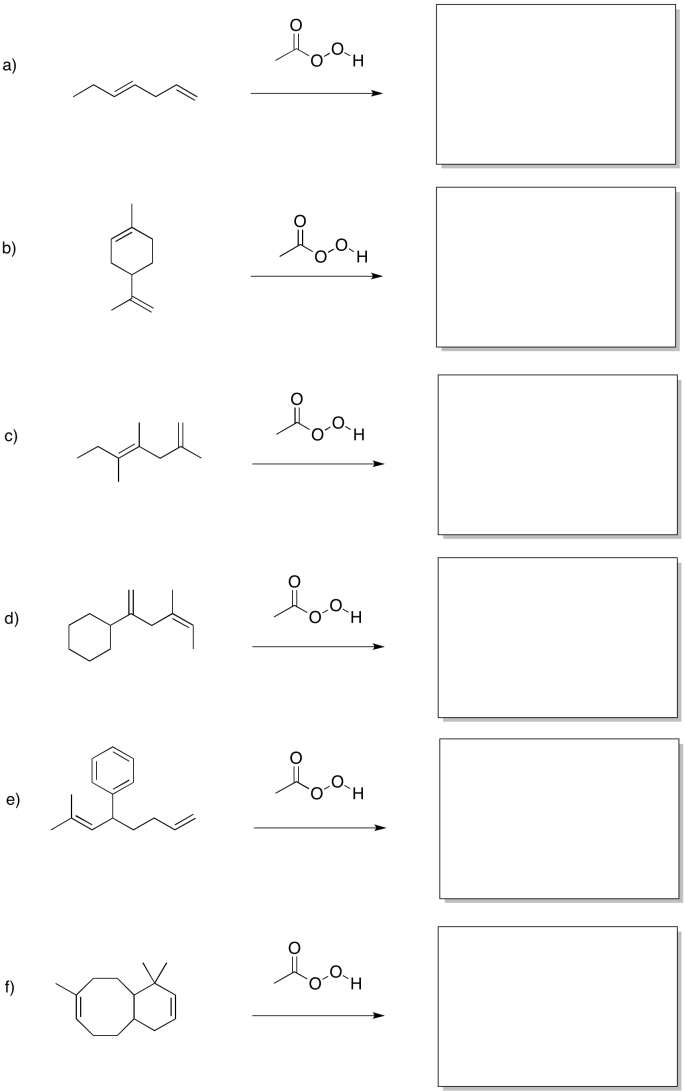
- Responder
-
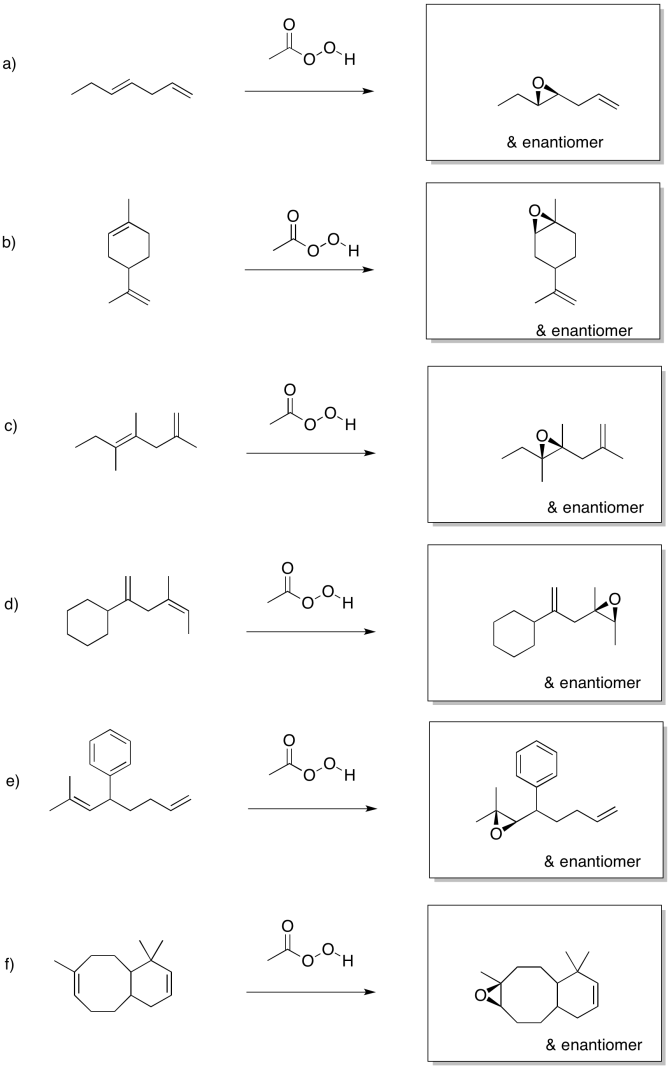
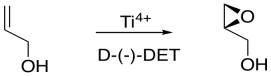
La epoxidación Sharpless es uno de los métodos más comunes para agregar catalíticamente un oxígeno a través de un doble enlace. El método generalmente emplea un catalizador de titanio; enfoques similares usan catalizadores de vanadio u otras especies metálicas. Como se mencionó anteriormente, los iones metálicos a veces pueden acelerar las epoxidaciones.
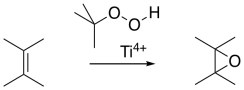
La epoxidación Sharpless es importante en parte porque epoxida selectivamente alcoholes alílicos: compuestos que contienen una unidad C=C-C-OH. Eso significa que, además de poder epoxidar selectivamente dobles enlaces más sustituidos en presencia de dobles enlaces menos sustituidos, también podemos seleccionar dobles enlaces que estén cerca de los alcoholes.
Circula el alcohol alílico en cada uno de los siguientes compuestos.
- Responder
-

¿Cómo identifica selectivamente esa posición la catálisis metálica? Recuerde, una de las estrategias importantes en la catálisis enzimática es la aproximación: el acto de unir dos cosas. Un alcohol es un potencial donante de pares solitarios, por lo que podría convertirse en un ligando para un ion metálico. Ti 4+ y V 4+ resultan ser muy oxófilos —se unen bien al oxígeno— y por lo tanto son especialmente adecuados para esta tarea.
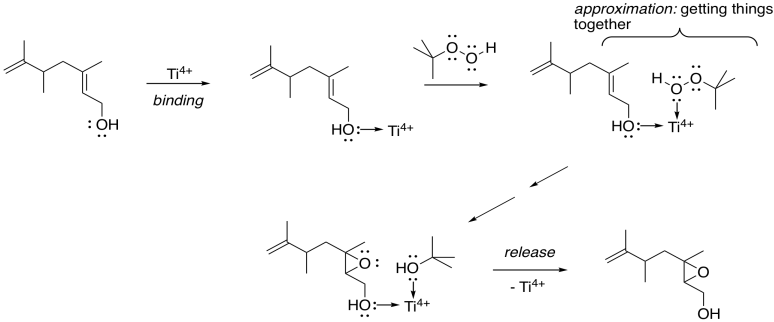
En este esquema, no nos preocupa exactamente cómo el ion titanio llega al peróxido para ceder su oxígeno extra al alqueno; eso es complicado. Sin embargo, el hecho de que tanto el alcohol alílico como el peróxido puedan unirse al titanio los acerca, y los hace más propensos a reaccionar entre sí.
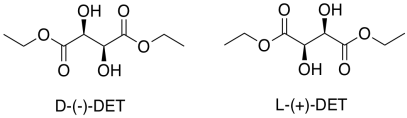
Esa es sólo una parte de la historia de la epoxidación Sharpless. La otra razón por la que este método es importante es su estereoselectividad. Para obtener estereoselectividad, se agrega un ligando quiral para el titanio. Por lo general, es tartrato de dietilo (DET) o tartrato de diisopropilo (DIT). El tartrato es quiral; hay un enantiómero D- (-) y un enantiómero L- (+). El D y L son símbolos comunes utilizados para designar enantiómeros en azúcares; relacionan la estructura de nuevo con los abuelos bioquímicos de todos los azúcares, D-gliceraldehído y L-gliceraldehído. Los símbolos (-) y (+) se refieren a las características de este compuesto en particular en la polarimetría; el enantiómero (+) gira la luz polarizada plana en el sentido de las agujas del reloj, mientras que el enantiómero (-) gira la luz polarizada plana en sentido contrario a las agujas del reloj.
Asignar configuraciones estereoquímicas (R y S) a los tartratos para confirmar que son enantiómeros entre sí.
- Responder
-
D- (-) -tartrato es el isómero (2S,3S). L- (+) -tartrato es el isómero (2R,3R) .Cada centro quiral está configurado opuesto al correspondiente en la otra molécula, por lo que las moléculas son enantiómeros.
Si se agrega el isómero D- (-), se obtiene un posible enantiómero del producto. Si se agrega el isómero L- (+), se obtiene el otro enantiómero posible.
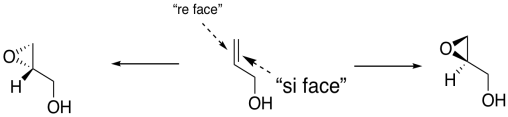
En general, obtendríamos un enantiómero si el oxígeno se agregara a una cara del alqueno y el otro enantiómero si el oxígeno se agregara a la otra cara. En el dibujo de abajo, la cara del alqueno hacia nosotros a veces se llama la “cara re” (pronunciada, cara de rayo). El rostro del alqueno lejos de nosotros se llama la “cara si” (ver cara). Estas palabras suenan relacionadas con la configuración R y S, y en cierto modo son así, pero se utilizan para describir dos caras diferentes de una molécula plana. Agregar oxígeno a la cara re da en enantiómero; addign oxígeno a la cara si da otro.
¿Cómo funciona esta reactividad preferida? ¿Cómo logra el metal agregar el oxígeno a una cara pero no a la otra? Los tartratos son ricos en oxígeno y por lo tanto se unen muy bien al titanio. Recuerde, si tenemos un sitio de reacción y lo hacemos quiral, generalmente se prefiere un enantiómero del producto. Las enzimas son moléculas quirales muy compicadas, y son buenas para producir un enantiómero de un producto. En comparación, el complejo de titanio DET es una molécula quiral relativamente simple, pero usa la misma idea.
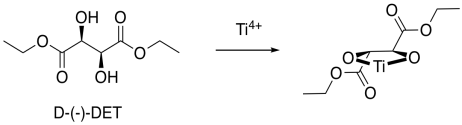
Ahora bien, es realmente muy difícil mirar estas condiciones y predecir exactamente qué enantiómero se formaría en una reacción. Sin embargo, podemos observar un factor que podría ilustrar una razón subyacente de la preferencia. En el análisis de cuadrantes, observamos la forma general formada por ese ligando de tartrato bidentado en el metal. En las imágenes de abajo, la bola roja es el átomo metálico. El ligando tartrato se extiende hacia arriba y hacia la derecha mientras se asienta sobre el metal, y también hacia abajo y hacia la izquierda; se dibuja en azul. En consecuencia, si pensamos en el metal como sentado en medio de un cuadrado, las esquinas alternas de ese cuadrado se llenan, y las otras esquinas están vacías.
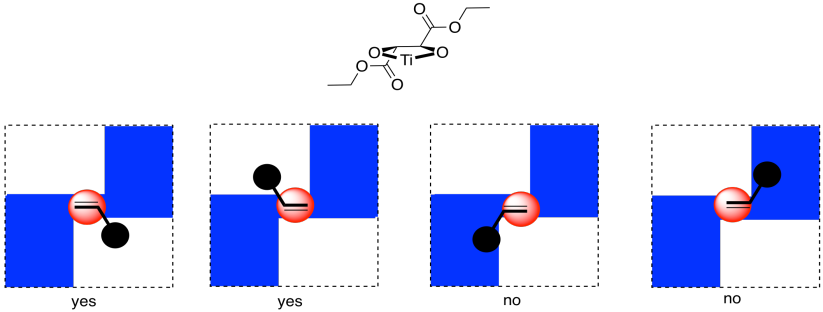
Imagina el alqueno acercándose a ese metal. El alqueno probablemente tendrá una orientación preferida en la que se unirá. Solo por ejemplo, tal vez necesite unirse con el doble enlace en el mismo plano que el anillo formado por el titanio y los oxígenos (horizontalmente en la imagen). Si hace eso, puede reducir las interacciones estéricas con el ligando uniendo una cara del alqueno preferentemente al metal, manteniendo el sustituyente más grande en el alcano (la bola negra) en un espacio relativamente abierto. El alqueno también podría unirse si girara boca abajo en comparación con la primera imagen, pero la misma cara aún estaría hacia el titanio.
Por otro lado, si el alqueno intenta unirse a través de la otra cara del enlace pi, el sustituyente más grande estaría en un espacio más abarrotado. Eso podría ser menos favorable.
En general, si el alqueno tiene una cara preferida que se unirá al metal, entonces cualquier cosa entregada de ese metal aterrizará en esa cara, y no en la opuesta.
Hay muchas variaciones en este modelo. Tal vez no son las interacciones estéricas las que influyen en cómo el alqueno se acerca al metal. A lo mejor es algún otro factor, como los enlaces de hidrógeno, el que tira del alqueno orientado en una dirección y no en otra. Sin embargo, aunque los detalles de un caso particular hacen que el resultado sea muy difícil de predecir, la idea general es familiar: una molécula quiral encajará preferentemente de una manera con otra molécula, por su forma asimétrica.
Aunque es posible que no puedas predecir de la parte superior de tu cabeza qué enantiómero se forma en una epoxidación Sharpless, dado un resultado, es posible que puedas adivinar otro. Dada la reacción de la izquierda, mira lo que puedes decir sobre la reacción de la derecha.
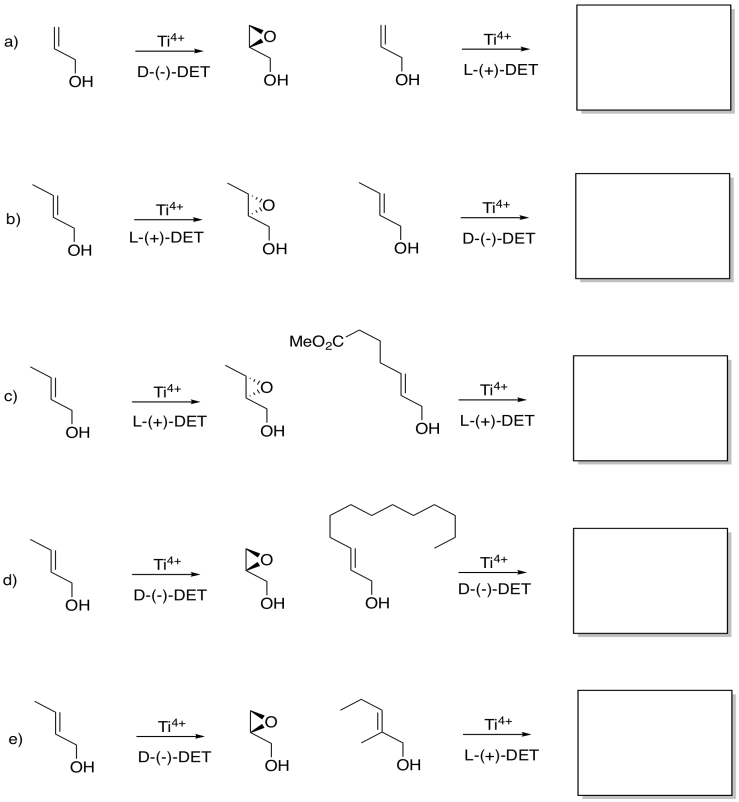
- Responder
-
Rellene las casillas en la siguiente síntesis.
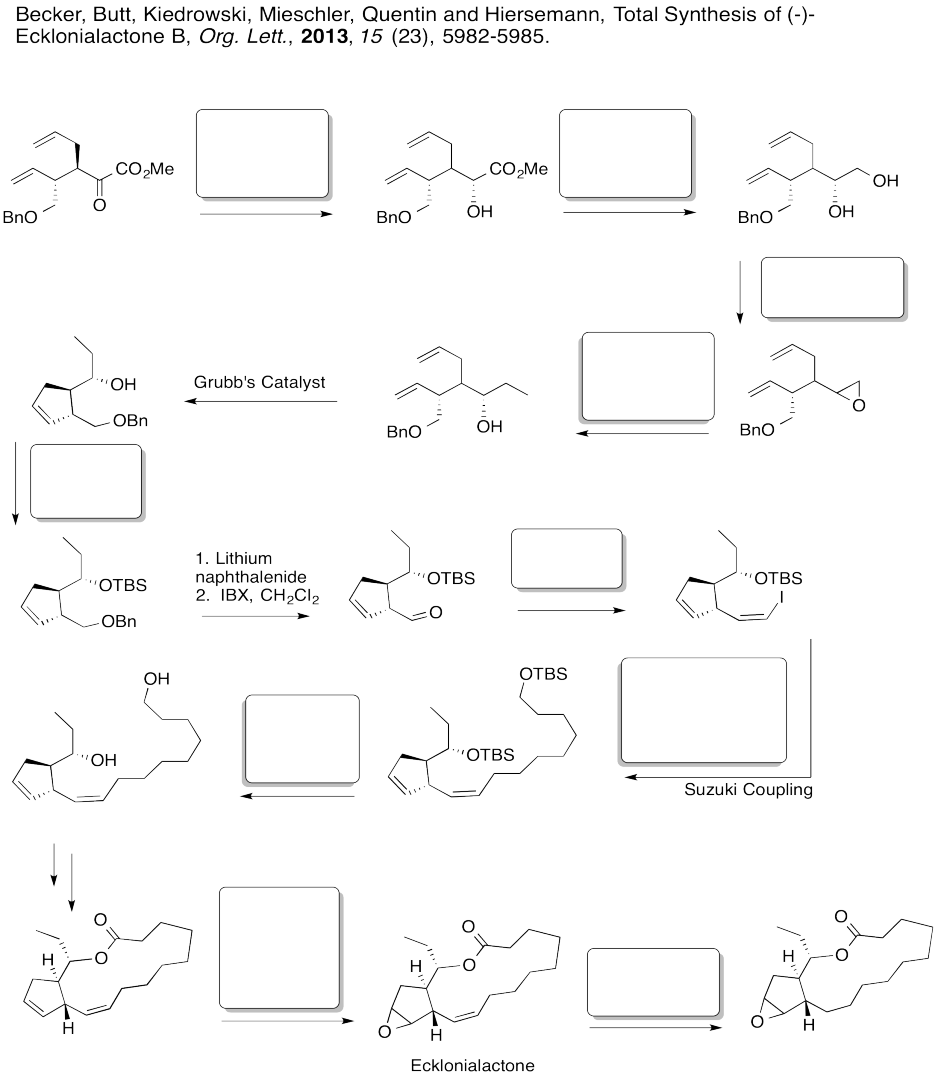
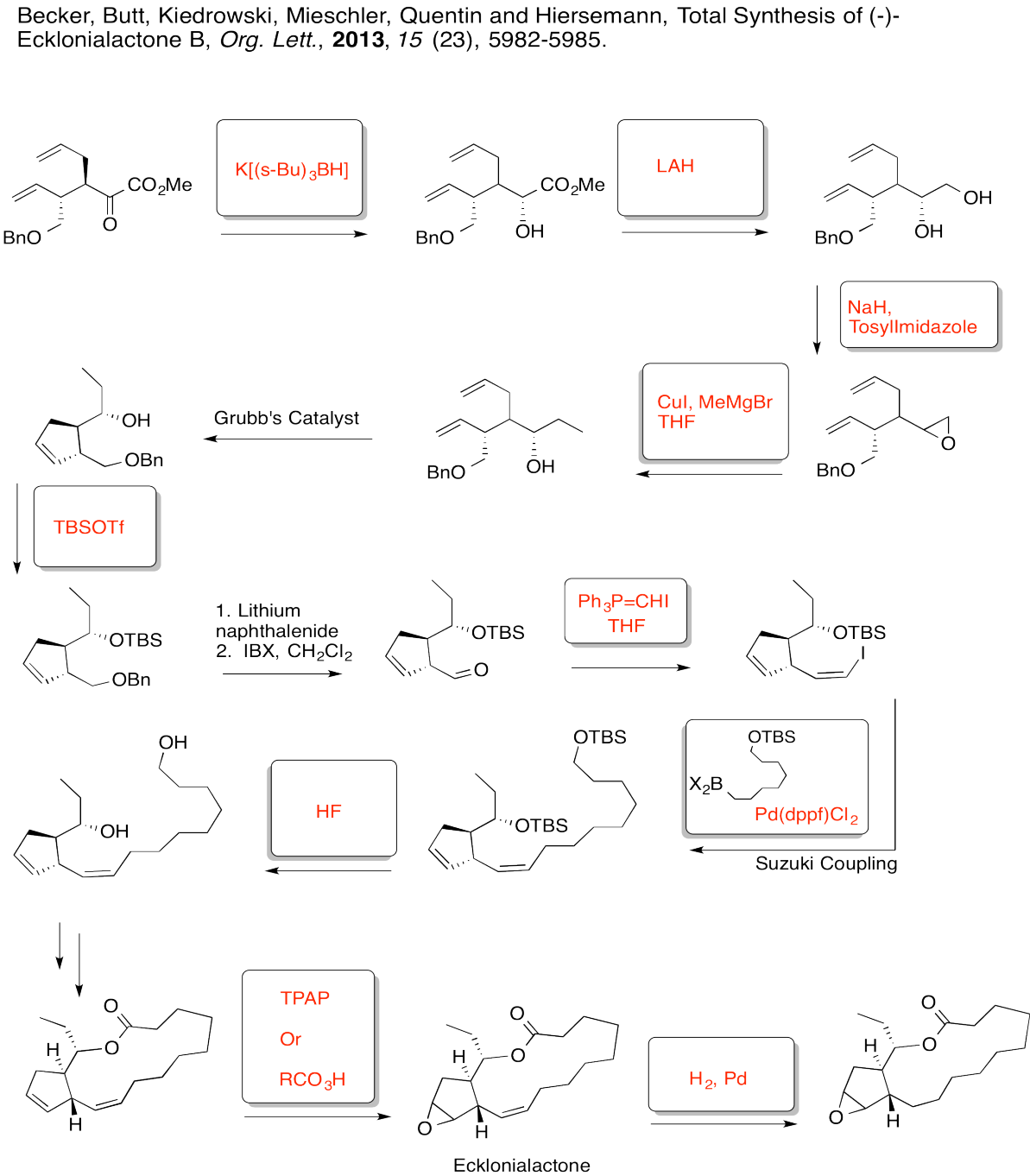
- Responder
-
Rellene las casillas en la siguiente síntesis.
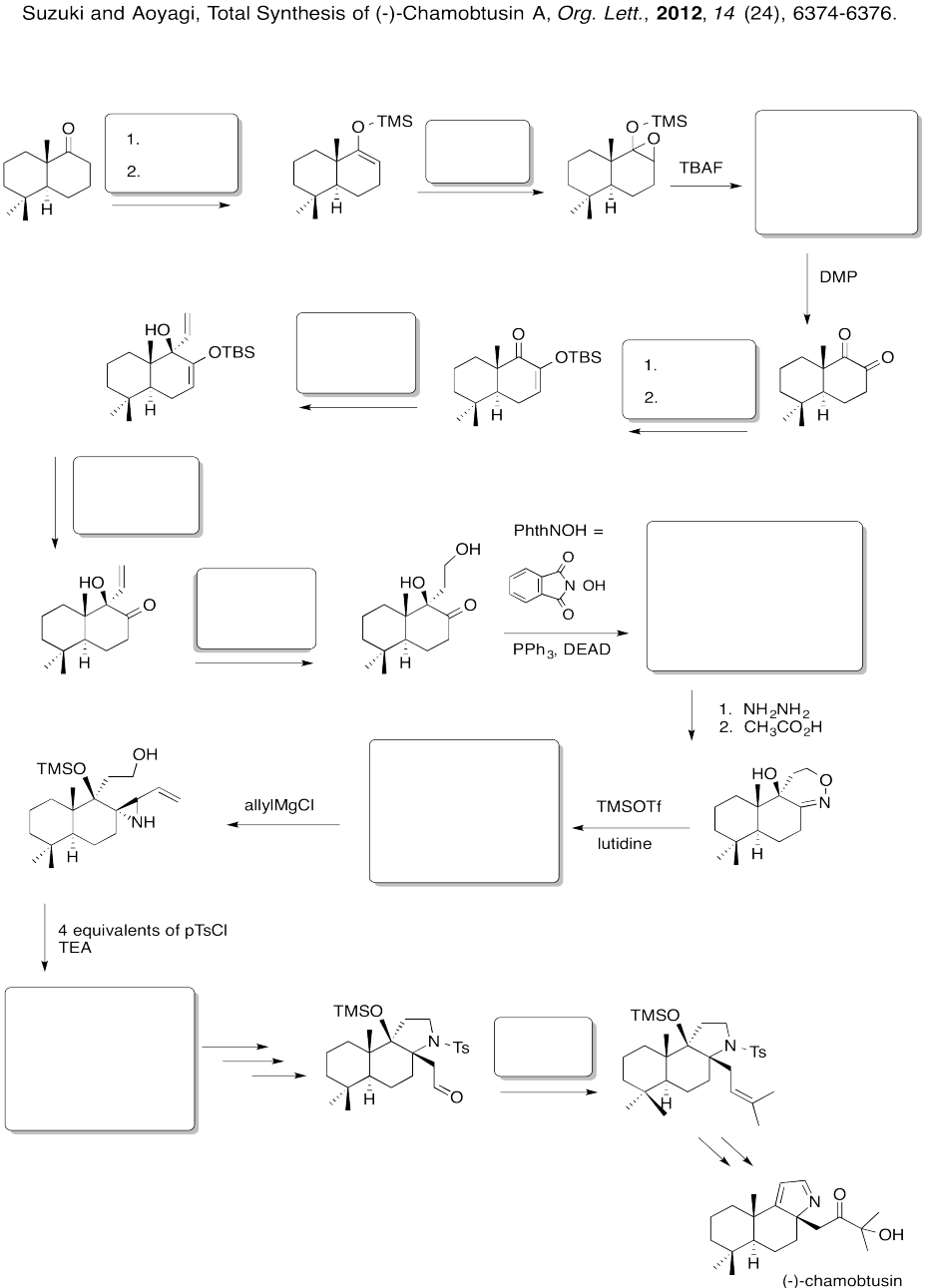
Responder-
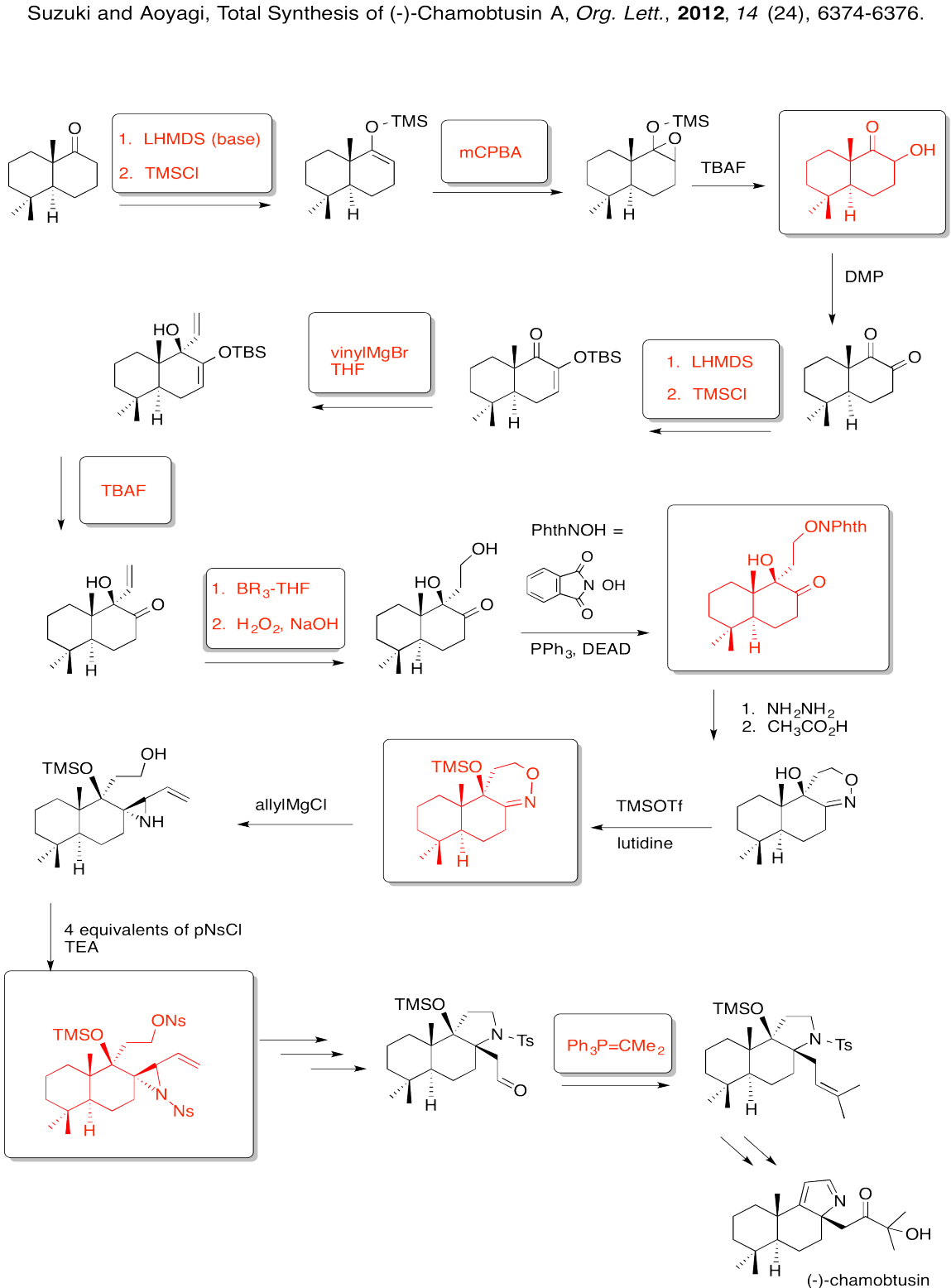
Rellene las casillas en la siguiente síntesis.
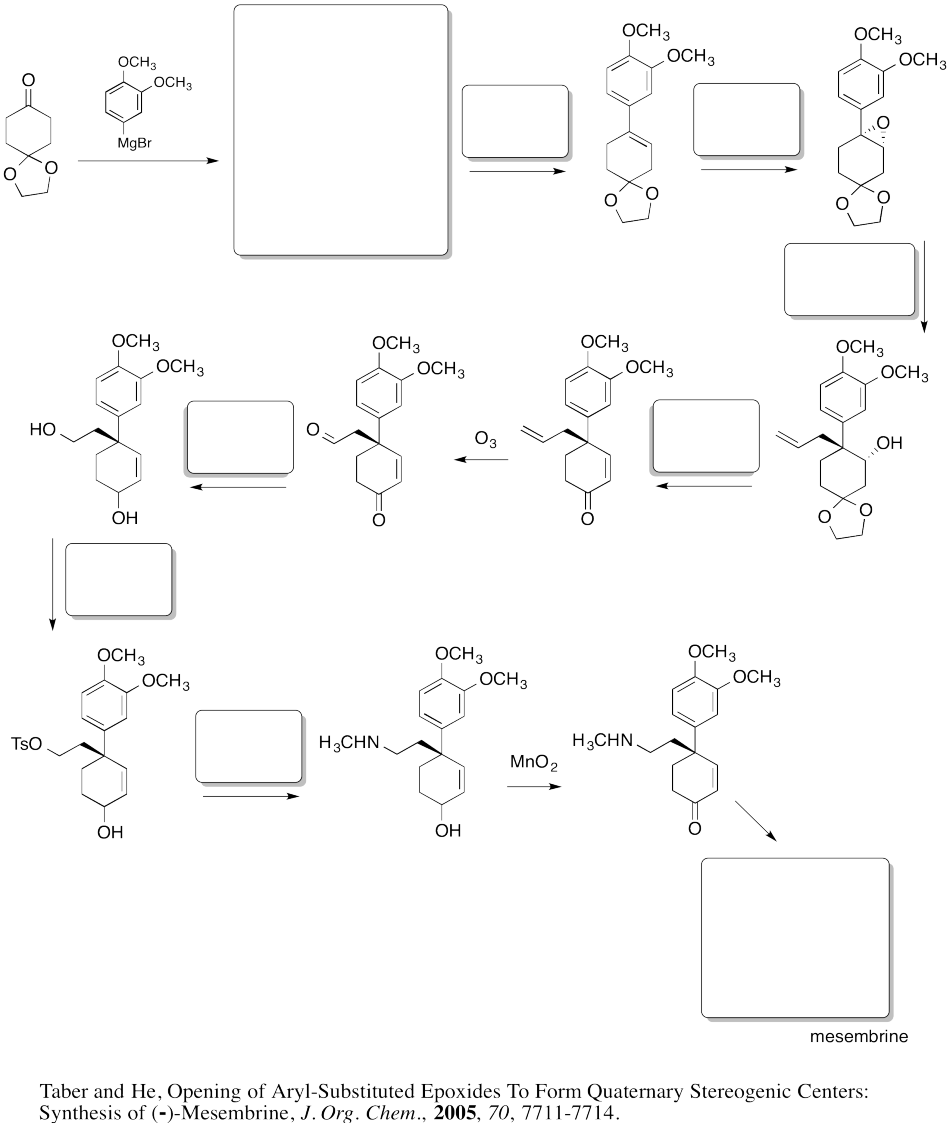
- Responder
-