6.9: Ciclopropanación
- Page ID
- 78669
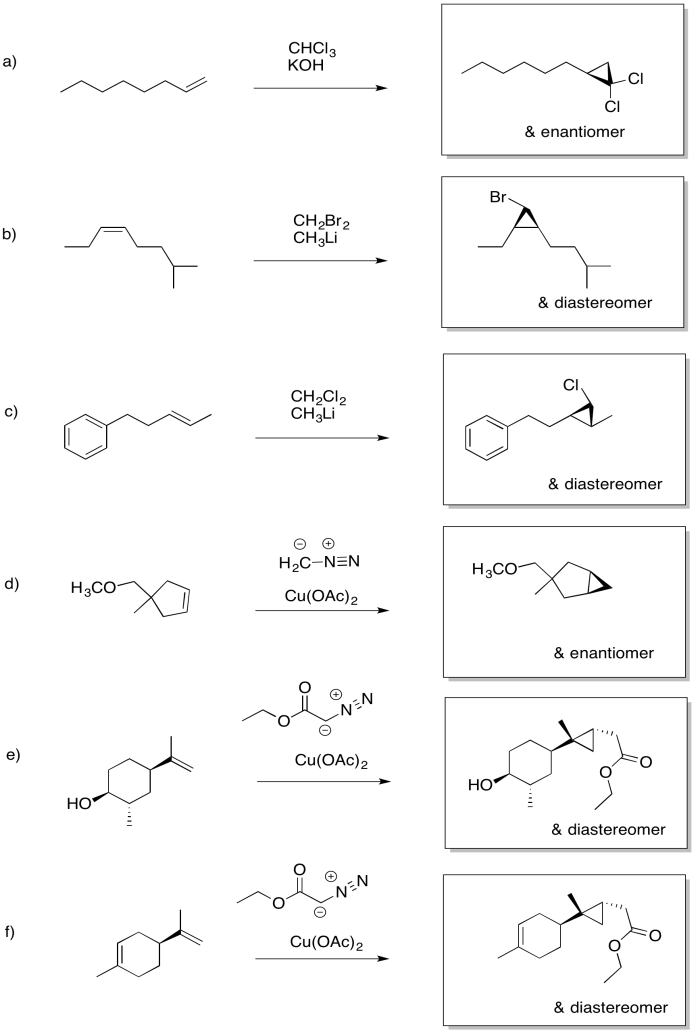
Anteriormente, vimos que los alquenos pueden donar sus electrones pi a electrófilos de oxígeno en peróxidos. El resultado es la transferencia de un átomo de oxígeno del peróxido al alqueno. Se forma un anillo epóxido u oxirano.
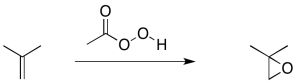
Otro ejemplo relacionado es la ciclopropanación de un alqueno. En la ciclopropanación de alqueno, un alqueno se convierte en un ciclopropano. Se dona un átomo de carbono al alqueno.
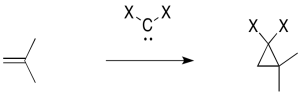
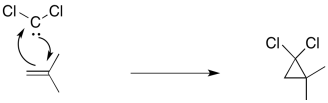
Un ejemplo clásico es la adición de diclorocarbeno a un alqueno.
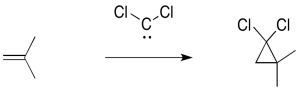
Los carbenos son electrófilos porque el carbono no tiene octeto. El carbono tiene sólo dos enlaces y un par solitario. Eso son sólo tres electrones, no ocho.
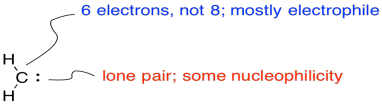
Por otro lado, hay una pareja solitaria. El carbeno también puede ser nucleófilo.
La reacción implica la adición del alqueno a un carbeno electrófilo. Al mismo tiempo, esa pareja solitaria puede donar de vuelta, para que en realidad no se forme un carbocation.
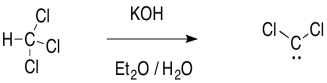
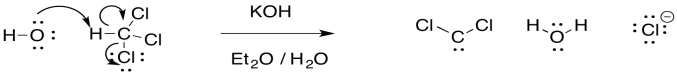
El carbeno a veces se forma a través de una inusual eliminación “alfa” en presencia de una base fuerte. Las bases fuertes suelen ser reactivos de alquillitio, como CH 3 Li, pero KOH funcionará con algunos compuestos.
La reacción es inusual porque un protón se abstrae de un átomo de carbono, y un grupo lápida se aparta del mismo átomo. Es mucho más común ver al grupo saliente apartarse del siguiente átomo sobre, en una beta-eliminación.
Los carbenos se forman frecuentemente a partir de compuestos diazoicos. Estos incluyen diazometano, CH 2 N 2.
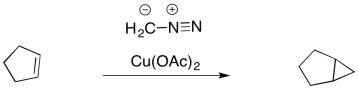
En compuestos diazo, un grupo N 2 está colgando de un hilo. Se puede dejar fácilmente, resultando en un carbeno. Esta reacción suele ser promovida por catalizadores metálicos, como las sales de cobre (II).
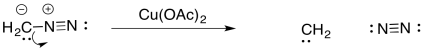
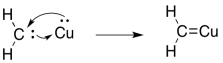
El carbeno, CH 2, es incluso menos estable que CCl 2. Sin embargo, en presencia de sales metálicas, se puede estabilizar como un complejo de carbeno metálico.
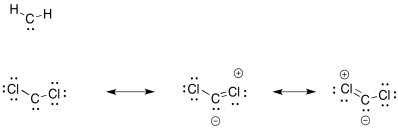
¿Por qué un carbeno es más estable con átomos de cloro unidos?
- Responder
-
Los cloros pueden (débilmente) compartir sus electrones para llenar el octeto sobre carbono.
Algunos complejos metálicos de carbeno, como el que se muestra a continuación, son particularmente estables. Explique por qué.
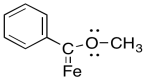
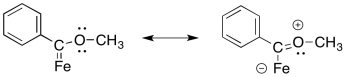
- Responder
-
El oxígeno puede π-donar para ayudar a llenar el octeto en el carbono.
Los carbenos libres, los que no están unidos a un ion metálico, suelen ser tan inestables que solo pueden generarse brevemente en solución antes de que reaccionen con un nucleófilo, como un alqueno. Los carbenos de Arduengo, como el de abajo, son lo suficientemente estables como para ser puestos en una botella y guardarlos en el refrigerador. Explique por qué.
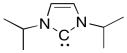
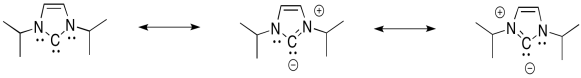
- Responder
-
No sólo pueden los nitrógenos π-donar para ayudar a llenar el octeto sobre carbono, sino que este es un sistema aromático. Es plano, cíclico, totalmente conjugado, con un número impar de pares de electrones en el sistema π.
Predecir los productos de las siguientes reacciones.
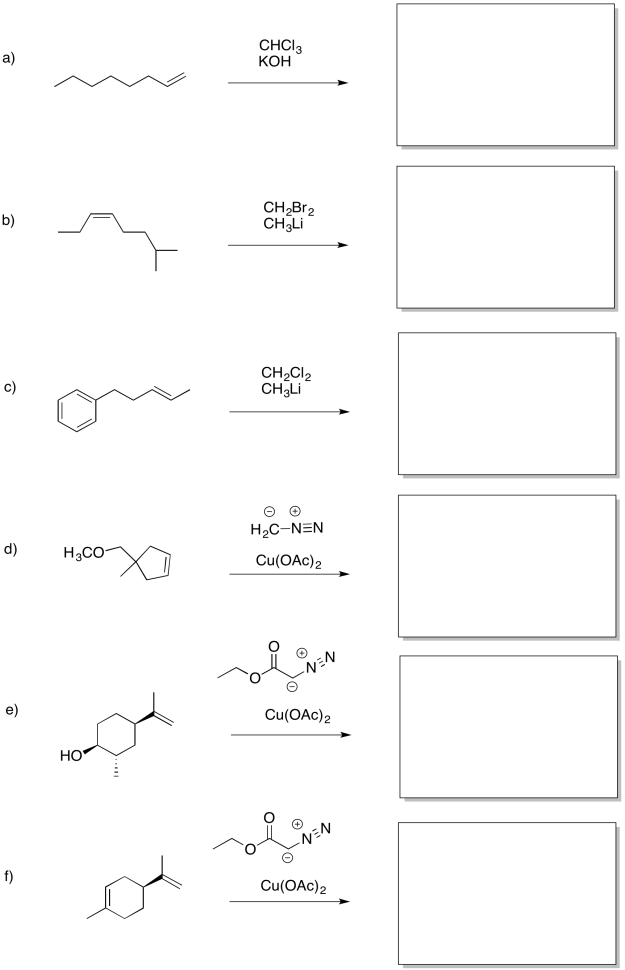
- Responder
-