6.10: Oxidaciones de alquenos
- Page ID
- 78731
Hay una serie de otras adiciones a los alquenos que ocurren a través de mecanismos concertados. Las oxidaciones de alquenos se encuentran entre las más útiles sintéticamente de estas reacciones porque son capaces de convertir materiales de partida de hidrocarburos simples en compuestos que contienen oxígeno. Los grupos funcionales heteroatómicos resultantes pueden abrir nuevas vías de utilidad sintética o pueden reflejar aspectos de un producto natural objetivo.
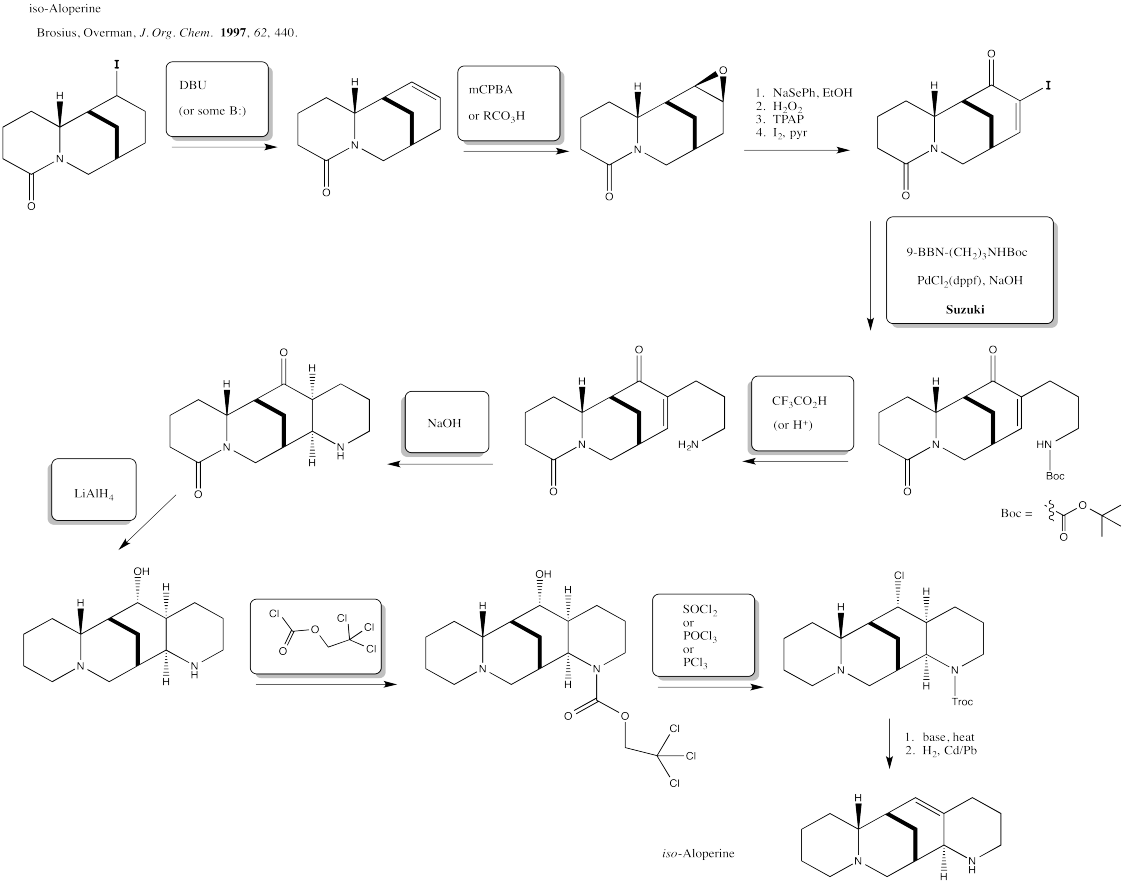
Las tres oxidaciones de alquenos más comunes son la epoxidación, la dihidroxilación y la escisión oxidativa.
Epoxidación
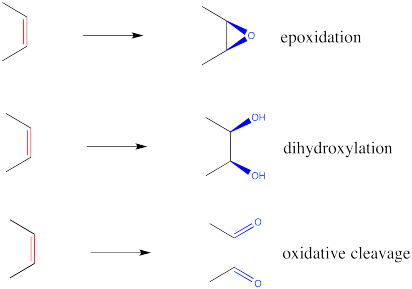
La epoxidación es un método para convertir un alqueno en un epóxido. El reactivo requerido es siempre una especie de peroxo. Una especie de peroxo se parece mucho a un compuesto normal que contiene oxígeno, pero con un oxígeno extra en él. Históricamente, el reactivo más común fue el ácido m-cloroperbenzoico (m CPBA).
Sin embargo, también se pueden utilizar otros reactivos, como el peróxido de hidrógeno (H 2 O 2) o el hidrógeno persulfato de potasio (KHSO 5), comercializados bajo el nombre comercial Oxone. Estos últimos métodos se consideran “más verdes” o más amigables con el medio ambiente, ya que los poductos laterales (agua o sulfato, respectivamente) son bastante inocuos. Estos métodos son generalmente más lentos y a menudo se usan con un catalizador. Los catalizadores utilizados con peróxido de hidrógeno incluyen especies ácidas de Lewis como el tungstato de sodio (Na 2 WO 4) necesarias para activar el peróxido. Una reacción similar usando titanio (IV) y ligandos quirales conduce a un epóxido enantioméricamente puro; esta reacción se llama "Epoxidación Sharpless”. Con la oxona, las cetonas se utilizan como catalizadores de transferencia de oxígeno en un método denominado “oxidación Shi”.
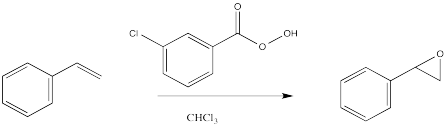
La electrofilicidad de los compuestos peroxi continúa un tema visto en halógenos como el cloro y el bromo. Cuando dos átomos de oxígeno están conectados entre sí, uno de los puede actuar como electrófilo, al igual que cuando dos halógenos están conectados entre sí.
Durante la epoxidación, el compuesto peroxi simplemente entrega su oxígeno extra al doble enlace. El átomo de oxígeno acepta un par de electrones del doble enlace y dona un par de electrones al doble enlace al mismo tiempo.
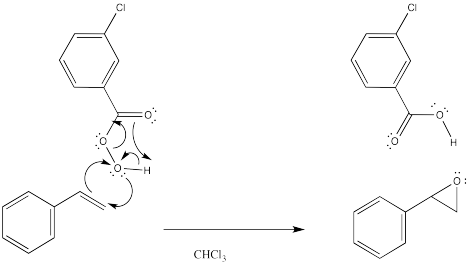
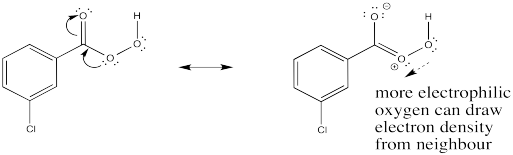
La reacción tiene algo en común con las reacciones pericíclicas. En las reacciones pericíclicos y otras reacciones que tienen lugar bajo el control de la simetría orbital, es común ver seis electrones circulando en un anillo como característica central del mecanismo. Esta imagen es una reminiscencia de la estructura aromática del benceno. De hecho, se piensa que esa estabilización aromática juega un papel en la estabilización de los estados de transición de diversas reacciones. En este caso, los tres pares de electrones implican la entrega del oxígeno, la transferencia de protones y la donación de π al carbonilo en mCPBA. Sin embargo, es posible que no se encuentre un conjunto similar de flechas en la reacción del peróxido de hidrógeno.
Mostrar cómo el carbonilo en m CPBA puede ayudar a activar el oxígeno donante hacia la reacción con el alqueno.
- Contestar
-
Mostrar cómo un ion titanio (IV) puede ayudar a activar el oxígeno donante en peróxido de hidrógeno hacia la reacción con el alqueno.
- Contestar
-
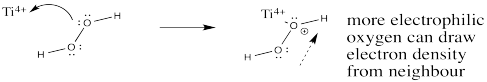
La naturaleza electrofílica del compuesto peroxi se observa en la selectividad de la reacción de epoxidación. Los alquenos que son más ricos en electrones tienden a reaccionar mucho más rápido que otros. Por ejemplo, los alquenos más sustituidos, a menudo considerados ricos en electrones, pueden epoxidarse selectivamente en presencia de otros alquenos.

Además, aunque en ocasiones las enonas pueden epoxidarse, la reacción es generalmente más lenta que con alquenos regulares. Por supuesto, el carbonilo unido al alqueno en una enona hace que el alqueno sea muy pobre en electrones.
Parte de la evidencia de un mecanismo concertado de epoxidación proviene de la estereoquímica de la reacción. En general, si se epoxida un cis-alqueno, los dos grupos que estaban cis entre sí en el alqueno permanecen cis entre sí en el epóxido. Si los grupos comienzan trans entre sí, permanecen trans en el epóxido. Al igual que en la hidroboración, no hay oportunidad de que estas relaciones estereoquímicas cambien.

Dihidroxilación
La dihidroxilación es la adición de un grupo OH a ambos lados de un alqueno. Por lo general, cuando se usan reactivos como el tetroxido de osmio, los grupos hidroxilo se agregan a la misma cara del doble enlace. Por lo tanto, esta reacción se denomina una sin-dihidroxilación.
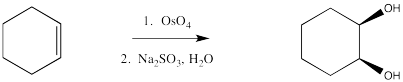
Los ésteres de osmato pueden aislarse de esta reacción, como resultado de la adición concertada de tetroóxido de osmio al alqueno. Una vez más, este paso puede compararse con una reacción pericíclica. Sin embargo, el éster de osmato generalmente se descompone in situ mediante la adición de un “agente reductor” como el sulfito de sodio.
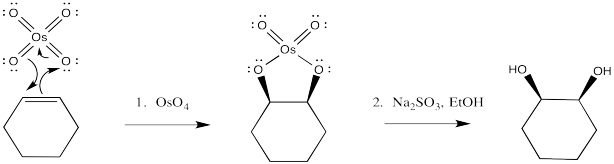
Una vez más, la naturaleza concertada de la reacción se ve en la estereoquímica del producto. El hecho de que ambos oxígenos, que provienen del osmio, se entreguen a la misma cara del alqueno sugiere que se agreguen al mismo tiempo.
No es raro que los átomos de oxígeno formen enlaces π adicionales a metales de transición como el osmio. En este caso, podríamos pensar en el osmio como la formación de un complejo de 18 electrones como resultado. Sea o no que ese contribuyente de resonancia sea una representación importante del tetroóxido de osmio, es un dispositivo útil para pensar en cómo el oxígeno podría formar una atracción inicial hacia el alqueno.
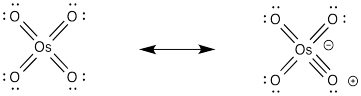
Debido al alto costo del tetroxido de osmio, su potente toxicidad y su alarmante propensión a sublimarse rápidamente, se prefieren otros reactivos. Sin embargo, es bastante común usar una cantidad catalítica de tetroóxido de osmio, junto con un co-oxidante. Los co-oxidantes pueden ser cosas como sales de Fe (III) y aire, aunque a menudo se usa peróxido de hidrógeno.
Escisión oxidativa: Ozonólisis
La ozonólisis da como resultado la escisión completa de un doble enlace en dos partes. Los fragmentos resultantes están cada uno rematados por un átomo de oxígeno.
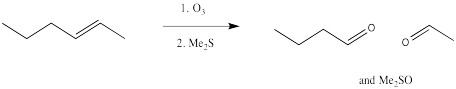
Una vez más, esta reacción comienza con una adición concertada del ozono al alqueno.
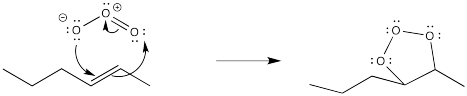
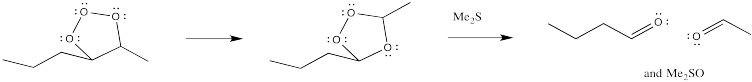
Sin embargo, el aducto primero formado, denominado molozónido, se reorganiza rápidamente a un segundo producto, denominado ozónido. Ambas especies pueden ser aisladas. Sin embargo, en la práctica esto rara vez se hace debido a la espantosa tendencia de los molozónidos y ozónidos a explotar inesperadamente. En cambio, el ozónido se descompone mediante la adición de un agente reductor, como sulfuro de dimetilo o zinc, dejando atrás dos fragmentos que contienen oxígeno.
Rellene los reactivos para las siguientes oxidaciones de alquenos.
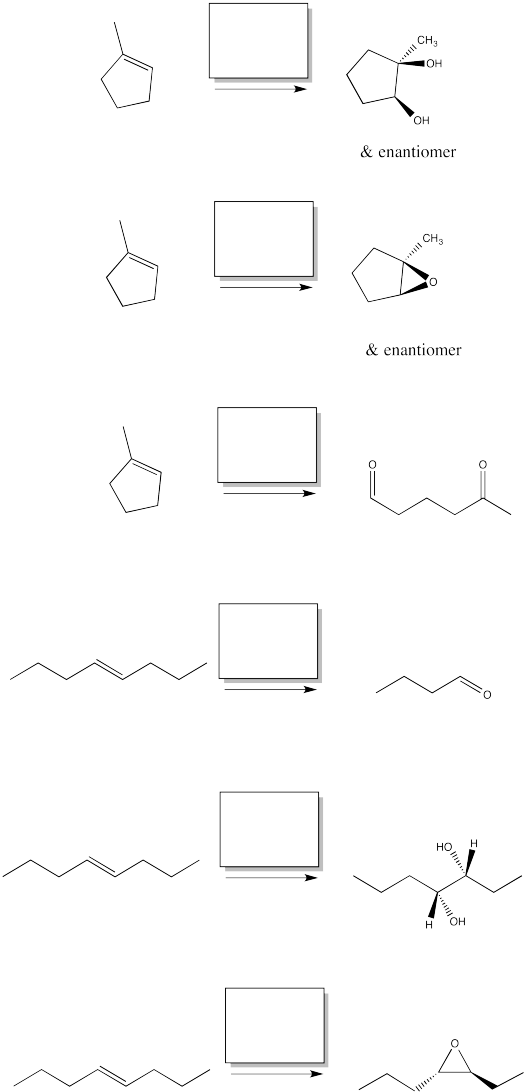
- Contestar
-
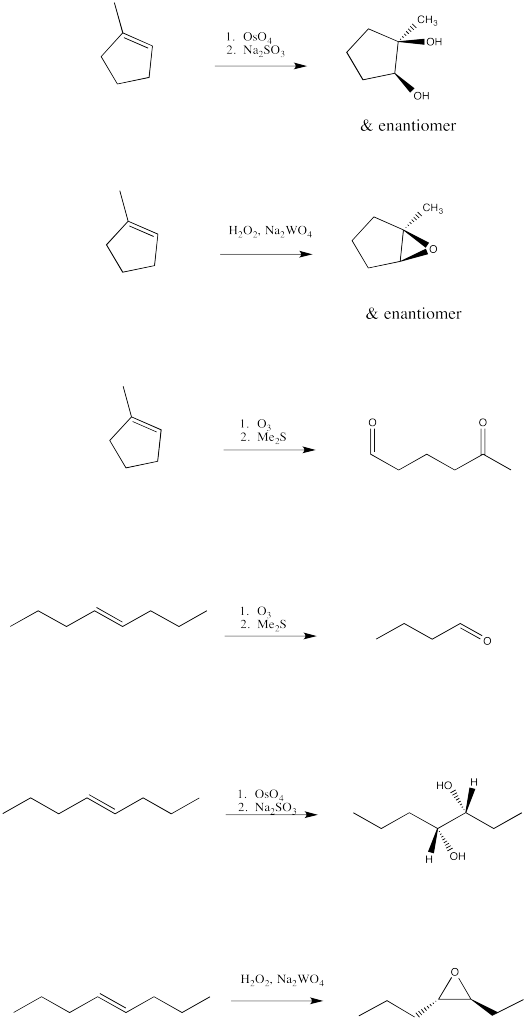
Rellene los productos de las siguientes oxidaciones de alquenos.
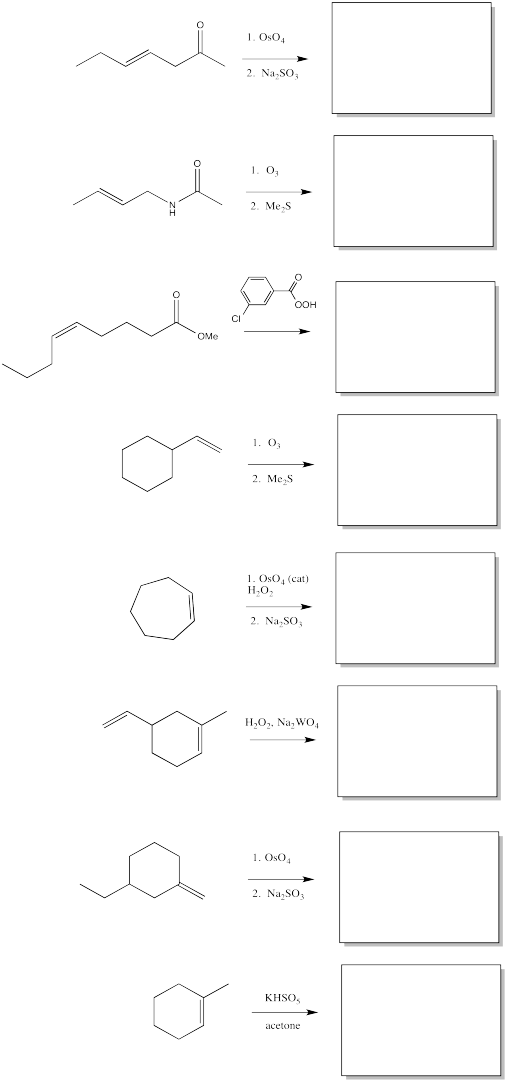
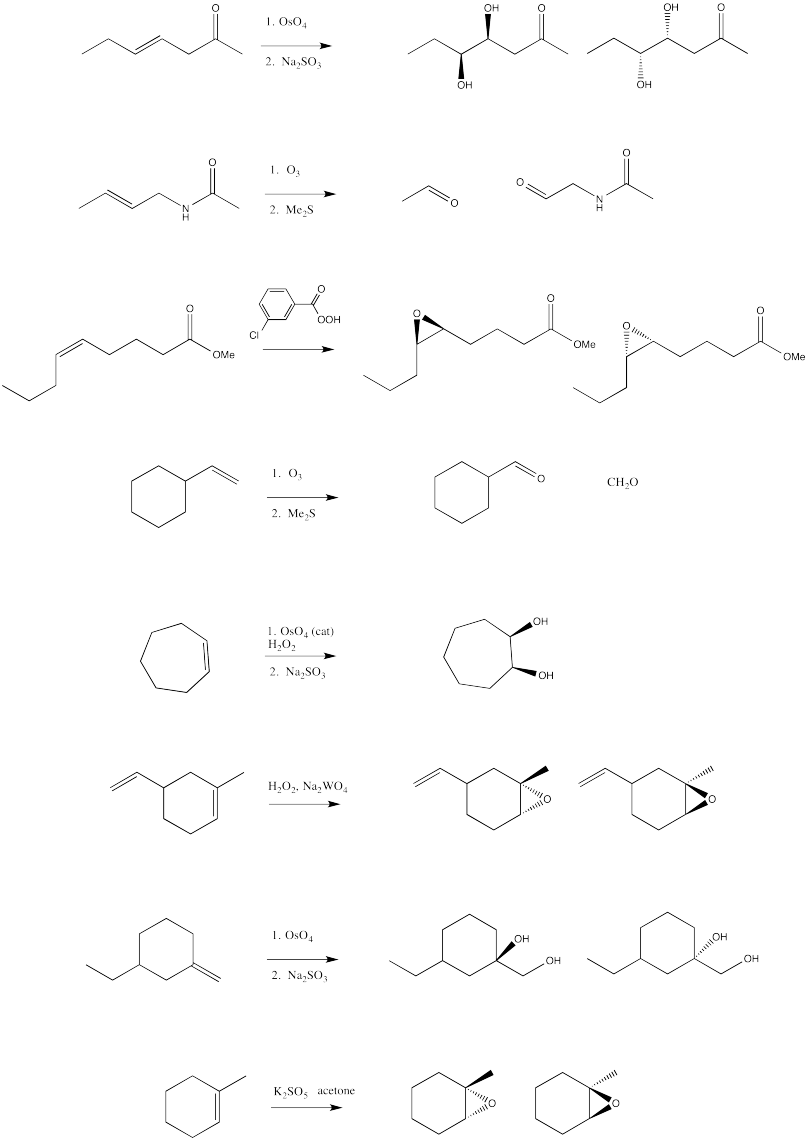
- Contestar
-
Rellene los espacios en blanco en la siguiente síntesis.
- Contestar
-