6.12: Polimerización de alquenos - Métodos catiónicos vivos
- Page ID
- 78713
El problema con los intermedios reactivos como los cationes es que son tan reactivos. A veces, los cationes hacen cosas inesperadas. Por ejemplo, ya hemos visto cómo frecuentemente sufren cambios de 1,2-hidruro. Pueden someterse a adición nucleofílica, pero pueden sufrir eliminación en su lugar. En ocasiones, puede haber competencia entre diferentes nucleófilos que compiten para combinarse con el catión; puede terminar con una mezcla de productos.
En otras palabras, todo tipo de cosas podrían salir mal durante una polimerización catiónica.
¿Cuáles son las consecuencias de una polimerización que salió mal? El mayor problema es que la polidispersidad se vuelve demasiado alta. Las cadenas poliméricas obtenidas en la reacción no son de tamaño uniforme; hay algunas cadenas mucho, mucho más largas así como algunas cadenas mucho, mucho más cortas.
Recuerde, la polidispersidad es un componente importante de cómo pensamos sobre el tamaño de las cadenas poliméricas. Debido a que los polímeros son una colección de moléculas formadas a través del crecimiento en tándem de cadenas, muchas cadenas que crecen al mismo tiempo, siempre tendremos una gama de longitudes de cadena. La polidispersidad nos dice cuán amplia es esa distribución. Si la polidispersidad es demasiado alta, significa que hay un rango demasiado grande de longitudes de cadena (y pesos moleculares) en el material. Debido a que las propiedades físicas de los polímeros dependen en parte de la longitud de la cadena, cuando la polidispersidad es demasiado alta, tenemos cada vez menos control sobre las propiedades del material. Puede que no funcione de la manera que queremos que se desempeñe.
¿Por qué estas reacciones inesperadas de cationes conducen a una gama más amplia de pesos moleculares? Es porque a menudo detienen que crecer una cadena. A estas reacciones las llamamos “eventos de terminación aleatoria”.
Como resultado de eventos de terminación aleatoria, algunas cadenas dejan de crecer cuando aún son demasiado cortas. Otras cadenas siguen creciendo y engullen el resto del monómero. Hay monómero extra sobrante, porque algunas cadenas no usaban las suyas, por lo que las cadenas que siguen creciendo se alargan extra. Hay una gama muy amplia de longitudes de cadena.
Un síntoma secundario de este problema es que el peso molecular medido del polímero a veces es mayor de lo esperado. Eso no tiene ningún sentido al principio; si las cadenas dejan de crecer, ¿cómo puede el peso molecular ser mayor de lo que pensábamos que sería? ¿No sería más bajo?
Bueno, a veces eso es cierto. Si todas las cadenas dejaran de crecer temprano, entonces el peso molecular no alcanzaría nuestras expectativas, y quedaría mucho monómero sobrante. Sin embargo, estamos hablando de terminación aleatoria. Algunas cadenas dejan de crecer. Otros no.
Recuerda que al final de una polimerización, el polímero suele precipitarse. Todos los monómeros sobrantes permanecen disueltos y se decantan. Al mismo tiempo, muchas de las cadenas muy cortas también permanecen disueltas, y también se pierden. Nos quedamos con las cadenas más grandes, y el peso promedio de las cadenas se ha desplazado al alza. Además, existen métodos físicos para medir el tamaño de los polímeros que están más fuertemente influenciados por las moléculas más grandes, y ese hecho puede inflar artificialmente nuestra estimación del peso molecular.
En contraste con este escenario, una “polimerización viva” es un proceso en el que las cadenas poliméricas siguen creciendo uniformemente y el peso molecular concuerda estrechamente con las expectativas. Además, una vez terminada una polimerización viva, se puede agregar más monómero y las cadenas comenzarán a crecer nuevamente. Las cadenas en crecimiento no se apagan y dejan de crecer. Cuando se les acaba el monómero, permanecen “latentes” (es como si estuvieran durmiendo) hasta que haya más monómero disponible.
Una estrategia clave para la polimerización viva es limitar el número de especies reactivas en un momento dado. Cuantas menos especies reactivas haya, menos eventos de terminación aleatoria ocurrirán.
Ese escenario podría parecer plantear un problema diferente: si hay menos especies reactivas, entonces hay menos cadenas de crecimiento. Si hay menos cadenas de crecimiento, ¿la polimerización no será mucho más lenta? Sí, va a ser más lento. Estamos buscando un punto óptimo en el que la polimerización proceda a una velocidad razonable pero la tasa de terminación sea muy baja.
Sin embargo, hay una manera de mantener bajo el número de especies reactivas, pero aún así tienen muchas cadenas de crecimiento, o al menos potencialmente cadenas en crecimiento. Simplemente explotamos un equilibrio en el que las cadenas pasan parte de su tiempo realmente creciendo y parte de su tiempo latente.
La idea es tener un anión que pueda tapar el catión, para que tengamos un haluro de alquilo en lugar de un catión. En un caso muy sencillo, podríamos pensar en añadir algunas sales haluro a la reacción de polimerización. Los aniones haluro podrían unirse reversiblemente al intermedio catiónico, enviándolo a una fase latente. Ocasionalmente, el haluro se disociaría de nuevo, y el polímero volvería a crecer.
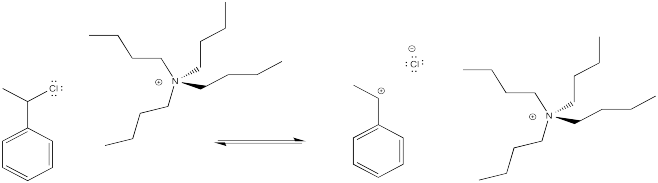
Sin embargo, el haluro debe salir de vez en cuando, produciendo un catión que pueda sufrir polimerización. Para ayudar a que el haluro salga, se podría emplear un ácido de Lewis. El siguiente ejemplo muestra cloruro de estaño (IV) agregado a la mezcla.
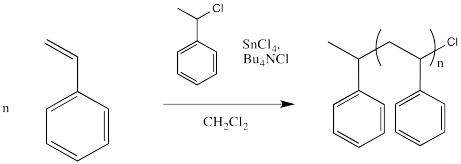
El haluro se coordina con el ácido de Lewis, que polariza el enlace carbono-halógeno. Los compuestos de estaño, hierro o titanio son algunos exampos de ácidos de Lewis que a veces se utilizan para este propósito, pero hay otros, también.
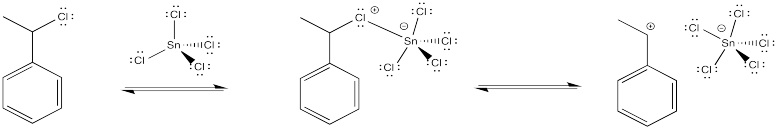
Este método en realidad puede cambiar ligeramente el mecanismo de la reacción. Tal vez el ion haluro nunca se va completamente, y el catión nunca se forma completamente. En cambio, puede haber suficiente polarización en presencia del ácido de Lewis para que el alqueno se dona al catión incipiente (casi formado).
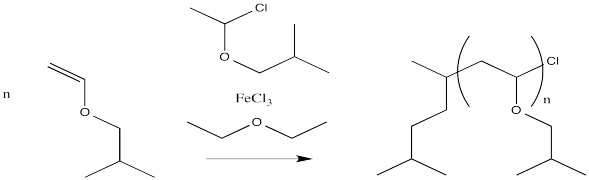
Proporcionar un mecanismo, con flechas, para la siguiente reacción de polimerización catiónica viva.