6.13: Polimerización Ziegler-Natta
- Page ID
- 78714
El polietileno y el polipropileno son dos materiales enormemente importantes en el mercado. El hecho de que su uso continúe persistiendo a pesar de preocupaciones ambientales legítimas es un testimonio de cuán útiles se han vuelto estos materiales a lo largo de los años.
El polietileno y el polipropileno se pueden considerar como polímeros de los alquenos, eteno y propeno muy simples. De hecho, de ahí es exactamente de donde provienen estos materiales.
Dibujar el primer intermedio formado después de la etapa de iniciación en la polimerización catiónica de:
- eteno
- propeno
A diferencia de otros polímeros de alquenos que hemos visto, el polietileno y el polipropileno no se polimerizan a través de métodos catiónicos.
En cambio, estos monómeros se encadenan a través de un proceso llamado "polimerización Ziegler-Natta”. Este proceso lleva el nombre de un químico alemán e italiano a quienes se les atribuye de forma independiente su desarrollo en la década de 1950.
En la polimerización Ziegler-Natta, los monómeros se tratan con un catalizador, como una mezcla de cloruro de titanio (o compuestos relacionados, como el cloruro de oxovanadio) con trietilaluminio (o trimetilaluminio). A menudo se agregan otros componentes, como el cloruro de magnesio, para modificar el catalizador y mejorar el rendimiento. La mezcla aquí descrita produce un catalizador heterogéneo; es un sólido insoluble.
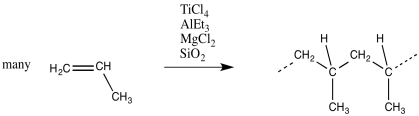
Ahora bien, el catalizador no es realmente cloruro de titanio, porque todos estos componentes reaccionan juntos para hacer algo nuevo. Exactamente lo que hacen puede ser difícil de determinar. Es un gmish complicado.
A pesar de la complicada mezcla de catalizadores, sí sabemos un poco sobre el mecanismo de reacción. En parte esta información proviene de estudios de compuestos modelo. Los compuestos modelo son más simples que los catalizadores industriales, pero aún tienen algunas características estructurales en común con sus primos trabajadores. Tienen lo suficiente en común para poder llevar a cabo catálisis de polimerización, aunque tal vez no tan bien como los pesos pesados industriales.
Entonces, ¿qué creemos que pasa? Parece bastante claro que una de las cosas que hace el trialquilaluminio es proporcionar un grupo alquilo al titanio. Eso no debería ser demasiado sorprendente. El trietilaluminio, como el etillitio o el bromuro de etilmagnesio, debe ser una fuente de grupos etilo nucleofílicos. El tetracloruro de titanio debería ser un electrófilo bastante bueno, completo con grupos salientes de haluro. Podemos imaginar al menos uno de esos cloruros siendo reemplazado por un ligando de etilo.
Proporcionar un mecanismo para la etilación de tetracloruro de titanio con trietilaluminio.
El siguiente paso, presumiblemente, podría ser la unión de un ligando alqueno al metal de transición.
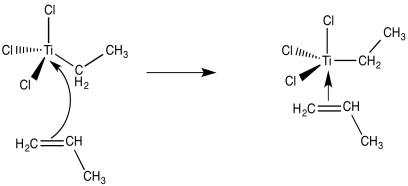
Ahora estamos viendo un compuesto organometálico de transición. Deberíamos estar pensando en los mecanismos de reacción organometálicos. Por ejemplo, una inserción 1,2-del alqueno en el enlace metal-carbono proporcionaría un nuevo alquilo metálico.
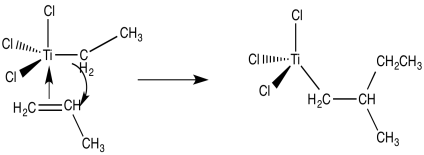
A partir de ahí, y usando estos mismos pasos elementales en sucesión, es fácil imaginar cómo podría ocurrir la polimerización del propeno. La unión de un alqueno adicional, seguido de la inserción 1,2-del propeno en el enlace metal-carbono, da como resultado la formación del dímero de propeno (con un grupo terminal metilo).
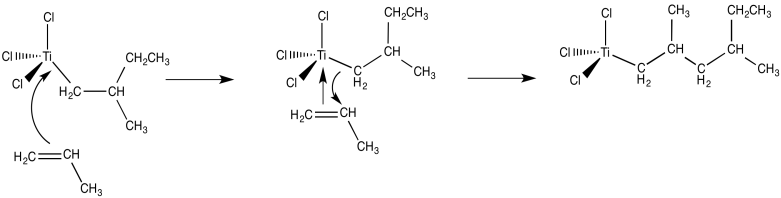
- El mecanismo de polimerización Ziegler-Natta implica la unión de alquenos e inserción en enlaces metal-carbono
Hagamos una pausa por un momento y veamos un poco más de cerca el papel del compuesto de aluminio. Este tema es periférico a la adición electrofílica aunque importante para el tema de la catálisis.
En catálisis, a veces se agregan “promotores” y “soportes” para mejorar la función catalizadora. Podrían hacerlo de varias maneras. Pueden participar directamente en la reacción, proporcionando sitios ácidos o básicos de Lewis adicionales, de la misma manera que los residuos de aminoácidos que rodean el sitio activo de una enzima pueden ayudar a catalizar una reacción. Pueden desempeñar un papel más sutil, afectando las propiedades físicas del catalizador (como su solubilidad) o incluso sintonizando las propiedades químicas del catalizador. Por ejemplo, tal vez el promotor añada un poco más de densidad de electrones al catalizador, haciéndolo un poco menos electrófilo. Eso podría hacer que el catalizador sea más estable; tal vez se vuelva más selectivo, reaccionando con más cuidado en lugar de con abandono salvaje. A lo mejor hace que el catalizador dure más tiempo.
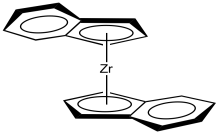
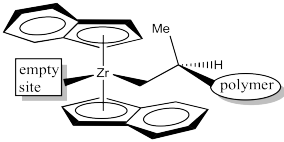
Aunque la polimerización clásica de Ziegler-Natta implica catálisis heterogénea, se han desarrollado muchas variaciones, incluyendo sistemas modelo para estudiar los fundamentos de la reacción, así como otros catalizadores homogéneos en funcionamiento. Una variación muy exitosa, desarrollada por Walter Kaminsky en la Universidad de Hamburgo, utiliza Cp 2 ZrCl 2 como catalizador y metilalumoxano (MAO) como promotor. Esta especie de circonio, en la que el átomo de circonio está encajado entre dos ligandos ciclopentadiently, se llama comúnmente un “zirconoceno”.
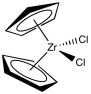
La MAO es otra especie mal definida. Se obtiene tratando trimetilaluminio con un rastro de humedad. Si recuerdas algo sobre reactivos Grignard o alquillitios, podrías pensar que no es tan buena idea. En verdad, es una idea aún peor con el trimetilaluminio con cualquiera de esos otros dos alquilos metálicos. El trimetilaluminio se descompone rápidamente en otra cosa, una especie mal definida llamada “metilalumoxano”.
Lo que sabemos sobre la estructura de MAO puede ser un poco confuso. Una vez más, se puede arrojar algo de luz sobre el tema a través de estudios modelo. En algunos hermosos trabajos realizados en el laboratorio de Andrew Barron en la Universidad de Rice, se obtuvieron cúmulos de óxido de alquil aluminio mediante el cuidadoso tratamiento de tri (t butil) aluminio con agua. Resultaron agregados de óxido de aluminio, que contenían dos, tres, cuatro o seis átomos de aluminio, dependiendo de las condiciones de reacción. A continuación se muestra un dibujo de un ejemplo, un hexámero.
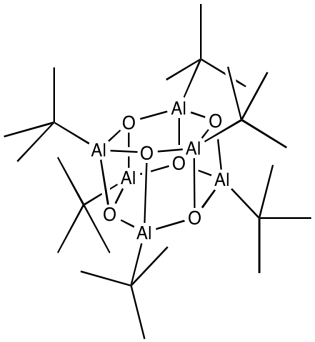
Algunos de los grupos alquilo han sido reemplazados por ligandos de óxido. Podemos imaginar que algo similar sucedería con el trimetilaluminio. El aluminio forma enlaces con el oxígeno, que hace puentes entre diferentes átomos de aluminio. La estructura es probablemente oligomérica en sí misma, formando grandes racimos de óxido de aluminio, aunque también debe retener algunos grupos metilo.
Proporcionar un mecanismo para la formación de un dímero de aluminio oxi-puenteado a través del tratamiento de trimetilaluminio con agua.
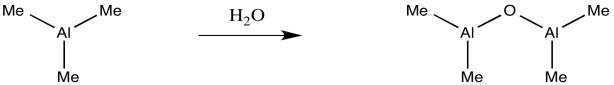
¿Por qué el tri (t butil) aluminio con agua produce estructuras bien definidas, mientras que el trimetilaluminio con agua provoca un desastre?
Al igual que en el catalizador original de Ziegler-Natta, las “cosas extra” juegan un papel importante. El MAO puede afinar las cualidades del catalizador de circonio, además de proporcionar un grupo alquilo.
Los catalizadores de “zirconoceno” de Kaminsky se utilizan comercialmente para producir polipropileno. Han sido particularmente importantes en el desarrollo de formas de controlar la estereoquímica de la reacción.
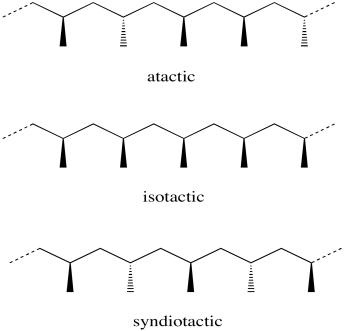
Considera una cadena de polipropileno. Cada grupo metilo que cuelga de la cadena principal zigzagueante del polímero podría tener dos orientaciones posibles. Podría estar saliendo adelante, mostrado con una cuña. Podría estar yendo hacia atrás, se muestra con un guión.
La relación estereoquímica entre esas cuñas y guiones se llama “tacticidad”. La tacticidad básicamente viene en tres sabores: aleatorios, alternantes e iguales. Un arreglo estereoquímico aleatorio se describe como un polímero “atáctico”. Si todos los grupos metilo están del mismo lado en una proyección regular en zig-zag de la columna vertebral (ya sea todas las cuñas o todos los guiones) la disposición se describe como “isotáctica”. Si en cambio los grupos metilo se alternan (cuña-guión-cuna-guion), el arranement se llama “sindiotáctico”.
En colaboración con Hans-Herbert Brintzinger de la Universidad de Konstanz, Kaminsky desarrolló catalizadores de circonoceno que podrían controlar la tacticidad de la cadena polimérica. El uso del zirconoceno original, Cp 2 ZrCl 2, resultó en un polímero atáctico. Sin embargo, los catalizadores de circonoceno modificados hacen selectivamente el polipropileno isotáctico o sindiotáctico. Veremos dos ejemplos. El primero se describe a veces como un catalizador C 2 y conduce a la formación de polipropileno isotáctico. El segundo a veces se describe como un catalizador de C s y conduce a la formación de polipropileno sindiotáctico. (Las etiquetas, C s y C 2, son grupos de puntos de simetría que describen la forma del catalizador, pero no vamos a entrar en esa idea más allá).
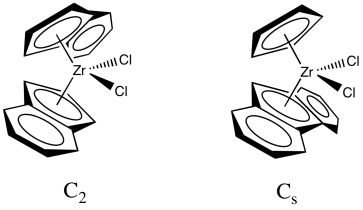
Uno de estos catalizadores (C 2 vs. C s) es quiral; el otro no lo es. ¿Cuál es cuál?
Veamos el catalizador C 2. Lo despojaremos hasta apenas la parte de circonoceno, dejando fuera los cloruros. Los cloruros probablemente se reemplazan por grupos metilo o se pierden por disociación (presumiblemente dejando Cp' 2 ZrCl + ion).
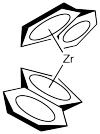
Rotaremos el fragmento catalizador para mirarlo desde el “frente”: la parte más abierta de la “cuña” de circonoceno, que es la dirección desde la que se acercaría un propeno recién coordinado.
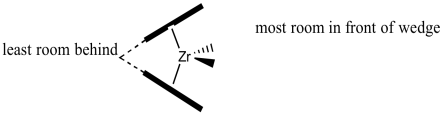
Aquí está la vista desde delante de la cuña. Esta es la superficie con la que interactuará el propeno a medida que se acerque.
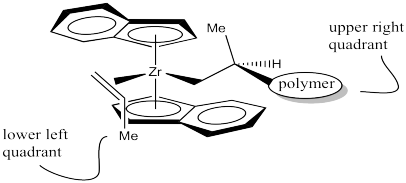
En nuestra discusión, utilizaremos el “análisis de cuadrantes”, una herramienta estándar para tratar de analizar el estereocontrol en la catálisis de metales de transición. En el análisis de cuadrantes, tratamos de imaginar diferencias en las barreras estéricas en cada uno de los cuatro cuadrantes alrededor del centro metálico. ¿Cómo influirá la disposición de grupos voluminosos en el abordaje de un sustrato?

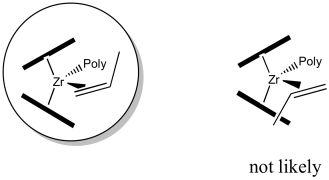
En el catalizador C 2 que estamos usando, parece que habrá más espacio en los cuadrantes superior derecho e inferior izquierdo. La parte superior izquierda e inferior derecha están bloqueadas por esos anillos. Cuando se acerca el propeno, la cadena polimérica presentará el mayor obstáculo, porque se está extendiendo una distancia significativa alejándose del átomo de circonio. Para minimizar las interacciones estéricas, la cadena puede extenderse hacia el cuadrante superior derecho relativamente vacío.
Alternativamente, el cambio de polímero podría extenderse hacia el cuadrante inferior izquierdo relativamente abierto, pero eso realmente nos daría el mismo dibujo, solo girado 180 grados.
Hacer un dibujo del complejo con el polímero en el cuadrante inferior izquierdo.
Al pensar en llevar el propeno al sitio de coordinación vacío junto a la cadena polimérica, hay dos preguntas que debemos considerar sobre la orientación. El primero es sobre qué extremo del alqueno llevar a la cuña. El propeno tiene dos extremos diferentes: un extremo tiene dos átomos de hidrógeno, mientras que el otro extremo tiene un hidrógeno y un metilo. Parece probable que el propeno se ajuste mejor si el extremo estrecho, el que tiene los dos átomos de hidrógeno, se extiende dentro de esa estrecha cuña.
Ahora necesitamos pensar cuál de las dos caras del propeno se coordinará con el circonio. Para pensar en las caras de propeno, sostenga la mano plana, con el pulgar formando un ángulo recto con el resto de su mano. El dorso de tu mano representa una cara del propeno; la palma de tu mano representa la otra. El propeno entrará de tal manera que se minimicen las interacciones estéricas.
Parece que la forma más fácil es como se muestra a continuación. El grupo metilo se coloca en el cuadrante inferior izquierdo. Se puede pensar en ello como mantener el grupo metilo alejado del anillo superior o mantenerlo alejado de la cadena del polímero, que también está en un cuadrante superior.
Si tu mano izquierda es propeno, hemos coordinado el dorso de tu mano al circonio, con el pulgar apuntando hacia abajo. Si hubiéramos coordinado tu palma, el pulgar estaría apuntando hacia arriba.
Una vez más, si empezamos con el polímero en el cuadrante inferior izquierdo, todo el dibujo apenas gira 180 grados. Sigue siendo la misma cara la que coordina (el dorso de tu mano izquierda).
Hacer un dibujo del complejo con el polímero en el cuadrante inferior izquierdo y el propeno coordinando hacia la derecha.
El siguiente evento es la inserción 1,2-del alqueno en el enlace metal-alquilo. Eso nos deja con la siguiente estructura. Observe que hemos formado un nuevo estereocentro. Debido a que el grupo metilo del propeno coordinado apuntaba hacia abajo, y el hidrógeno adyacente a él estaba por lo tanto hacia arriba, entonces en el nuevo estereocentro el metilo todavía está en la más baja de dos posiciones posibles y el hidrógeno está en la parte superior de dos posiciones posibles. Además, el metilo es empujado hacia atrás y hacia la izquierda porque el alquilo vino de la derecha.
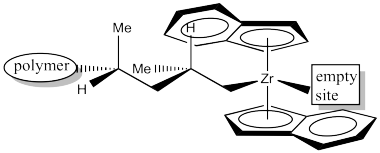
Para ayudar a realizar un seguimiento de ese paso de inserción, aquí hay un dibujo con etiquetas de color. El extremo estrecho del propeno ahora está unido al circonio a través de un enlace sigma. El extremo más ancho del proeno ha formado el nuevo centro quiral. El carbono que solía formar un enlace sigma con el circonio es ahora solo otro carbono a lo largo de la cadena de polímero en crecimiento. La parte más joven del polímero se encuentra en el extremo de crecimiento.
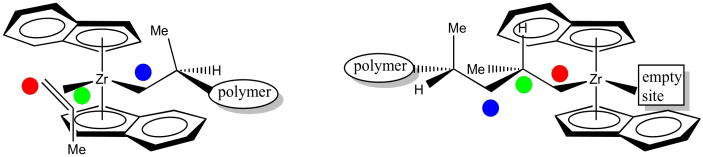
Cuando otro propeno se acerca para ocupar la posición vacía, se coordinará usando la misma cara que el propeno anterior.
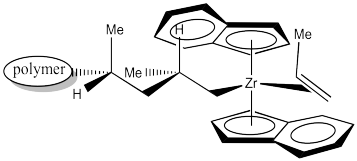
La inserción 1,2-produce un nuevo centro quiral. El catalizador C2 está produciendo una cadena de polímero isotáctico. El es un ejemplo de “control de sitio” de polimerización. El catalizador quiral C2 ha influido en la estereoquímica de la cadena en crecimiento.
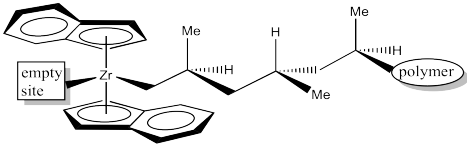
Asignar configuración (R o S) a cada uno de los centros quirales a lo largo de la cadena polimérica en el dibujo anterior para confirmar la isotacticidad. Tenga en cuenta que “polímero” significa una larga cadena de carbonos.
Ahora veamos el catalizador de C s. Lo desnudaremos como lo hicimos antes.
¿A dónde irá una cadena de polímeros en crecimiento? Obviamente debería entrar en uno de los cuadrantes superiores.
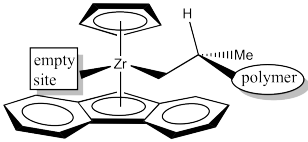
No es obvio si debe ser superior derecha o superior izquierda. Esta vez, hace la diferencia, porque el panorama no sería el mismo.
Dibuje el sitio del catalizador con la cadena de polímero en el cuadrante superior izquierdo.
Sin embargo, una vez que se acerca el propeno, se produce una clara preferencia. El centro quiral de la cadena polimérica se muestra con el hidrógeno hacia arriba hacia el anillo Cp, ya que es pequeño y no causa demasiada interacción estérica. La cadena de polímero se extiende hacia adelante, hacia el gran espacio abierto de la cuña. El deja el metilo apuntando a un lado de la cuña.
¿De qué manera se acercará el propeno? ¿Entrará del mismo lado que el metilo, o del lado opuesto? Probablemente del lado opuesto, como se muestra a continuación.
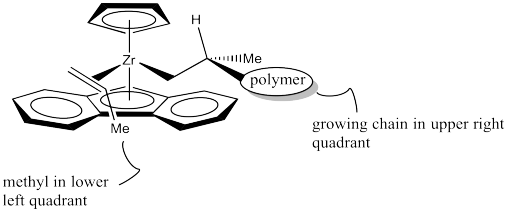
Los investigadores sospechan que el grupo metilo apunta “hacia abajo” en el dibujo anterior, en lugar de “hacia arriba”, porque la cadena polimérica es un obstáculo estérico más grande que el anillo aromático inferior, y la cadena polimérica se encuentra en un cuadrante superior. Una vez más, el enfoque del propeno se controla esteroquímicamente, aunque esta vez la estereoquímica de un centro quiral existente en la cadena polimérica en crecimiento influyó en cómo procedieron las cosas.
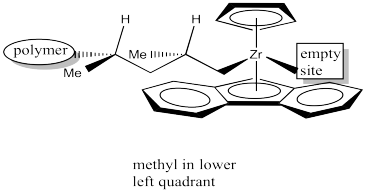
Una vez más, tras la inserción 1,2-se forma un nuevo centro quiral. El catalizador de Cs está formando una cadena de polímero sindiotáctico.
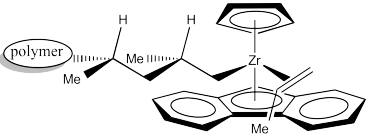
Debido a la influencia de un centro coral existente en el resultado estereoquímico de la reacción, se considera que este catalizador funciona a través del “control final de cadena”. El sitio del catalizador simplemente amplifica la influencia de ese centro quiral sobre el centro quiral que se forma a continuación. Lo hace reuniendo los reactivos en un pequeño espacio donde las diferencias estéricas de dos vías sutilmente diferentes se vuelven más importantes.
Marque las configuraciones (R o S) de los centros quirales en el dibujo anterior para confirmar la sindiotacticidad.

