7.2: Mecanismo de Sustitución Aromática Electrofílica
- Page ID
- 78868
El bromo no se agregará a través del doble enlace del benceno.
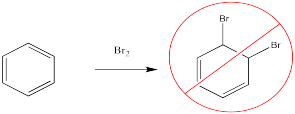
En cambio, un átomo de bromo puede reemplazar a uno de los átomos de hidrógeno en el benceno. Esta reacción es especialmente fácil en presencia de un catalizador.
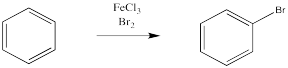
¿Cómo sucede ese resultado? ¿Por qué ocurre ese resultado?
Se ha estudiado mucho estas reacciones y hay fuertes evidencias de los pasos a través de los cuales ocurren. Como era de esperar, la reacción implica la donación de electrones π del benceno. Por el momento, asumiremos que el electrófilo es un catión bromo; luego trataremos su estructura exacta.
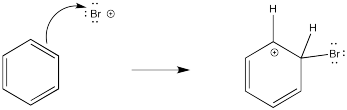
El problema es que ese paso inicial da como resultado la pérdida de aromaticidad. El sistema aromático confiere un poco de estabilidad adicional al sistema π, por lo que la molécula está motivada para restaurar la aromaticidad. La forma más fácil de hacerlo, y deshacerse de una carga positiva al mismo tiempo, sería desprotonar el catión. Alguna base recogerá el protón; es probable que sea un ion bromuro en este caso. Veremos más adelante de dónde viene ese bromuro.
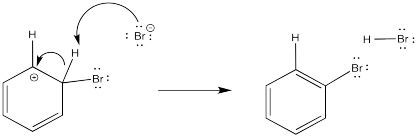
- La sustitución aromática electrofílica procede a través de un intermedio catiónico.
- Las formas intermedias a través de la donación de electrones π del areno a un electrófilo.
- La aromaticidad se restablece a través de la pérdida de un protón de este catión.
¿Cómo sabemos que el mecanismo se despliega de esta manera? Hay tres pasos básicos que se logran claramente durante el curso de la reacción: se rompe el enlace C-H, se forma el enlace C-Br y se rompe el enlace Br-Br.
¿Cuándo se rompe el bono C-H? Esa pregunta puede ser respondida buscando lo que se llama un “efecto isótopo”. El isótopo más común de hidrógeno es 1 H, o protio, pero también está disponible 2 H; se llama “deuterio”. El deuterio suele ser representado por el símbolo D y el protio por el símbolo H. El deuterio es dos veces más pesado que el protio común. Esa diferencia de masa conduce a una frecuencia vibracional menor de un enlace C-D que un enlace C-H. El enlace C-H vibra más rápidamente y energéticamente que un enlace C-D; como consecuencia, el enlace C-H se rompe más fácilmente que el enlace C-D.
Si tomamos una muestra de benceno ordinario, C 6 H 6, y una muestra de benceno deuterado, C 6 D 6, podemos medir la rapidez con la que cada uno sufre una reacción de bromación. Muy a menudo, una reacción que implica la escisión del enlace C-H se ralentizará si está involucrado un enlace C-D. Este desenlace se observa en las eliminaciones E2, por ejemplo. Esta ralentización de la reacción con el isótopo más pesado se llama efecto isótopo deuterio.
Sin embargo, no se observa ningún efecto de isótopo de deuterio durante la bromación ni en otras reacciones de sustitución electrofílica aromática. Esa ausencia de un efecto isótopo generalmente significa que la escisión del enlace C-H es una especie de ocurrencia tardía. La parte dura de la reacción ya está hecha. Tanto los bonos C-H como los C-D se rompen tan rápida y fácilmente, en comparación, que realmente no notamos la diferencia entre ellos.
Aún hay más evidencias. En algunos casos excepcionales, el intermedio catiónico en esta reacción es lo suficientemente estable como para aislarse y cristalizarse. La difracción de rayos X muestra que hay un carbono tetraédrico en el anillo, lo que indica que el enlace C-H aún no se ha roto.
El enlace C-H se rompe al final de la reacción. ¿Cuándo se rompe el vínculo Br-Br?
Esa pregunta es un poco más difícil de responder. No podemos usar la misma estrategia isotópica que usamos con el enlace C-H. Aunque el deuterio es dos veces más pesado que el protio, produciendo un efecto isótopo sustancial, 81 Br es solo 2.5% más masivo que 79 Br. Cualquier diferencia en las tasas que involucran estos isótopos es indetectable. La naturaleza exacta de las especies de bromo en la reacción es complicada, e incluso puede ser diferente bajo diferentes condiciones.
En el caso de reacciones de bromación no catalizadas, la adición de sales como NaBr no tiene efecto sobre la velocidad de reacción, lo que indica que el areno reacciona directamente con Br 2 en lugar de Br +. Explique esta línea de razonamiento.
- Contestar
-
En el caso de reacciones de bromación no catalizadas, existe evidencia clara de que la etapa de ruptura del enlace Br-Br no inicia la reacción. Si ese fuera el primer paso, presumiblemente habría un equilibrio entre los iones Br 2 y Br + /Br -. Ese equilibrio se desplazaría hacia Br 2 si se agregaran sales de bromuro. En ese caso, se suprimiría la cantidad de catión bromo y la reacción se ralentizaría. Sin embargo, no se observan tales efectos salinos. Esa evidencia sugiere que, en la reacción no catalizada, el aromático reacciona directamente con Br 2.
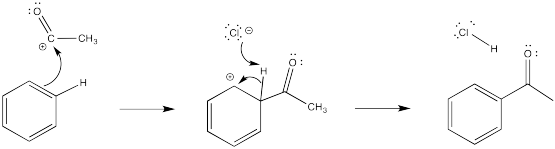
Dados cada uno de los siguientes electrófilos, proporcionar un mecanismo para la sustitución aromática electrófila.
a) NO 2 + b) CH 3 CH 2 + c) SO 3 H + d) CH 3 CO +
- Contestar a
-
En cada caso, una base debe eliminar el protón del intermedio catiónico. Para este papel se ha elegido un anión que estaría presente en solución.
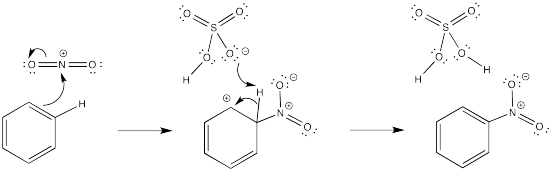
- Respuesta b
-
En cada caso, una base debe eliminar el protón del intermedio catiónico. Para este papel se ha elegido un anión que estaría presente en solución.
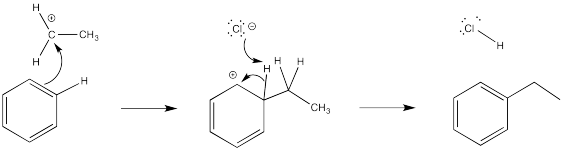
- Respuesta c
-
En cada caso, una base debe eliminar el protón del intermedio catiónico. Para este papel se ha elegido un anión que estaría presente en solución.
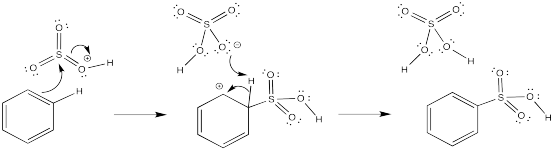
- Respuesta d
-
En cada caso, una base debe eliminar el protón del intermedio catiónico. Para este papel se ha elegido un anión que estaría presente en solución.