7.3: Formación del electrófilo
- Page ID
- 78859
El mecanismo de sustitución aromática electrofílica sigue dos etapas elementales. Primero, la donación de un par de electrones π al electrófilo da como resultado una pérdida de aromaticidad y formación de un catión. Segundo, la eliminación de un protón de ese catión restaura la aromaticidad.
¿Cómo se forma el electrófilo en primer lugar? Los detalles de esa parte de la reacción varían de un caso a otro. Con la reacción catalizada del bromo, el ácido de Lewis activa el halógeno para volverlo más electrófilo. La activación puede llegar incluso a formar un catión bromo, como se sugirió anteriormente. De lo contrario, la carga positiva sobre el átomo de bromo que liga el ácido de Lewis puede anularse, indirectamente, cuando el areno dona al átomo terminal de bromo.
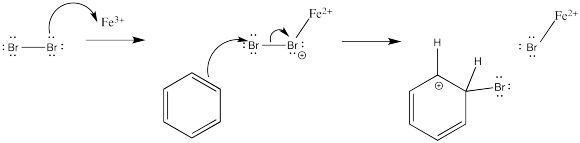
La aparición de un ion bromuro para desprotonar el catión simplemente resulta del equilibrio del complejo ácido-base de Lewis.

Mostrar el mecanismo de cloración de benceno en presencia de cloruro férrico.
Las reacciones de haluros de alquilo y acilo también involucran catalizadores ácidos de Lewis; frecuentemente, se emplea cloruro de aluminio (AlCl 3). Estas dos reacciones se llaman Friedel - Crafts reacciones después de los co-descubridores franceses y americanos de la reacción. Típicamente, se cree que las reacciones de Friedel-Crafts ocurren a través de la formación inicial de electrófilos catiónicos, que luego reaccionan con aromáticos de la misma manera que los electrófilos halógenos.

El catión alquilo es un potente electrófilo. Es capaz de interrumpir temporalmente la aromaticidad del anillo aromático, formando un ion arenio.
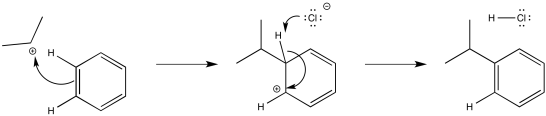
El intermedio de ion arenio es probablemente desprotonado por ion haluro; alguna cantidad de estos iones estaría en equilibrio con el aducto ácido-base de Lewis.

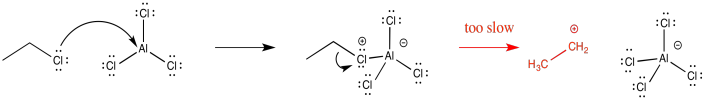
Debido a que las alquilaciones Friedel-Crafts ocurren a través de cationes alquilo, las reacciones de los haluros de alquilo primarios son generalmente bastante lentas. Esos cationes simplemente no son lo suficientemente estables como para formarse. Aunque a veces parece que la formación de un intermedio estable ralentizaría las cosas, porque no estaría motivada para reaccionar más, generalmente lo contrario es cierto. Debido a que un intermedio está en alta energía, es intrínsecamente difícil de formar en primer lugar. Esta dificultad actúa como un bloqueo a la reacción, para que no proceda con mucha facilidad.
Formar el intermedio más fácilmente, por lo tanto, permite que la reacción proceda más rápidamente. Por ejemplo, el catión terc-butilo es relativamente estable, de modo que el intermedio se forma con relativa facilidad. La alquilación de anillos aromáticos con haluros de alquilo terciario es especialmente fácil de lograr.
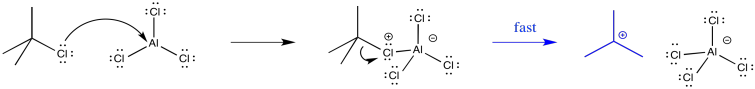
En algunos casos, la formación de un catión probablemente no ocurre en absoluto. En cambio, el complejo ácido-base de Lewis activado actúa como electrófilo directamente. Esta vía parece ocurrir con los electrófilos metílicos. Sin embargo, también hay indicios de que los haluros de alquilo primarios experimentan este mecanismo en paralelo con el mecanismo catiónico.
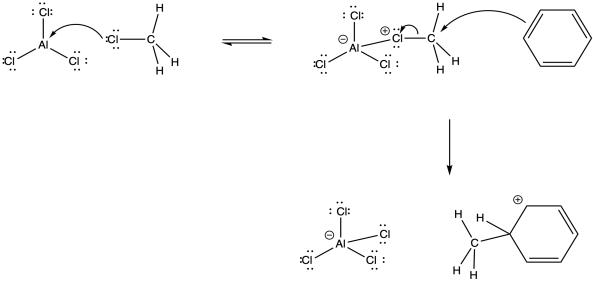
Vale la pena señalar que en algunos casos, múltiples productos pueden resultar a través de reordenamientos. Estas observaciones proporcionan evidencia adicional de la naturaleza catiónica de los intermedios, así como de las vías competidoras.
Mostrar el mecanismo para la alquilación Friedel-Crafts de benceno con 2-cloropropano en presencia de cloruro de aluminio.
- Contestar
-
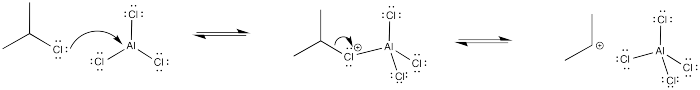
¿Por qué la reacción de Friedel-Crafts del 1-cloropropano es mucho más lenta que la reacción del 2-cloropropano? Explicar usando un mecanismo e intermedios.
- Contestar
-
El catión primario formado es muy inestable. Como resultado, existe una alta barrera a la formación de cationes.
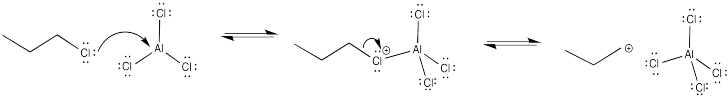
Mostrar por qué la alquilación Friedel-Crafts de benceno con 2-cloropentano da como resultado la formación de dos productos diferentes.
- Contestar
-

Mostrar el mecanismo para la acilación Friedel-Crafts de benceno con cloruro de etanoilo (cloruro de acetilo) en presencia de cloruro de aluminio.
- Contestar
-
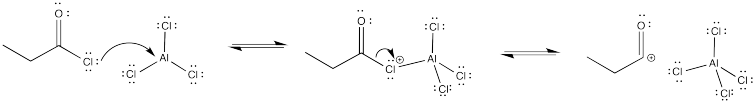
Mostrar por qué la acilación Friedel-Crafts de benceno con cloruro de pentanoilo da como resultado un solo producto, sin reordenamiento.
- Contestar
-

El catión que resulta se estabiliza vía π-donación a partir de oxígeno.
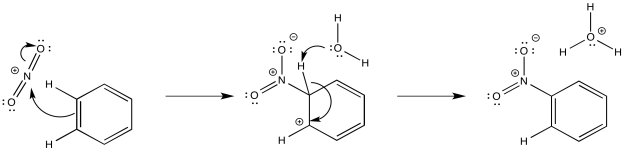
Las reacciones de nitración y sulfonación difieren de las otras sustituciones que hemos visto porque no utilizan catálisis ácida de Lewis. Estas reacciones dependen de los equilibrios que ocurren en medios fuertemente ácidos. Cuando el ácido nítrico se disuelve en ácido sulfúrico, hay evidencia espectroscópica que las formas NO 2 +, proporcionando un electrófilo. Ese electrófilo se añade fácilmente al anillo aromático.
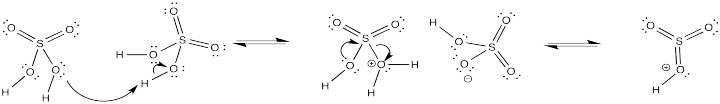
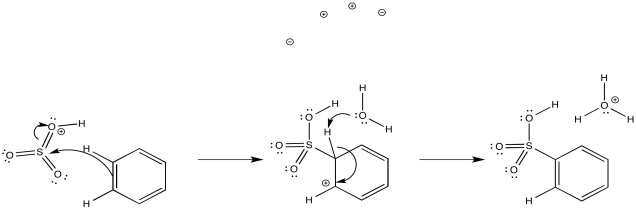
De manera similar, cuando el ácido sulfúrico se concentra por ebullición del agua residual, resulta trióxido de azufre. Bajo estas condiciones ácidas, este último forma fácilmente SO 3 H +, el electrófilo en la sulfonación.
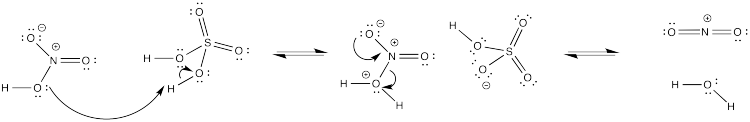
Proporcionar un mecanismo para la formación de NO 2 + a partir de ácido nítrico y sulfúrico.
- Contestar
-
Proporcionar un mecanismo para la formación de SO 3 H + a partir de ácido sulfúrico.
- Contestar
-