7.4: Activación y Desactivación
- Page ID
- 78860
Debido a que el benceno actúa como nucleófilo en la sustitución aromática electrófila, los sustituyentes que hacen que el benceno sea más rico en electrones pueden acelerar la reacción. Los sustituyentes que hacen que el benceno sea pobre en electrones pueden retardar la reacción.
A mediados del siglo XX, químicos físicos orgánicos, incluido Christopher Ingold, realizaron una serie de estudios cinéticos sobre reacciones de sustitución aromática electrofílica. En la siguiente tabla, se puede observar que algunos sustituyentes confieren una velocidad de reacción que es mucho mayor que la del benceno (R = H). El fenol, C 6 H 5 OH, se somete a nitración mil veces más rápido que el benceno. El nitrobenceno, C 6 H 5 NO 2, experimenta la reacción millones de veces más lentamente.
| Tasa de nitración en derivados de benceno | |
| R en C 6 H 5 R | Tasa relativa |
| OH | 1,000 |
| CH 3 | 25 |
| H | 1 |
| CH 2 Cl | 0.71 |
| I | 0.18 |
| F | 0.15 |
| Cl | 0.033 |
| Br | 0.030 |
| CO 2 Et | 0.0037 |
| NO 2 | 6 x 10 -8 |
| NMe 3 + |
1.2 x 10 -8 |
Estas observaciones son consistentes con el papel del aromático como nucleófilo en esta reacción. Los sustituyentes que alejan la densidad electrónica del anillo aromático ralentizan la reacción. Estos grupos se denominan grupos desactivantes en esta reacción. Los sustituyentes que donan fácilmente la desnidad electrónica al anillo, o que estabilizan eficazmente el intermedio catiónico, promueven la reacción. Estos grupos se denominan grupos activadores en esta reacción.
Los papeles de estos grupos están relacionados con sus interacciones electrónicas con los electrones en el anillo. Algunos grupos pueden ser donadores de π, proporcionando densidad de electrones adicional al anillo de benceno a través de la conjugación.

Otros grupos pueden ser aceptores π, alejando la densidad de electrones del anillo mediante conjugación.

Aún otros pueden ser aceptores σ-, alejando la densidad de electrones del anillo a través de un simple efecto inductivo que surge de la electronegatividad de un sustituyente.
En algunos casos, puede haber múltiples efectos, y la influencia general de los sustituyentes está determinada por el equilibrio de los efectos. Un efecto puede ser más fuerte en un caso que en el otro, por lo que gana en un caso y pierde en otro.
Explique por qué un átomo de flúor ralentizaría una sustitución electrófila en un anillo de benceno adyacente.
Mostrar, con estructuras, cómo el grupo OH en fenol hace que el anillo de benceno sea más nucleófilo.
- Contestar
-

Mostrar, con estructuras, cómo el grupo CO 2 Et hace que el anillo de benceno sea menos nucleófilo.
- Contestar
-
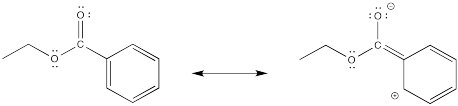
Mostrar, con estructuras, cómo un grupo metilo estabiliza el intermedio catiónico durante una reacción de nitración.
- Contestar
-

En general, los grupos desactivadores se agrupan en dos clases. Los aceptores π, como los carbonilos, si se colocan directamente adyacentes al anillo aromático, ralentizan la reacción. Los átomos altamente electronegativos, típicamente halógenos, unidos directamente al anillo aromático también ralentizan la reacción.
- los grupos desactivantes hacen que la sustitución aromática electrófila sea más lenta que en el benceno
- los aceptores π-son grupos desactivantes
- los halógenos son grupos desactivantes
Los grupos activadores también se agrupan en dos categorías. Donantes π, típicamente átomos de oxígeno o nitrógeno, aceleran la reacción. Esta observación es cierta a pesar de que estos átomos también son altamente electronegativos. Los grupos alquilo unidos al anillo aromático también aceleran la reacción.
- los grupos activadores hacen la sustitución aromática electrófila más rápida que en el benceno
- los donadores de oxígeno y nitrógeno son grupos activadores
- los alquilos son grupos activadores
Obsérvese que los halógenos también son donadores π, pero son menos efectivos en este sentido que el nitrógeno u oxígeno. Esto se debe a que el nitrógeno y el oxígeno son similares en tamaño al carbono, y forman una superposición p efectiva con el carbono adyacente en el anillo de benceno. En los halógenos, la electronegatividad gana por defecto, porque sus efectos donadores de π no son lo suficientemente buenos para hacerlos activadores.
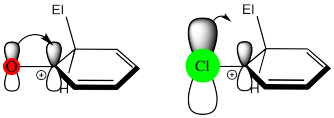
Por el contrario, el nitrógeno y el oxígeno son muy electronegativos, pero su excepcional capacidad donadora de π los convierte en activadores en lugar de desactivadores. Así, en muchos casos, existe un sutil equilibrio entre activar y dirigir los efectos. En algunos casos, el efecto activador es más pronunciado, y eso es lo que se observa. En otros casos, es el efecto desactivador el que gana.

Los grupos alquilo se comportan casi como donantes sigma, aunque esa puede ser una forma engañosa de pensar sobre ellos.
En cambio, su suave efecto activador surge de la hiperconjugación, en la que un par de electrones de enlace C-H pueden interactuar débilmente con un sitio catiónico, proporcionando un poco de estabilidad extra al catión.
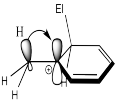
Uno de los grupos de la tabla, CH 2 Cl, no encaja del todo con las reglas generales. Se está desactivando muy ligeramente. Explique por qué este grupo actúa de esta manera.
- Contestar
-
Este es un grupo alquilo sustituido. Un grupo alquilo debe ser moderadamente activante, pero la presencia de un halógeno ejerce un efecto inductivo de extracción de electrones. El efecto estabilizador de cationes del sustituyente alquilo está completamente contrarrestado por el halógeno.
Predecir si cada uno de los siguientes grupos estaría activando o desactivando hacia la sustitución aromática electrofílica.
a) NH 2 b) CN c) OCH 3 d) PyME 2 + e) C (O) CH 3
- Contestar a
-
a) activar
- Respuesta b
-
b) Desactivar
- Respuesta c
-
c) activar
- Respuesta d
-
d) Desactivar
- Respuesta e
-
e) desactivar
Explicar la tendencia en los efectos activadores entre los diferentes halógenos.

