7.5: Efectos Directivos
- Page ID
- 78869
Además de ejercer un efecto sobre la velocidad de reacción, los sustituyentes en el anillo de benceno también influyen en la regioquímica de la reacción. Es decir, controlan dónde aparece el nuevo sustituyente en el producto.
Recuerde, hay tres posiciones diferentes en el anillo de bezeno donde se puede unir un nuevo sustituyente, en relación con el sustituyente original. La sustitución podría ocurrir realmente en cinco posiciones alrededor del anillo, pero dos pares están relacionados por simetría. El isomería en bencenos disustituidos puede describirse numerando los sustituyentes (1,2- etc) o por las relaciones orto -, meta - y para -. Hay dos posiciones orto -al sustituyente inicial y dos posiciones meta - a él.
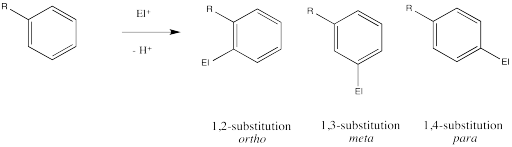
Ingold y sus colegas investigaron la cuestión de la regioquímica en la nitración. Reportaron las siguientes observaciones:
| Patrones de sustitución durante la nitración de derivados de benceno | |||
| R en C 6 H 5 R | % o - producto | % m - producto | % p - producto |
| CH 3 | 56 | 3 | 41 |
| F | 10 | 0 | 90 |
| Cl | 30 | 0 | 70 |
| Br | 38 | 0 | 62 |
| OH | 10 | 0 | 90 |
| CHO | 19 | 72 | 9 |
| CO 2 Et | 28 | 68 | 3 |
| CN | 17 | 81 | 2 |
| NO 2 | 6 | 94 | 0 |
Al mirar la mesa, se puede ver que hay dos grupos de sustituyentes. Un grupo reacciona para hacer mezclas de orto - y para - productos. Puede haber diferentes proporciones de orto - a para - y puede haber pequeñas cantidades de meta -, pero no se empantanen en los detalles en este momento. Enfócate en el panorama más amplio. Algunos grupos son "orto-/ para -directores”.
El otro grupo reacciona a productos masivamente meta-sustituidos. Puede haber pequeñas cantidades de productos orto y para, pero no se preocupe por eso. Enfócate en el panorama más amplio. Algunos grupos son "meta -directores”.
Estos efectos regioquímicos están muy estrechamente relacionados con los efectos activadores y directores que ya hemos visto. Si queremos entender estos datos, necesitamos pensar en cosas como π-donación, π-aceptación, efectos inductivos y estabilidad catiónica.
Mostrar estructuras de resonancia para el intermedio catiónico que resulta durante la nitración de tolueno (metilbenceno). Explicar por qué resulta una mezcla de orto- y para- sustitución.
- Contestar
-
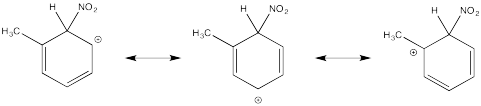
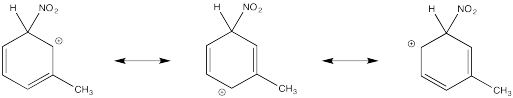
Los cationes terciarios que resultan durante la orto- y meta- sustitución ofrecen estabilidad extra, lo que lleva a la formación preferencial de estos cationes.
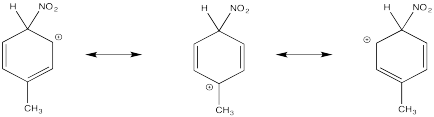
Mostrar estructuras de resonancia para el intermedio catiónico que resulta durante la nitración de clorobenceno. Explicar por qué resulta una mezcla de orto- y para- sustitución.
- Contestar
-
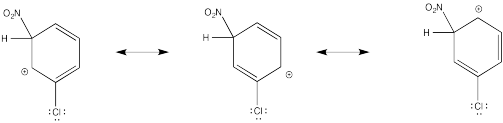
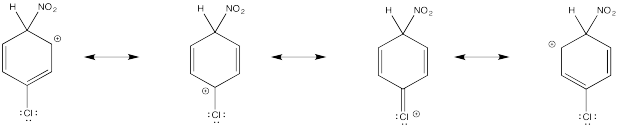
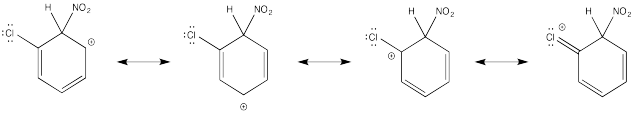
La donación π que ocurre en los cationes derivados de la orto- y meta- sustitución da como resultado una estabilidad extra, lo que lleva a la formación preferencial de estos cationes.
Mostrar estructuras de resonancia para el intermedio catiónico que resulta durante la nitración de acetofenona (C 6 H 5 COCH 3). Explicar por qué principalmente los resultados de meta-sustitución.
- Responder
-
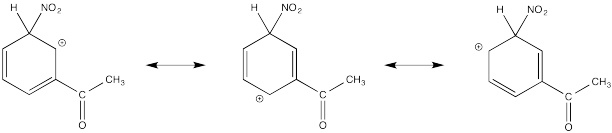
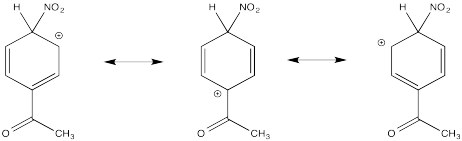
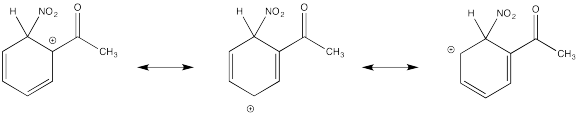
El catión directamente adyacente al carbonilo se desestabiliza por el efecto de extracción de electrones de la cetona. Por defecto, el otro intermedio se forma preferencialmente.
Mostrar estructuras de resonancia para el intermedio catiónico que resulta durante la nitración de acetanilida (C 6 H 5 NH (CO) CH 3). Explicar por qué resulta una mezcla de orto- y para- sustitución.
- Responder
-
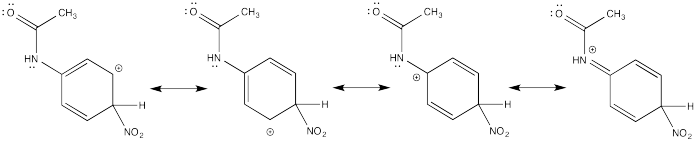
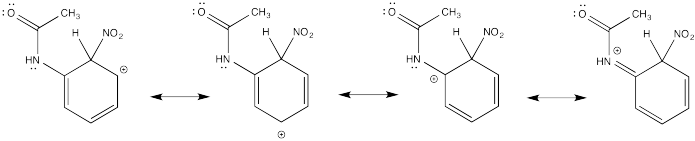

La donación π que ocurre en los cationes derivados de la orto- y meta- sustitución da como resultado una estabilidad extra, lo que lleva a la formación preferencial de estos cationes.
En general, podemos dividir estos sustituyentes en tres grupos:
- Los aceptadores π-son meta-directores.
- π-donadores son orto -/para - directores.
- los alquilos son orto -/para - directores.
Tenga en cuenta que, una vez más, podemos tener dos efectos competidores en un sustituyente, como un halógeno. En halógenos, aunque el efecto neto puede ser ralentizar la reacción, esa donación débil de π-aún es suficiente para inclinar el saldo de productos a favor de la orto- y para- sustitución.
Por ejemplo, el flúor tiene un par solitario. Puede ser un donador π.
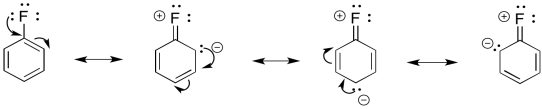
Podríamos ilustrar los efectos con la siguiente caricatura. Muestra acumulación de carga negativa, ilustrada en rojo, en tres de los carbonos en el anillo de benceno.

El flúor también es muy electronegativo. Puede ser un grupo extractor de electrones. Debido a que retira electrones a través de su enlace sigma en lugar de a través de efectos de resonancia, lo pensamos como “inductivamente” extracción de electrones. Sin embargo, una cantidad considerable de densidad de electrones del benceno es atraída por el flúor.
Nuevamente, podríamos ilustrar los efectos con una caricatura. Muestra acumulación de carga positiva, ilustrada en azul, en los carbonos más cercanos al flúor. Recuerde, las interacciones electrostáticas disminuyen rápidamente con la distancia, por lo que cuanto más lejos estén los carbonos del flúor, menor será el efecto que experimentarán.
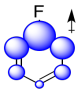
La suma de estos efectos se puede ilustrar en una caricatura compuesta que muestra diferentes cantidades de carga positiva o negativa acumuladas en diferentes carbonos.
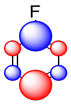
Así, aunque el flúor es generalmente un grupo electronegativo y desactivador, todavía puede lograr colocar cierta densidad extraelectrónica en carbonos particulares.
Que algo esté activando o desactivando en general depende de un balance similar de factoresEn general, podemos pensar en efectos competidores en términos de una sierra de ver.
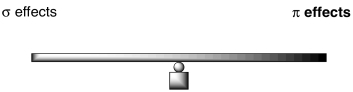
Para un donador de π electronegativo como el flúor u otro halógeno, cuanto más fuertes sean esos efectos de extracción de σs, más lenta será la reacción. Aleja más densidad de electrones del benceno de lo que devuelve. En consecuencia, el benceno es menos nucleófilo de lo que sería si el halógeno no estuviera ahí.

Por otro lado, cuanto mejor sea la donación-π, más rápida será la reacción. Los buenos donadores π incluyen oxígeno y nitrógeno. Tienen el tamaño justo para prestar un par solitario a un carbono vecino en el anillo de benceno. Los halógenos, por otro lado, son donantes relativamente torpes. O son un poco demasiado electronegativos para ser útiles, como el flúor, o bien son un poco demasiado grandes para compartir con carbono. Ese es el caso del cloro, bromo y yodo.
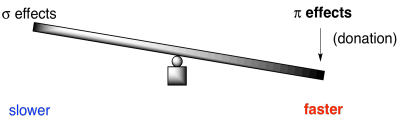
Recuerden, los mismos argumentos son ciertos en la química de los carbonilos. La reactividad general de los derivados carboxiloides depende de un equilibrio similar entre los efectos de donación y retirada. Como resultado, los ésteres y amidas son relativamente estables y no reactivos, mientras que los cloruros son muy reactivos.
Por supuesto, un aceptor π-funcionaría de la manera opuesta. Eso sería cierto si el átomo unido al benceno se une multiplicadamente a otro átomo, sobre todo si ese otro átomo es algo electronegativo (un oxígeno o un nitrógeno).

Planeación Retrosintética
A veces en el trabajo sintético es útil mirar un compuesto e imaginar de qué podría estar hecho. Esta práctica se utiliza en la química industrial, cuando un investigador podría estar tratando de decidir sobre la ruta más económica para hacer un compuesto en particular. Puede haber materiales fácilmente disponibles de los que pueda fabricarse un producto farmacéutico útil. Al trabajar hacia atrás un paso a la vez, el investigador puede ver más fácilmente diferentes posibilidades para los materiales de partida. De manera similar, un químico biológico podría ser capaz de identificar qué precursores biológicos podrían conducir a la formación de un compuesto particular en biología.
Por ejemplo, al observar la estructura del m-bromonitrobenceno, se podría imaginar que el compuesto podría hacerse por la bromación del nitrobenceno, pero no por la nitración del bromobenceno. Eso es porque los grupos nitro son meta- directores, pero los grupos bromo-son orto-, para- directores.
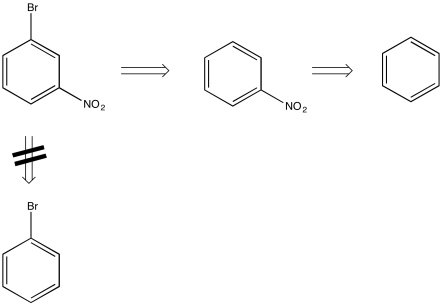
Este método de trabajar hacia atrás desde el compuesto objetivo se denomina “análisis retrosintético”. Al hacer un plan retrosintético, podemos llegar de manera más eficiente a las posibles formas de hacer un compuesto específico.
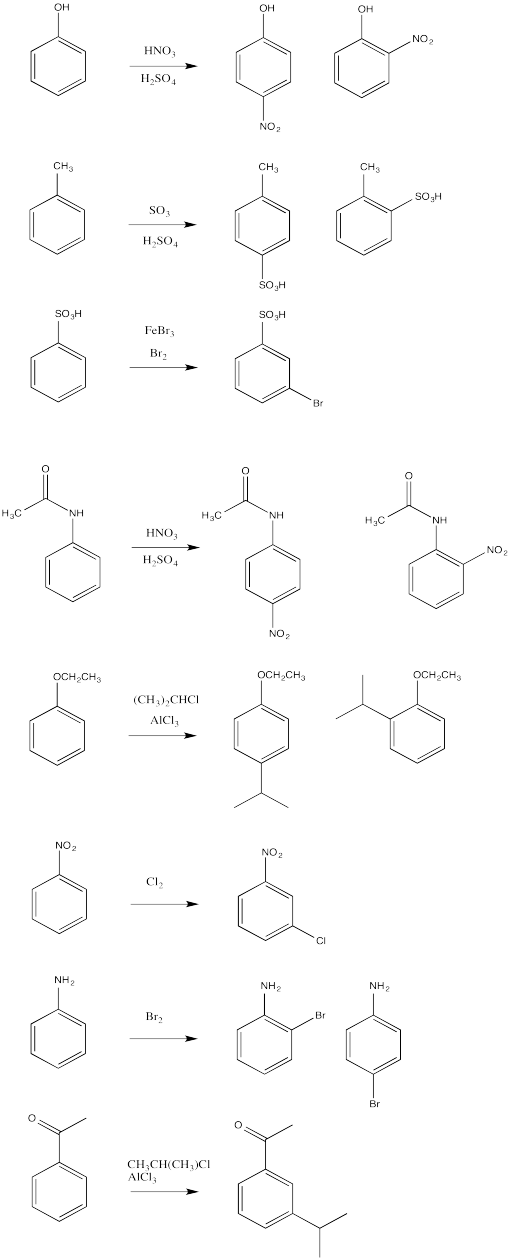
Rellenar los principales productos orgánicos de las siguientes reacciones.

Contestar-
Rellenar los materiales de partida y reactivos necesarios para obtener el producto principal mostrado mediante sustitución aromática electrofílica.
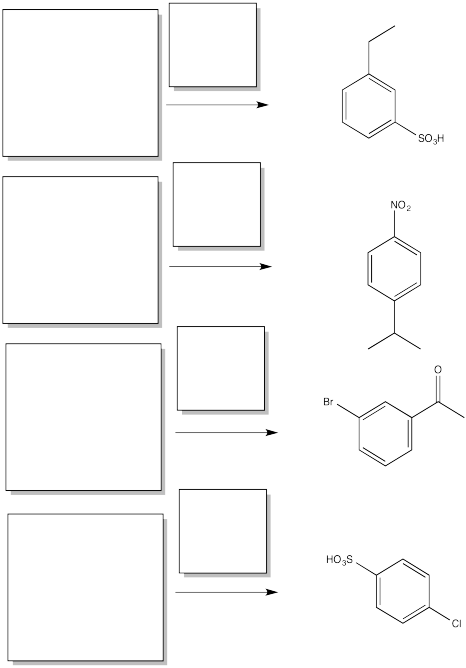
- Responder
-

Dados dos sustituyentes diferentes en un benceno, a veces puede haber un conflicto en predecir qué patrón de sustitución resultará. Generalmente, el grupo con el efecto activador más fuerte gana hacia fuera. Predecir los principales productos de las siguientes reacciones.
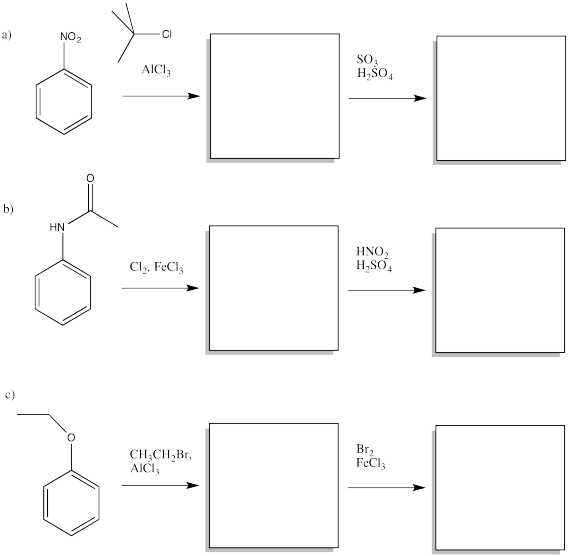
- Responder
-
En los casos que condujeron a mezclas de productos orto y para, solo se eligió un producto, basado en interacciones estéricas mínimas.
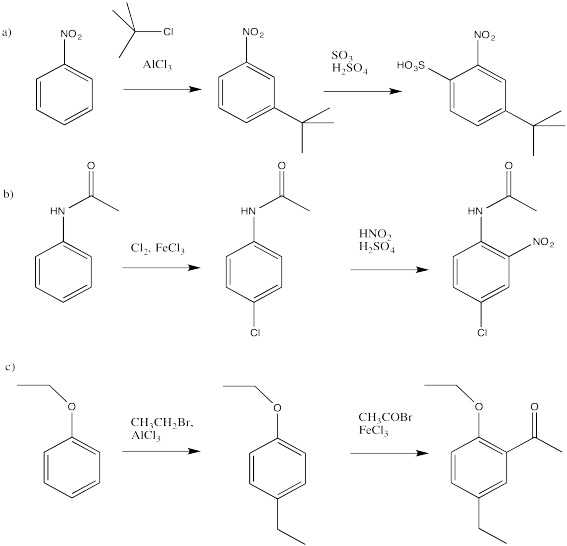
Problema AR5.8
- Responder
-
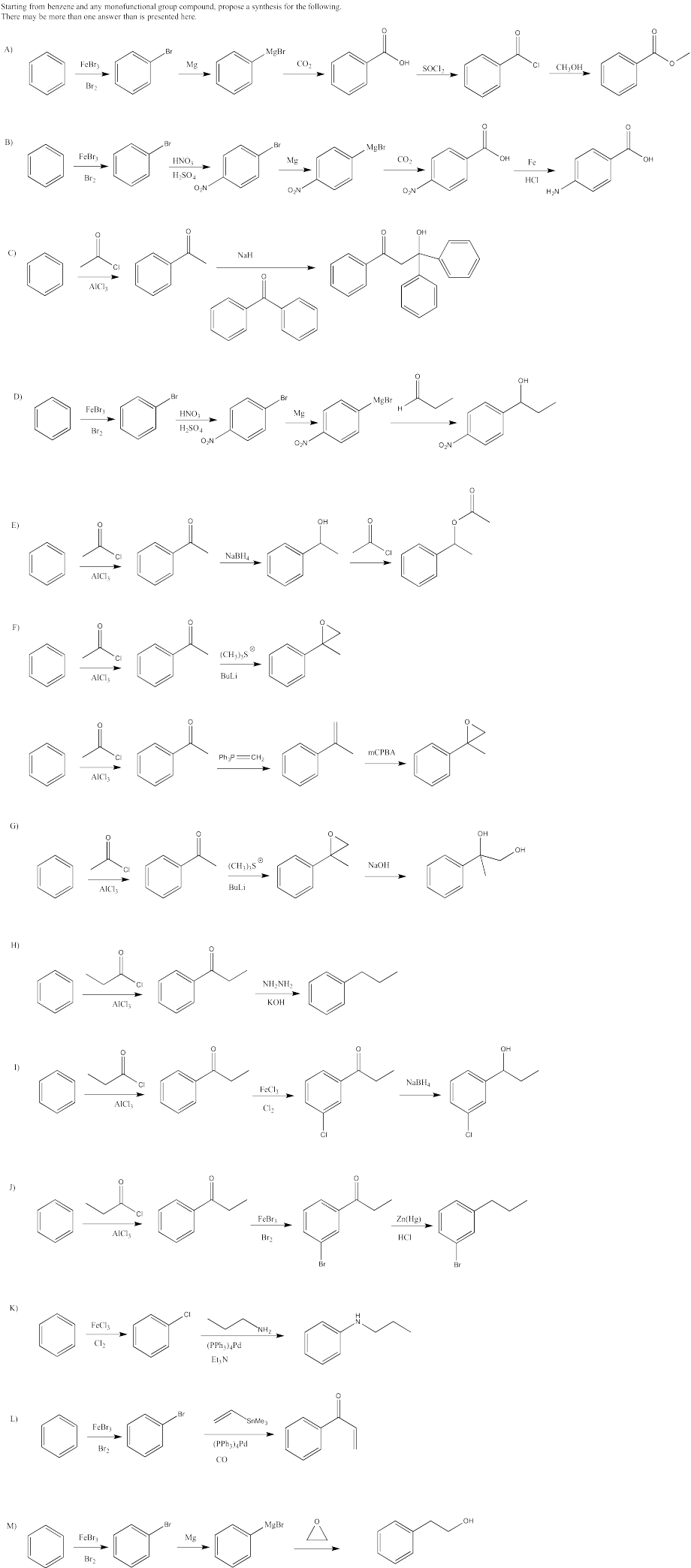
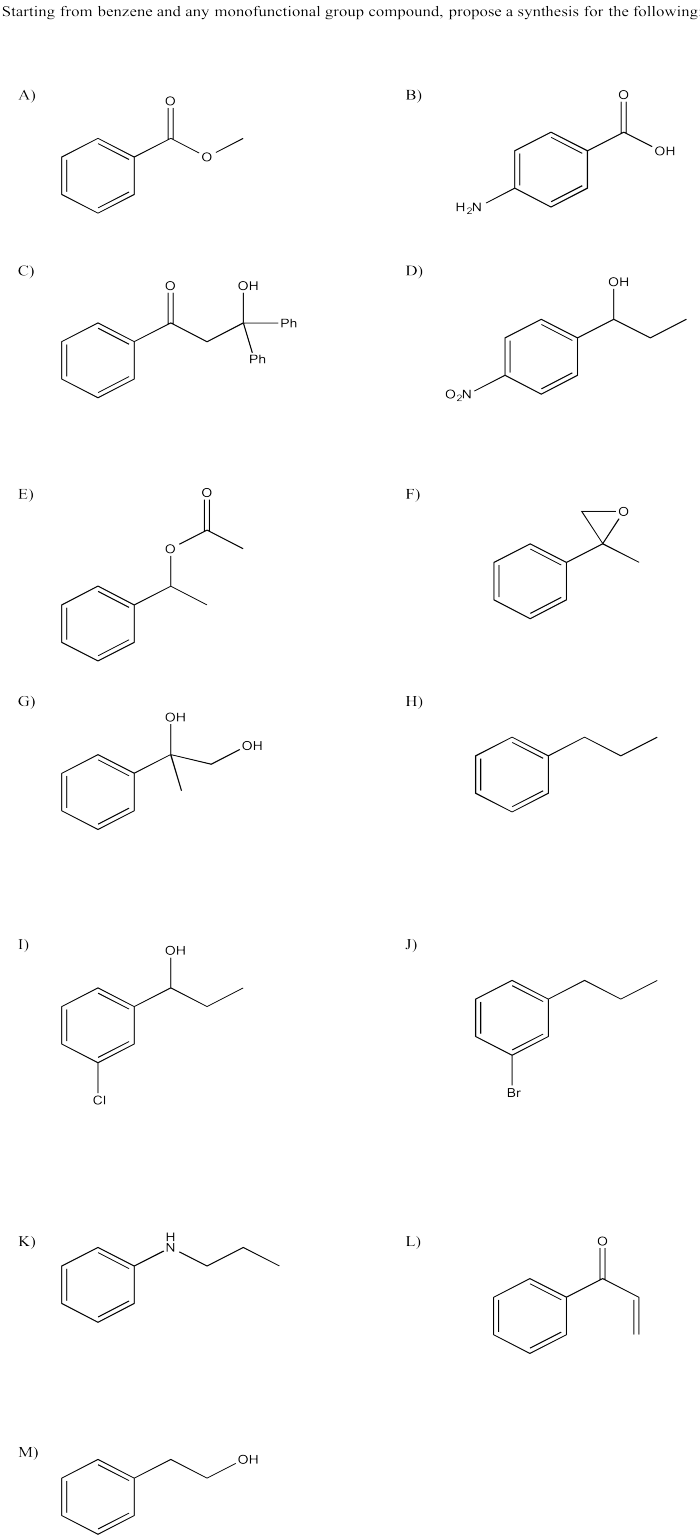
Proporcionar un plan retrosintético para cada uno de los siguientes compuestos, volviendo al benceno.
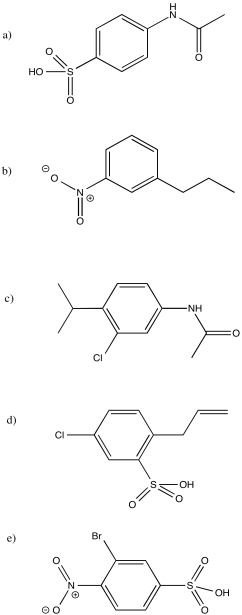
- Responder
-
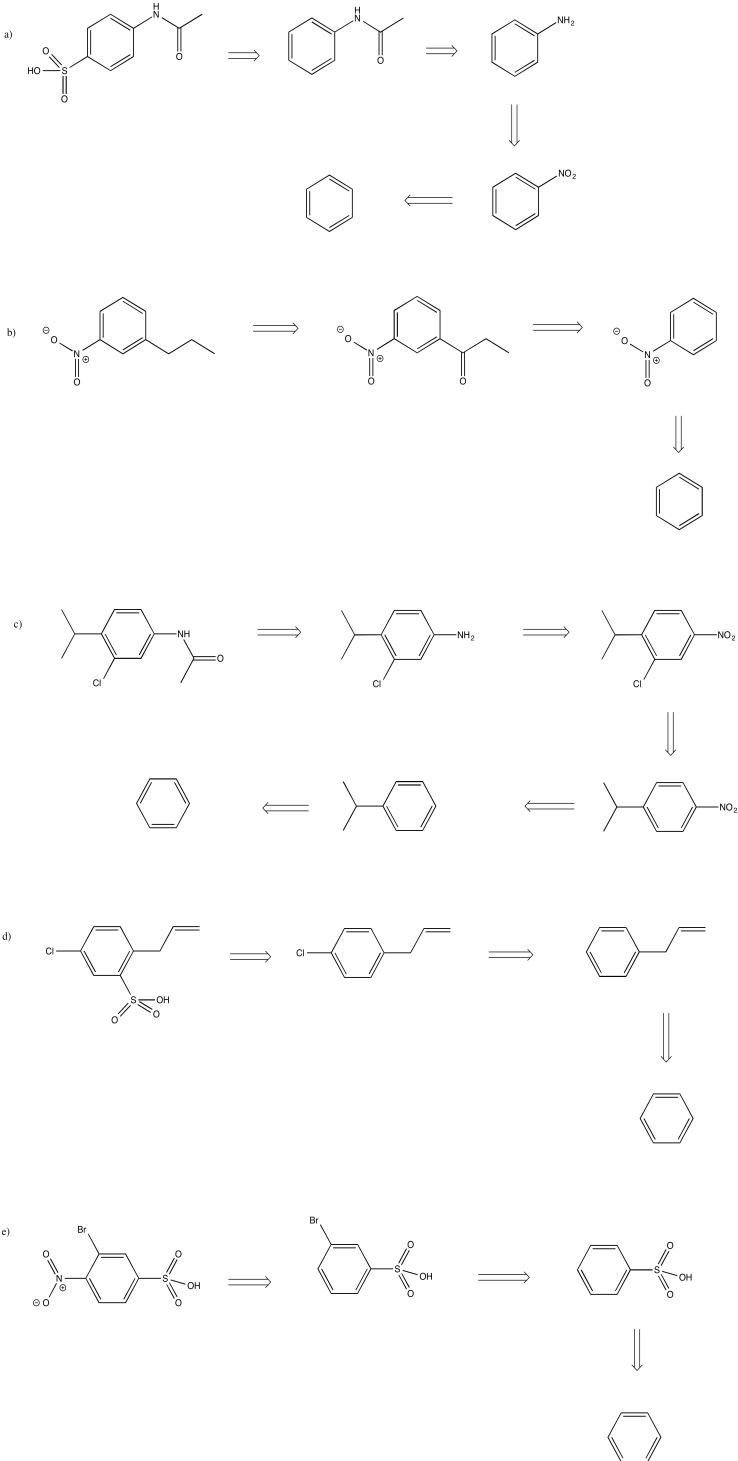
Convertir los planes retrosintéticos del problema anterior en síntesis.
- Responder
-
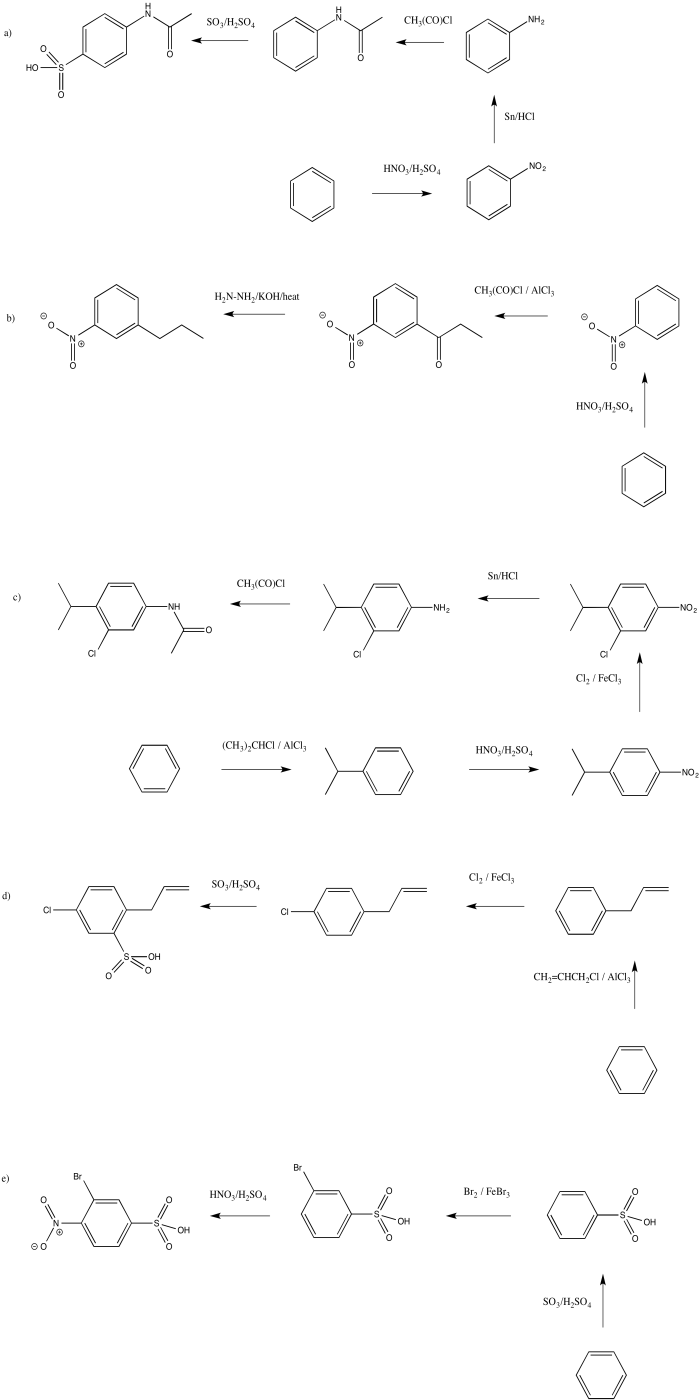
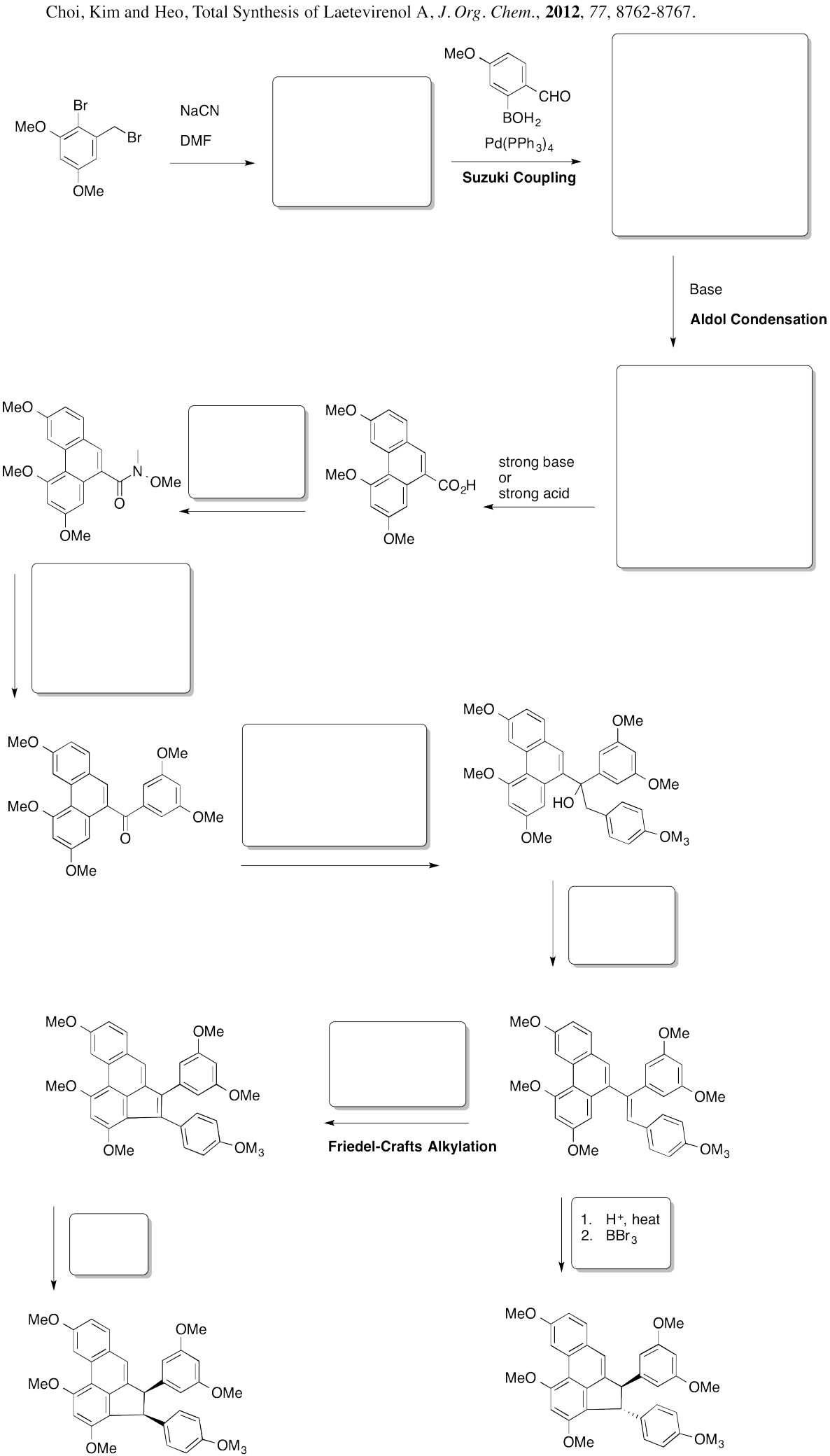
- Responder
-
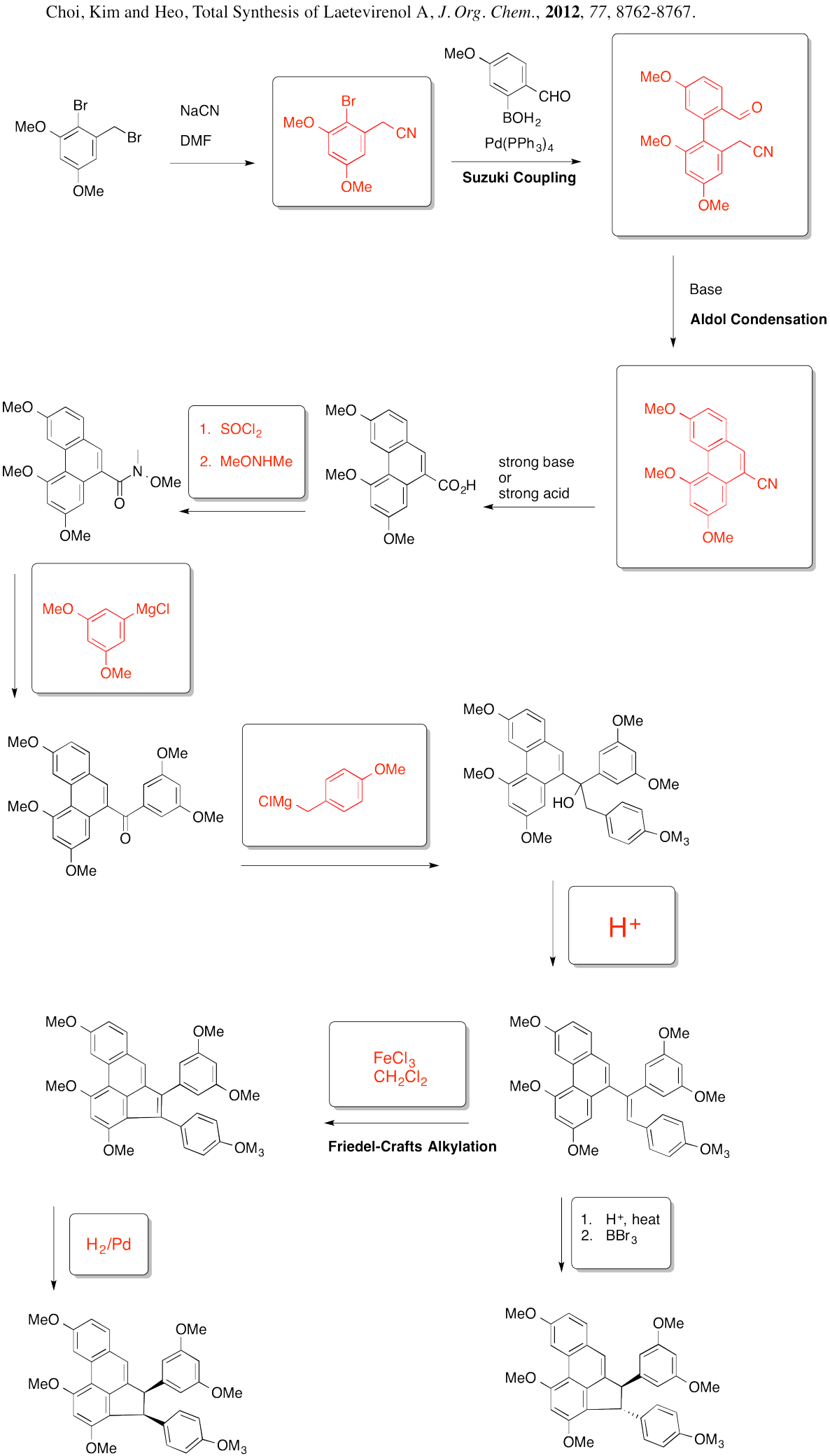
Problema AR5.12.
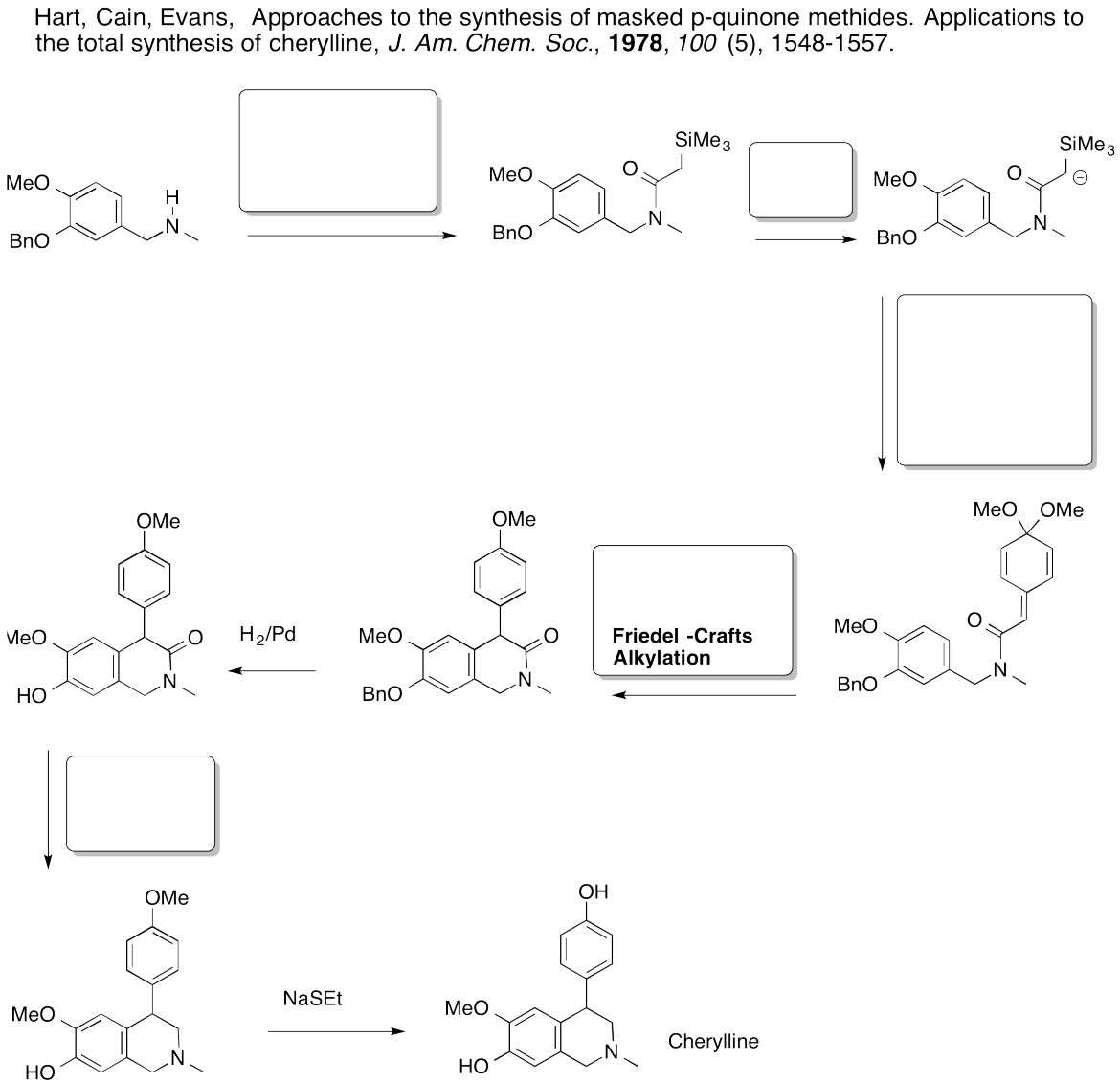
- Responder
-