3.1: Unidades y Dimensiones
- Page ID
- 71002
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente. Es especialmente importante que conozcas los significados precisos de todos los términos en cursiva en el contexto de este tema.
- Describir los nombres y abreviaturas de las unidades base SI y los prefijos decimales SI.
- Defina el litro y la tonelada métrica en estas unidades.
- Explicar el significado y uso de las dimensiones unitarias; indicar las dimensiones del volumen.
- Indique las cantidades que se necesitan para definir una escala de temperatura y mostrar cómo éstas se aplican a las escalas de temperatura Celsius, Kelvin y Fahrenheit.
- Explique cómo funciona un barómetro torricelliano.
¿Alguna vez has estimado una distancia “bajándola”, es decir, contando el número de pasos necesarios para llevarte una cierta distancia? O tal vez has usado el ancho de tu mano, o la distancia desde tu codo hasta la punta de un dedo para comparar dos dimensiones. Si es así, te has ocupado en lo que probablemente sea el primer tipo de medición jamás emprendido por la humanidad primitiva. Los resultados de una medición siempre se expresan en algún tipo de escala que se define en términos de un tipo particular de unidad. Las primeras escalas de distancia probablemente estuvieron relacionadas con el cuerpo humano, ya sea directamente (la longitud de una extremidad) o indirectamente (la distancia que un hombre podría caminar en un día).
A medida que se desarrollaba la civilización, surgieron una amplia variedad de escalas de medición, muchas por la misma cantidad (como la longitud), pero adaptadas a actividades o oficios particulares. Finalmente, se hizo evidente que para que el comercio y el comercio fueran posibles, esas escalas tenían que definirse en términos de estándares que permitieran verificar las medidas y, cuando se expresaban en diferentes unidades (bushels y picotazos, por ejemplo), correlacionarse o convertirse.
A lo largo de los siglos, cientos de unidades de medida y escalas se han desarrollado en las muchas civilizaciones que lograron algunos medios alfabetizados para registrarlas. Algunos, como los utilizados por los aztecas, cayeron en desuso y fueron en gran parte olvidados ya que estas civilizaciones se extinguieron. Otras unidades, como los diversos sistemas de medición que se desarrollaron en Inglaterra, alcanzaron prominencia a través de la extensión del Imperio y el comercio generalizado; muchos de estos se limitaron a oficios o industrias específicas. Los ejemplos que aquí se muestran son solo algunos de los que se han utilizado para medir la longitud o la distancia. La historia de las unidades de medición proporciona una fascinante reflexión sobre la historia del desarrollo industrial.
El acontecimiento más influyente en la historia de la medición fue sin duda la Revolución Francesa y la Era de la Racionalidad que siguió. Esto condujo directamente al sistema métrico que intentó acabar con la confusa multiplicidad de escalas de medición reduciéndolas a unas pocas fundamentales que podrían combinarse para expresar cualquier tipo de cantidad. El sistema métrico se extendió rápidamente por gran parte del mundo, y eventualmente hasta Inglaterra y el resto del Reino Unido cuando ese país estableció vínculos económicos más estrechos con Europa en la última parte del siglo XX. Estados Unidos es actualmente el único país importante en el que la “metricación” ha avanzado poco dentro de su propia sociedad, probablemente por su relativo aislamiento geográfico y su vibrante economía interna.
La ciencia, al ser un esfuerzo verdaderamente internacional, adoptó la medición métrica desde el principio; la ingeniería y las tecnologías relacionadas han sido más lentas para hacer este cambio, pero poco a poco lo están haciendo. Incluso dentro del sistema métrico, sin embargo, se emplearon diversas unidades para medir la misma cantidad fundamental; por ejemplo, la energía podría expresarse dentro del sistema métrico en unidades de ergs, electrón-voltios, julios y dos tipos de calorías. Esto llevó, a mediados de la década de 1960, a la adopción de un conjunto más básico de unidades, las unidades Systeme Internationale (SI) que ahora son reconocidas como el estándar para la ciencia y, cada vez más, para la tecnología de todo tipo.
Las unidades base SI
En principio, cualquier cantidad física puede expresarse en términos de sólo siete unidades base. Cada unidad base está definida por un estándar que se describe en el sitio web del NIST.
| longitud | medidor | m |
| masa | kilogramo | kg |
| tiempo | segundo | s |
| temperatura (absoluta) | kelvin | K |
| cantidad de sustancia | mole | mol |
| corriente eléctrica | amperio | A |
| intensidad luminosa | candela | cd |
Algunos puntos especiales sobre algunas de estas unidades son dignos de destacar:
- La unidad base de masa es única ya que un prefijo decimal (ver abajo) está incorporado en ella; es decir, no es el gramo, como cabría esperar.
- La unidad base de tiempo es la única que no es métrica. Numerosos intentos de hacerlo así nunca han cosechado ningún éxito; todavía estamos atrapados con el sistema 24:60:60 que heredamos de la antigüedad. (Los antiguos egipcios de alrededor del 1500 a.C. inventaron el día de 12 horas, y la parte 60:60 es un remanente del sistema base-60 que los sumerios utilizaron para sus cálculos astronómicos alrededor del 100 a. C.)
- De especial interés para la Química es el mole, la unidad base para expresar la cantidad de materia. Si bien el número no se menciona explícitamente en la definición oficial, los químicos definen al topo como el número de Avogadro (aproximadamente\(6.02 \times 10^{23}\)) de cualquier cosa.
Los prefijos decimales SI
Debido a la amplia gama de valores que pueden tener las cantidades, durante mucho tiempo ha sido la práctica emplear prefijos como milli y mega para indicar fracciones decimales y múltiplos de unidades métricas. Como parte de la norma SI, este sistema ha sido ampliado y formalizado.
| prefijo | abreviatura | multiplicador | — | prefijo | abreviatura | multiplicador |
|---|---|---|---|---|---|---|
| exa | E | 10 18 | deci | d | 10 —1 | |
| peta | P | 10 15 | centi | c | 10 —2 | |
| tera | T | 10 12 | milli | m | 10 —3 | |
| giga | G | 10 9 | micro | μ | 10 —6 | |
| mega | M | 10 6 | nano | n | 10 —9 | |
| kilo | k | 10 3 | pico | p | 10 —12 | |
| hecto | h | 10 2 | femto | f | 10 —15 | |
| deca | da | 10 | atto | a | 10 —18 |
Para obtener una tabla más completa, consulte la página del NIST sobre prefijos SI
Unidades no SI
Existe una categoría de unidades que son miembros “honorarios” de la SI en el sentido de que es aceptable utilizarlas junto con las unidades base definidas anteriormente. Estas incluyen unidades tan mundanas como la hora, minuto, y grado (de ángulo), etc., pero las tres que se muestran aquí son de particular interés para la química, y necesitarás conocerlas.
- litro (\(L\))\[1\, L = 1\, dm^3 = 10^{–3} m^3 \nonumber\]
- tonelada métrica (\(t\))\[1\, t = 10^3 kg \nonumber\]
- unidad de masa atómica (\(u\))\[1\, u = 1.66054×10^{–27}\, kg \nonumber\]
La mayoría de las cantidades físicas que realmente tratamos en la ciencia y también en nuestra vida cotidiana, tienen unidades propias: volumen, presión, energía y resistencia eléctrica son solo algunos de los cientos de ejemplos posibles. Es importante entender, sin embargo, que todos estos pueden expresarse en términos de las unidades base del SI; en consecuencia se les conoce como unidades derivadas.
De hecho, la mayoría de las cantidades físicas pueden expresarse en términos de una o más de las siguientes cinco unidades fundamentales:
| Masa M | longitud L | tiempo T | carga eléctrica Q | temperatura θ (theta) |
Consideremos, por ejemplo, la unidad de volumen, que denotamos como V. Para medir el volumen de una caja rectangular, necesitamos multiplicar las longitudes medidas a lo largo de las tres coordenadas:
\[V = x · y · z\]
Decimos, por lo tanto, que el volumen tiene las dimensiones de longitud-cubicado:
\[dim.V = L^3\]
Así las unidades de volumen serán m 3 (en el SI) o cm 3, ft 3 (inglés), etc. Además, cualquier fórmula que calcule un volumen debe contener dentro de él la dimensión L 3; así el volumen de una esfera es 4/3 π r 3.
Consideremos, por ejemplo, la unidad de volumen, que denotamos como V. Para medir el volumen de una caja rectangular, necesitamos multiplicar las longitudes medidas a lo largo de las tres coordenadas: V = x · y · z Decimos, por lo tanto, ese volumen tiene las dimensiones de longitud-cubicado: dim.V = L 3 Así las unidades de volumen será m 3 (en el SI) o cm 3, ft 3 (inglés), etc. Además, cualquier fórmula que calcule un volumen debe contener dentro de él la dimensión L 3; así el volumen de una esfera es 4/3 πr 3.
Encuentra las dimensiones de la energía.
Solución
Cuando se realiza un trabajo mecánico en un cuerpo, su energía aumenta por la cantidad de trabajo realizado, por lo que las dos cantidades son equivalentes y podemos concentrarnos en el trabajo. Este último es producto de la fuerza aplicada al objeto y la distancia que se desplaza. De la ley de Newton, la fuerza es producto de la masa y la aceleración, y esta última es la velocidad de cambio de velocidad, típicamente expresada en metros por segundo por segundo. Combinando estas cantidades y sus dimensiones arroja el resultado que se muestra aquí.
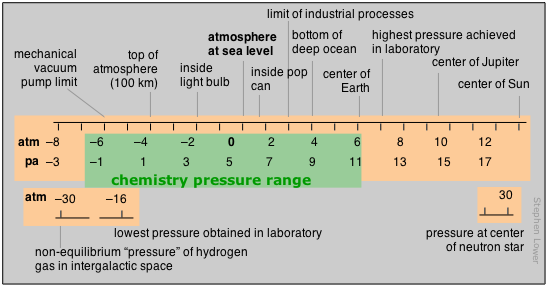
Unidades y sus rangos en Química
En esta sección, veremos algunas de las cantidades que se encuentran ampliamente en Química, y en las unidades en las que se expresan comúnmente. Al hacerlo, también consideraremos el rango real de valores que estas cantidades pueden asumir, tanto en la naturaleza en general, como también dentro del subconjunto de la naturaleza que la química normalmente aborda. Al revisar las diversas unidades de medida, es interesante observar que sus valores unitarios se sitúan cerca de los encontrados en la experiencia humana cotidiana
Masa y peso
Estas dos cantidades están ampliamente confundidas. Aunque a menudo se utilizan como sinónimos en el habla y la escritura informales, tienen diferentes dimensiones: el peso es la fuerza ejercida sobre una masa por el campo gravacional local:
\[f = m a = m g\]
donde g es la aceleración de la gravedad. Si bien el valor nominal de esta última cantidad es de 9.80 m s —2 en la superficie de la Tierra, su valor exacto varía localmente. Debido a que es una fuerza, la unidad de peso SI es propiamente el newton, pero es una práctica común (¡excepto en clases de física!) utilizar los términos “peso” y “masa” indistintamente, por lo que las unidades kilogramos y gramos son aceptables en casi todos los contextos ordinarios de laboratorio.
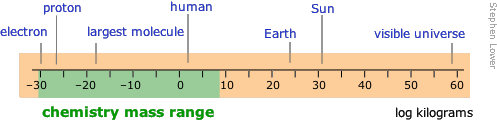
El rango de masas abarca 90 órdenes de magnitud, más que cualquier otra unidad. El rango que normalmente ocupa la química se ha expandido mucho desde los días en que un microgramo era una cantidad casi inconcebiblemente pequeña de material para manejar en el laboratorio; este límite inferior ahora ha caído al nivel atómico con el desarrollo de herramientas para manipular directamente estas partículas. El nivel superior refleja las masas más grandes que se manejan en las operaciones industriales, pero en los campos recientemente desarrollados de geoquímica y química ambiental, el rango puede extenderse indefinidamente. Los flujos de elementos entre las diversas regiones del medio ambiente (atmósfera a océanos, por ejemplo) a menudo se citan en teragramas.
Largo
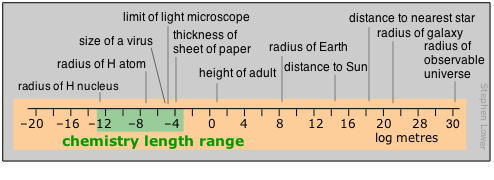
Los químicos tienden a trabajar principalmente en la parte moderadamente pequeña del rango de distancia. Quienes viven en el mundo liliputiano de las estructuras cristalinas y moleculares y los radios atómicos encuentran al picómetro una moneda conveniente, pero todavía se ve la unidad más antigua no SI llamada Ångstrom utilizada en este contexto; 1Å = 10 —10 m = 100pm. La nanotecnología, la furia de la época actual, también reside en este reino. Las moléculas poliméricas y coloides más grandes definen el extremo superior del rango de partículas; más allá de eso, en el mundo normal de hacer las cosas en el laboratorio, generalmente gobiernan el centímetro y ocasionalmente el milímetro.
Tiempo
Para los humanos, el tiempo se mueve por los latidos del corazón; más allá de eso, son los movimientos de nuestro planeta los que cuentan las horas, días y años los que finalmente definen nuestras vidas. Más allá de los pocos miles de años de historia detrás de nosotros, esos años a los poderes de las decenas que son la tarifa para campos como la biología evolutiva, la geología y la cosmología, dejan de transmitir ningún significado real para nosotros. Quizás es por eso que tanta gente no se inclina mucho a aceptar su validez.
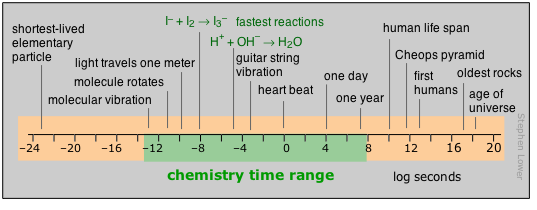
La mayor parte de lo que realmente ocurre en el tubo de ensayo del químico opera en una escala de tiempo mucho más corta, aunque no hay límite para lo lenta que puede ser una reacción; los límites superiores de aquellos que podemos estudiar directamente en el laboratorio están determinados en parte por cuánto tiempo puede esperar un estudiante de posgrado antes de pasar a ser remunerado empleo. Al mirar el mundo microscópico de los átomos y las moléculas mismas, la escala de tiempo vuelve a desplazarnos a un mundo irreal donde los números tienden a perder su significado. Puedes obtener cierta apreciación de la duración de un nanosegundo al señalar que se trata de cuánto tiempo tarda un rayo de luz en viajar entre tus dos manos extendidas. En cierto sentido, los fundamentos materiales de la química en sí están definidos por el tiempo: ni un nuevo elemento ni una molécula pueden reconocerse como tales a menos que dure alrededor lo suficiente como para que se tome su “imagen” a través de la medición de sus propiedades distintivas.
Temperatura
La temperatura, la medida de la intensidad térmica, abarca el rango más estrecho de cualquiera de las unidades base de la medida del químico. La razón de esto está ligada al significado de la temperatura como medida de la intensidad de la energía cinética térmica. El cambio químico ocurre cuando los átomos son empujados hacia nuevos arreglos, y la debilidad de estos movimientos detiene la mayor parte de la química a medida que se acerca al cero absoluto. En el extremo superior de la escala, los movimientos térmicos se vuelven lo suficientemente vigorosos para sacudir las moléculas en átomos, y eventualmente, como en las estrellas, despojan a los electrones, dejando un fluido gaseoso esencialmente sin reacción, o plasma, de núcleos desnudos (iones) y electrones.
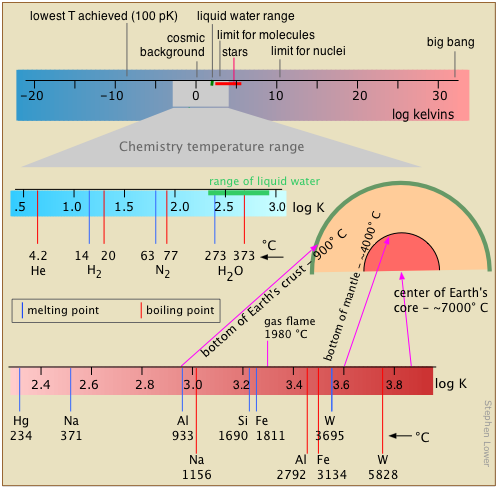
Todos sabemos que la temperatura se expresa en grados. Lo que frecuentemente olvidamos es que el grado es realmente un incremento de temperatura, una fracción fija de la distancia entre dos puntos de referencia definidos en una escala de temperatura.
Presión
La presión es la medida de la fuerza ejercida sobre una unidad de área de superficie. Sus unidades SI son por lo tanto newtons por metro cuadrado, pero hacemos un uso tan frecuente de la presión que una unidad SI derivada, el pascal, se usa comúnmente:
1 Pa = 1 N m —2
El concepto de presión se desarrolló por primera vez en relación con estudios relacionados con la atmósfera y el vacío que se llevaron a cabo por primera vez en el siglo XVII. Las moléculas de un gas se encuentran en un estado de constante movimiento térmico, moviéndose en líneas rectas hasta experimentar una colisión que intercambia impulso entre pares de moléculas y las envía rebotando en otras direcciones. Esto conduce a una distribución completamente aleatoria de las velocidades moleculares tanto en velocidad como en dirección, o lo haría en ausencia del campo gravitacional de la Tierra que ejerce una pequeña fuerza descendente sobre cada molécula, dando a los movimientos en esa dirección una ventaja muy leve. En un contenedor ordinario este efecto es demasiado pequeño para ser perceptible, pero en una columna de aire muy alta el efecto se suma: las moléculas en cada capa vertical experimentan golpes más dirigidos hacia abajo de las que están por encima de ella. La fuerza resultante se aleatoriza rápidamente, lo que resulta en un aumento de la presión en esa capa que luego se propaga hacia abajo hacia las capas de abajo.
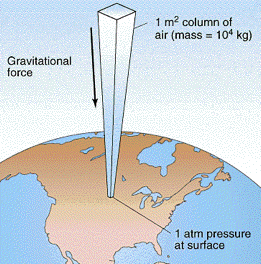
A nivel del mar, la masa total del mar de aire presionando hacia abajo sobre cada 1-cm 2 de superficie es de aproximadamente 1034 g, o 10340 kg m —2. La fuerza (peso) que ejerce la aceleración gravicional de la Tierra g sobre esta masa es
f = ma = mg = (10340 kg m —2) (9.81 m s —2) = 1.013 × 10 5 kg m s —2 = 1.013 × 10 5 newtons
lo que resulta en una presión de
\[1.013 × 10^5 N\, m^{–2} = 1.013 × 10^5 pa.\]
La presión real al nivel del mar varía con las condiciones atmosféricas, por lo que se acostumbra definir la presión atmosférica estándar como 1 atm = 1.013 10 5 pa o 101 kpa. Aunque la atmósfera estándar no es una unidad SI, sigue siendo ampliamente empleada. En meteorología, a menudo se usa la barra, exactamente 1.000 × 10 5 = 0.967 atm.
A principios del siglo XVII, el físico y matemático italiano Evangalisto Torricelli inventó un dispositivo para medir la presión atmosférica. El barómetro torricelliano consiste en un tubo de vidrio vertical cerrado en la parte superior y abierto en la parte inferior. Se llena con un líquido, tradicionalmente mercurio, y luego se invierte, con su extremo abierto sumergido en el recipiente del mismo líquido. El nivel de líquido en el tubo caerá por su propio peso hasta que la fuerza descendente sea equilibrada por la fuerza vertical transmitida hidrostáticamente a la columna por la fuerza descendente de la atmósfera que actúa sobre la superficie del líquido en el recipiente abierto. Torricelli también fue el primero en reconocer que el espacio por encima del mercurio constituía un vacío, y se le atribuye ser el primero en crear un vacío.
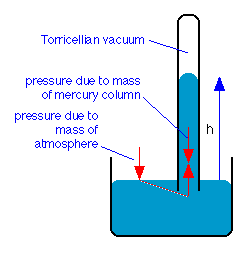
Una atmósfera estándar soportará una columna de mercurio de 76 cm de altura, por lo que el “milímetro de mercurio”, ahora más comúnmente conocido como el torr, ha sido durante mucho tiempo una unidad de presión común en las ciencias: 1 atm = 760 torr.


