5.3: Luz, Partículas y Ondas
- Page ID
- 70955
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Asegúrese de comprender a fondo las siguientes ideas esenciales
- Citar dos piezas de evidencia experimental que demuestran, respectivamente, la naturaleza de onda y partícula de la luz.
- Definir los términos amplitud, longitud de onda y frecuencia tal como se aplican a los fenómenos de onda.
- Dar una descripción cualitativa de la radiación electromagnética en términos de campos electrostáticos y magnéticos.
- Ser capaz de nombrar las regiones principales del espectro electromagnético (rayos X, región infrarroja, etc.) y especificar su secuencia en términos de longitud de onda o energía por fotón.
- Describir la diferencia entre los espectros lineales y los espectros continuos tanto en cuanto a su apariencia como a sus orígenes.
- ¿Qué se entiende por la longitud de onda de Broglie de una partícula? ¿Cómo afectarán la masa y velocidad de la partícula a la longitud de onda?
- Indique las consecuencias del principio de incertidumbre de Heisenberg en sus propias palabras.
Nuestra visión intuitiva del “mundo real” es aquella en la que los objetos tienen masas, tamaños, ubicaciones y velocidades definidas. Una vez que bajamos al nivel atómico, esta simple vista comienza a descomponerse. Se vuelve totalmente inútil cuando bajamos al nivel subatómico y consideramos la más ligera de todas las partículas químicamente significativas, el electrón. Las propiedades químicas de un tipo particular de átomo dependen de la disposición y el comportamiento de los electrones que componen casi todo el volumen del átomo. La estructura electrónica de un átomo sólo puede determinarse indirectamente observando la manera en que los átomos absorben y emiten luz. La luz, como ya sabrás, tiene propiedades onduladas, por lo que necesitamos saber algo sobre las ondas para poder interpretar estas observaciones. Pero debido a que los electrones son en sí mismos partículas cuánticas y por lo tanto tienen propiedades ondulares propias, encontraremos que una comprensión del comportamiento de los electrones en los átomos solo se puede obtener a través del lenguaje de las ondas.
El lenguaje de la luz
Los átomos son demasiado pequeños para ver directamente, incluso con los microscopios ópticos más potentes. Pero los átomos sí interactúan y bajo algunas circunstancias emiten luz de formas que revelan sus estructuras internas con un detalle increíblemente fino. Es a través del “lenguaje de la luz” que nos comunicamos con el mundo del átomo. Esta sección te presentará los rudimentos de esta lengua.
¿Onda, partícula o qué?
A principios del siglo XIX, el científico inglés Thomas Young llevó a cabo el famoso experimento de doble hendidura que demostró que un haz de luz, cuando se divide en dos haces y luego se recombina, mostrará efectos de interferencia que solo pueden explicarse asumiendo que la luz es una perturbación ondulada. Para 1820, Augustin Fresnel había puesto esta teoría sobre una base matemática sólida, pero la naturaleza exacta de las ondas permaneció poco clara hasta la década de 1860 cuando James Clerk Maxwell desarrolló su teoría electromagnética.

Pero la explicación de Einstein del efecto fotoeléctrico en 1905 mostró que la luz también exhibe una naturaleza parecida a partículas. El fotón es el paquete más pequeño posible (cuántico) de luz; tiene masa cero pero una energía definida.
Cuando se realizan experimentos de interferencia de ondas de luz con intensidades de luz extremadamente bajas, la teoría de ondas se descompone; en lugar de registrar una sucesión suave de patrones de interferencia como se muestra arriba, un detector extremadamente sensible ve pulsos individuales, es decir, fotones individuales.
Nota
Supongamos que realizamos el experimento de interferencia de doble rendija utilizando un haz de luz tan débil que solo un fotón a la vez pasa por el aparato (es experimentalmente posible contar fotones individuales, por lo que este es un experimento práctico). Cada fotón pasa por la primera hendidura, y luego a través de una u otra del segundo conjunto de hendiduras, eventualmente golpeando la película fotográfica donde crea un pequeño punto. Si desarrollamos la película después de que haya pasado un número suficiente de fotones, encontramos el mismo patrón de interferencia que obtuvimos con luz de mayor intensidad cuyo comportamiento podría explicarse por la interferencia de ondas.
Aquí hay algo extraño. Cada fotón, actuando como una partícula, debe pasar por una u otra del par de hendiduras, por lo que esperaríamos obtener sólo dos grupos de manchas en la película, cada una opuesta a una de las dos rendijas. En cambio, parece que cada partícula, al pasar por una hendidura, “conoce” a la otra, y ajusta su trayectoria final para construir un patrón de interferencia en forma de onda.
Se vuelve aún más extraño: supongamos que configuramos un detector para determinar a qué hendidura se dirige un fotón, y luego bloqueamos la otra hendidura con un obturador. Encontramos que el fotón navega recto a través de la hendidura abierta y sobre la película sin tratar de crear ningún tipo de patrón de interferencia. Al parecer, cualquier intento de observar el fotón como una partícula discreta hace que se comporte como tal.
Un conocido físico (Landé) sugirió que tal vez deberíamos acuñar una nueva palabra, wavicle, para reflejar esta dualidad.
Más tarde, prácticamente el mismo experimento se repitió con electrones, demostrando así que las partículas pueden tener propiedades onduladas (como predijo el físico francés Louis de Broglie en 1923), así como lo que convencionalmente se pensaba que eran ondas electromagnéticas poseen propiedades similares a partículas.
¿Es una partícula o es una onda?
Para los cuerpos grandes (la mayoría de los átomos, pelotas de béisbol, autos) no hay duda: las propiedades de las olas son insignificantes, y las leyes de la mecánica clásica pueden describir adecuadamente sus comportamientos. Pero para partículas tan pequeñas como los electrones (partículas cuánticas), la situación es bastante diferente: en lugar de moverse por caminos bien definidos, una partícula cuántica parece tener infinidad de caminos que se abren paso a través del espacio, buscando y recogiendo información sobre todas las rutas posibles, y luego ajustando su comportamiento para que su trayectoria final, cuando se combina con la de otros, produzca el mismo efecto general que veríamos a partir de un tren de ondas de longitud de onda = h/mv.

Llevando a su extremo esta idea de indeterminación cuántica, el físico Erwin Schrödinger propuso un “experimento de pensamiento” en el que la desintegración radiactiva de un átomo iniciaría una cadena de eventos que conducirían a la muerte de un gato colocado en una caja cerrada. El átomo tiene un 50% de probabilidad de descomponerse en una hora, lo que significa que su representación de onda contendrá ambas posibilidades hasta que se haga una observación. La pregunta, entonces, es ¿el gato estará simultáneamente en un estado vivo y muerto hasta que se abra la caja? Si es así, esto plantea todo tipo de preguntas interesantes sobre la naturaleza del ser.
Lo que necesitas saber sobre las olas
Utilizamos el término “onda” para referirnos a una cantidad que cambia con el tiempo. Las olas en las que los cambios ocurren de manera repetida o periódica son de especial importancia y están muy extendidas en la naturaleza; piense en los movimientos de la superficie oceánica, las variaciones de presión en una tubería de órgano o las vibraciones de una cuerda de guitarra arrancada. Lo interesante de todos esos fenómenos repetitivos es que pueden describirse mediante las mismas ecuaciones matemáticas.
El movimiento de las olas surge cuando una perturbación periódica de algún tipo se propaga a través de un medio; variaciones de presión a través del aire, movimientos transversales a lo largo de una cuerda de guitarra, o variaciones en las intensidades de los campos eléctricos y magnéticos locales en el espacio, lo que constituye radiación electromagnética. Para cada medio, existe una velocidad característica a la que viaja la perturbación.

Hay tres propiedades medibles del movimiento de las olas: amplitud, longitud de onda y frecuencia, el número de vibraciones por segundo. La relación entre la longitud de onda\(λ\) (lambda griega) y la frecuencia de una onda\ ( u\) (griego nu) está determinada por la velocidad de propagación v.
\ [v = u λ\]
¿Cuál es la longitud de onda de la nota musical A = 440 hz cuando se propaga a través del aire en la que la velocidad del sonido es 343 m s —1?
Solución
\ [λ =\ dfrac {v} { u} =\ dfrac {343\; m\, s^ {—1}} {440\, s^ {—1}} = 0.80\; m\]
Luz y radiación electromagnética
El descubrimiento de Michael Faraday de que las corrientes eléctricas podrían dar lugar a campos magnéticos y viceversa planteó la cuestión de cómo estos efectos se transmiten a través del espacio. Alrededor de 1870, el físico escocés James Clerk Maxwell (1831-1879) demostró que esta radiación electromagnética puede describirse como un tren de campos eléctricos y magnéticos oscilantes perpendiculares.

Maxwell pudo calcular la velocidad a la que se propagan las perturbaciones electromagnéticas, y encontró que esta velocidad es la misma que la de la luz. Por lo tanto, propuso que la luz es en sí misma una forma de radiación electromagnética cuyo rango de longitud de onda forma sólo una parte muy pequeña de todo el espectro electromagnético. El trabajo de Maxwell sirvió para unificar lo que alguna vez se pensó que eran reinos completamente separados del movimiento de las olas.
El espectro electromagnético
El espectro electromagnético se divide convencionalmente en varias partes como se representa en el diagrama siguiente, en el que las cuatro escalas logarítmicas correlacionan la longitud de onda de la radiación electromagnética con su frecuencia en herz (unidades de s-1) y la energía por fotón, expresada tanto en julios como electrón-voltios.
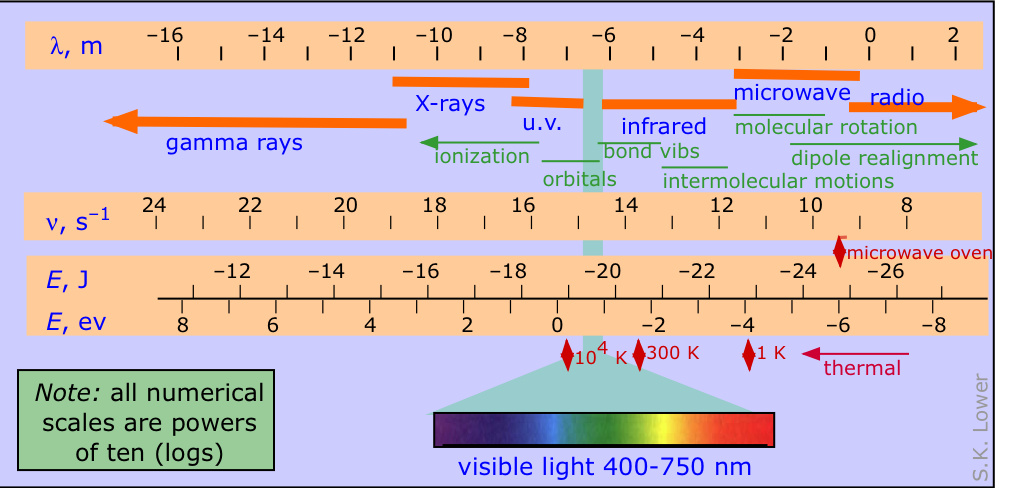
Los otros elementos mostrados en el diagrama, de arriba hacia abajo, son:
- los nombres utilizados para denotar los diversos rangos de longitud de onda de radiación (debe conocer sus nombres y el orden en que aparecen)
- los principales efectos de la radiación en átomos y moléculas
- los picos de radiación térmica emitidos por cuerpos negros a tres temperaturas diferentes
Radiación electromagnética y química. Vale la pena señalar que la radiación en el rango ultravioleta puede tener efectos químicos directos al ionizar átomos e interrumpir los enlaces químicos. La radiación de longitud de onda más larga puede interactuar con átomos y moléculas de manera que proporcionan un valioso medio para identificarlos y revelar características estructurales particulares.
Unidades y magnitudes de energía
Es útil desarrollar algún sentimiento por las diversas magnitudes de energía con las que debemos lidiar. La unidad básica de energía del SI es el Joule; la aparición de esta unidad en la constante h de Planck nos permite expresar el equivalente energético de la luz en julios. Por ejemplo, la luz de longitud de onda 500 nm, que parece azul-verde para el ojo humano, tendría una frecuencia de
El cuántico de energía transportado por un solo fotón de esta frecuencia es
Otra unidad de energía que se emplea comúnmente en la física atómica es el electrón voltio; esta es la energía cinética que adquiere un electrón al ser acelerado a través de una diferencia de potencial de 1 voltio. La relación 1 eV = 1.6022E—19 J da una energía de 2.5 eV para los fotones de luz azul-verde.
Dos pequeñas baterías de linterna producirán alrededor de 2.5 voltios, y así podrían, en principio, dar a un electrón aproximadamente la misma cantidad de energía cinética que la luz azul-verde puede suministrar. Debido a que la energía producida por una batería deriva de una reacción química, esta cantidad de energía es representativa de la magnitud de los cambios de energía que acompañan a las reacciones químicas.
En términos más familiares, un mol de fotones de 500 nm tendría un equivalente energético del número de Avogadro multiplicado por 4E—19 J, o 240 kJ por mol. Esto es comparable a la cantidad de energía requerida para romper algunos enlaces químicos. Muchas sustancias son capaces de sufrir reacciones químicas después de la interrupción inducida por la luz de su enlace interno; se dice que tales moléculas son fotoquímicamente activas.
Espectros: Interacción de luz y materia
Espectros continuos
Cualquier cuerpo cuya temperatura esté por encima del cero absoluto emite radiación que cubre un amplio rango de longitudes de onda. A temperaturas muy bajas las longitudes de onda predominantes se encuentran en la región de radio microondas. A medida que aumenta la temperatura, las longitudes de onda disminuyen; a temperatura ambiente, la mayor parte de la emisión es en el infrarrojo.
A temperaturas aún más altas, los objetos comienzan a emitir en la región visible, al principio en el rojo, y luego se mueven hacia el azul a medida que aumenta la temperatura. Estos espectros de emisión térmica se describen como espectros continuos, ya que todas las longitudes de onda dentro del amplio rango de emisión están presentes.

La fuente de emisión térmica más familiar para nosotros es el Sol. Cuando la luz solar es refractada por gotitas de lluvia en un arco iris o por un prisma en una pantalla de visualización, vemos la parte visible del espectro.

Al rojo vivo, blanco caliente, azul caliente... tu guía aproximada de temperaturas de objetos calientes.
Espectros de línea
Calienta una pieza de hierro hasta cerca de su punto de fusión y emitirá un amplio espectro continuo que el ojo percibe como naranja-amarillo. Pero si zap el hierro con una chispa eléctrica, algunos de los átomos de hierro se vaporizarán y tendrán uno o más de sus electrones temporalmente eliminados de ellos. A medida que se enfríen los electrones se volverán a combinar con los iones de hierro, perdiendo energía a medida que se mueven hacia el núcleo y renunciando a este exceso de energía como luz. El espectro de esta luz es todo menos continuo; consiste en una serie de longitudes de onda discretas que llamamos líneas.

Cada elemento químico tiene su propio espectro lineal característico que sirve muy parecido a una “huella digital” capaz de identificar un elemento particular en una mezcla compleja. A continuación se muestra lo que verías si pudieras mirar varios espectros de líneas atómicas diferentes directamente.

Los espectros de líneas atómicas son extremadamente útiles para identificar pequeñas cantidades de diferentes elementos en una mezcla.
- Las empresas que poseen grandes flotas de camiones y autobuses envían regularmente sus muestras de aceite de motor del cárter a análisis espectrográfico. Si encuentran altos niveles de ciertos elementos (como el vanadio) que ocurren solo en ciertas aleaciones, esto puede indicar que ciertas partes del motor están sufriendo un desgaste severo. Esto permite que el personal mecánico tome medidas correctivas antes de que ocurra una falla del motor.
- Varios elementos (Rb, Cs, Tl) fueron descubiertos observando líneas espectrales que no correspondían a ninguno de los elementos entonces conocidos. El helio, que solo está presente en las huellas de la Tierra, fue descubierto por primera vez observando el espectro del Sol.
- Una aplicación más prosaica de los espectros atómicos es la determinación de los elementos presentes en las estrellas.
Si vives en una ciudad, ¡probablemente veas fuentes de luz de línea atómica todas las noches! Los letreros de “neón” son los más coloridos y espectaculares, pero el alumbrado público de alta intensidad es la fuente más extendida. Una mirada al espectro de emisión (arriba) del sodio explica el intenso color amarillo de estas lámparas. El espectro de mercurio (no mostrado) tiene de manera similar sus líneas más fuertes en la región azul-verde.
Partículas y ondas
Hay un concepto más fundamental que debes conocer antes de poder adentrarnos en los detalles de los átomos y sus espectros. Si la luz tiene una naturaleza de partículas, ¿por qué las partículas no deberían poseer características onduladas? En 1923 un joven físico francés, Louis de Broglie, publicó un argumento que demostraba que la materia debería tener, en efecto, una naturaleza ondulada. La longitud de onda de Broglie de un cuerpo es inversamente proporcional a su momentum mv:
\[ \lambda =\dfrac{h}{mv}\]
Si exploras la magnitud de las cantidades en esta ecuación (recuerda que h es alrededor de 10 —33 J s), será evidente que las longitudes de onda de todos menos los cuerpos más ligeros son fracciones insignificantemente pequeñas de sus dimensiones, de modo que todos los objetos de nuestro mundo cotidiano tienen límites definidos. Incluso los átomos individuales son lo suficientemente masivos como para que su carácter de onda no sea observable en la mayoría de los tipos de experimentos. Los electrones, sin embargo, son otra cuestión; el electrón fue de hecho la primera partícula cuyo carácter ondular se vio experimentalmente, siguiendo la predicción de Broglie. Su pequeña masa (9.1E—31 kg) la convirtió en un candidato obvio, y velocidades de alrededor de 100 km/s se obtienen fácilmente, produciendo un valor de λ en la ecuación anterior que supera bien lo que pensamos como el “radio” del electrón. A tales velocidades el electrón se comporta como si estuviera “extendido” a dimensiones atómicas; un haz de estos electrones puede ser difractado por las filas ordenadas de átomos en un cristal de la misma manera que la luz visible es difractada por las arboledas estrechamente espaciadas de una grabación de CD.
La difracción de electrones se ha convertido en una herramienta importante para investigar las estructuras de moléculas y de superficies sólidas.
En el microscopio electrónico se observa una explotación más familiar de las propiedades ondulares de los electrones, cuya utilidad depende de que la longitud de onda de los electrones sea mucho menor que la de la luz visible, permitiendo así que el haz de electrones revele detalles en una escala correspondientemente menor .
El principio de incertidumbre
En 1927, el físico alemán Werner Heisenberg señaló que la naturaleza de onda de la materia lleva a una conclusión profunda y de largo alcance: ningún método de observación, por muy perfectamente que se lleve a cabo, puede revelar tanto la ubicación exacta como el momento (y por lo tanto la velocidad ) de una partícula. Este es el origen del concepto ampliamente conocido de que el mismo proceso de observación cambiará el valor de la cantidad que se observa. El principio de Heisenberg puede expresarse matemáticamente por la desigualdad
\[ \Delta{x}\Delta{p} \leq \dfrac{h}{2\pi}\]
en el que los\(\Delta\) (deltas) representan las incertidumbres con las que se conoce la ubicación y el impulso.
Nota
Supongamos que desea medir la ubicación exacta de una partícula que está en reposo (impulso cero). Para lograrlo, se debe “ver” la molécula iluminándola con luz u otra radiación. Pero la luz actúa como un haz de fotones, cada uno de los cuales posee el impulso h/λ en el que λ es la longitud de onda de la luz. Cuando un fotón choca con la partícula, transfiere parte de su impulso a la partícula, alterando así tanto su posición como su momento.
Observe cómo la forma de esta expresión predice que si la ubicación de un objeto se conoce exactamente (\(\Delta{x} = 0\)), entonces la incertidumbre en el momento debe ser infinita, lo que significa que no se puede conocer nada en absoluto sobre la velocidad. De igual manera, si la velocidad se especificara exactamente, entonces la ubicación sería completamente incierta y la partícula podría estar en cualquier lugar. Una consecuencia interesante de este principio es que incluso a una temperatura de cero absoluto, las moléculas en un cristal deben poseer todavía una pequeña cantidad de movimiento vibratorio de punto cero, suficiente para limitar la precisión a la que podemos medir sus ubicaciones en la red cristalina.
Una formulación equivalente del principio de incertidumbre relaciona las incertidumbres asociadas a una medición de la energía de un sistema con el tiempo que\(\Delta{t}\) se tarda en realizar la medición:
\[ \Delta{E}\Delta{t} \leq \dfrac{h}{2 \pi}\]
La “incertidumbre” a la que se hace referencia aquí va mucho más allá de limitarse a limitar nuestra capacidad de observar la cantidad\(\Delta{x}\Delta{p}\) a una precisión mayor que \(h/2\ pi\). Significa, más bien, que este producto no tiene valor exacto, ni, por extensión, hacer posición e impulso a escala microscópica. Un término más apropiado sería la indeterminación, que está más cerca de la palabra original Ungenauigkeit de Heisenberg.
La naturaleza revolucionaria El principio de incertidumbre de Heisenberg pronto se extendió mucho más allá del arcano mundo de la física; sus consecuencias entraron rápidamente en el reino de las ideas y ha inspirado numerosas obras creativas en las artes, ¡pocas de las cuales realmente tienen mucho que ver con el Principio! Una posible excepción es la aclamada obra de Michael Frayn (ver más abajo) que ha traído una idea del pensamiento de Heisenberg a un amplio segmento del público.


