5.4: El átomo de Bohr
- Page ID
- 70974
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Describir los modelos Thompson, Rutherford y los primeros modelos planetarios del átomo, y explicar por qué este último no es consistente con la física clásica.
- Indicar los principales conceptos que distinguían el modelo de Bohr del átomo del modelo planetario anterior.
- Dar un ejemplo de una onda estacionaria mecánica; indicar el significado y la importancia de sus condiciones límite.
- Esboce un diagrama que muestre cómo se aplica el concepto de onda estacionaria a la descripción del electrón en un átomo de hidrógeno.
- ¿Qué es un espectro de emisión de línea atómica? ¿Cuál es la significación de la región continua de un espectro de emisión? Dibuje un dibujo que muestre lo esencial de dicho espectro, incluyendo el límite de ionización y el continuo.
- Describir la manera en que los números cuánticos de Bohr explican el espectro observado de un átomo típico.
- Explicar la relación entre el espectro de absorción y emisión de un átomo.
Nuestro objetivo en esta unidad es ayudarle a entender cómo debe seguir la disposición de la tabla periódica de los elementos como consecuencia necesaria de las leyes fundamentales del comportamiento cuántico de la materia. La teoría moderna del átomo hace pleno uso de la dualidad onda-partícula de la materia. Para desarrollar y presentar esta teoría de manera integral, requeriríamos una serie de herramientas matemáticas que se encuentran más allá del alcance de este curso. Por lo tanto, presentaremos la teoría de manera semi-cualitativa, enfatizando sus resultados y sus aplicaciones, más que su derivación.
Modelos del átomo
Los modelos son ampliamente empleados en la ciencia para ayudar a entender cosas que no se pueden ver directamente. La idea es imaginar un sistema o proceso simplificado que podría esperarse que exhiba las propiedades básicas o el comportamiento de lo real, para luego probar este modelo con ejemplos más complicados y modificarlo según sea necesario. Aunque siempre se encuentra en un terreno filosófico inestable al tratar de equiparar un modelo con la realidad, llega un punto en el que la diferencia entre ellos se vuelve insignificante para la mayoría de los propósitos prácticos.
El modelo planetario
La demostración de Thompson en 1867 de que todos los átomos contienen unidades de carga eléctrica negativa condujo al primer modelo basado en la ciencia del átomo que preveía que los electrones se extendieran uniformemente por todo el volumen esférico del átomo. Ernest Rutherford, un neozelandés que comenzó como estudiante de Thompson en Cambridge, desconfió de este modelo de “pudín de ciruela” (como lo llamó) y pronto lo puso a descansar; el famoso experimento de bombardeo de rayos alfa de Rutherford (realizado, en 1909, por sus alumnos Hans Geiger y Ernest Marsden) demostró que casi todos la masa del átomo se concentra en un cuerpo extremadamente pequeño (y por lo tanto extremadamente denso) llamado núcleo. Esto lo llevó a sugerir el modelo planetario del átomo, en el que los electrones giran en órbitas alrededor del “sol” nuclear.

Aunque hace tiempo que el modelo planetario ha sido desacreditado, parece haber encontrado un lugar permanente en las representaciones populares del átomo, y ciertos aspectos del mismo siguen siendo útiles para describir y clasificar la estructura y el comportamiento atómico. El modelo planetario del átomo asumió que la atracción electrostática entre el núcleo central y el electrón se equilibra exactamente por la fuerza centrífuga creada por la revolución del electrón en su órbita. Si este equilibrio no estuviera presente, el electrón o caería al núcleo, o sería arrojado fuera del átomo.

La dificultad con esta imagen es que es inconsistente con un hecho bien establecido de la electrodinámica clásica que dice que cada vez que una carga eléctrica sufre un cambio de velocidad o dirección (es decir, aceleración, que debe ocurrir si el electrón da vueltas alrededor del núcleo), debe continuamente irradian energía. Si los electrones realmente siguieran tal trayectoria, todos los átomos actuarían son estaciones de radiodifusión en miniatura. Además, la energía radiada vendría de la energía cinética del electrón orbitante; a medida que esta energía se irradia, hay menos fuerza centrífuga para oponerse a la fuerza de atracción debida al núcleo. El electrón caería rápidamente en el núcleo, siguiendo una trayectoria que se conoció como la “espiral de muerte del electrón”. Según la física clásica, ningún átomo basado en este modelo podría existir por más de una breve fracción de segundo.
Modelo de Bohr
Niels Bohr fue un brillante físico danés que llegó a dominar el mundo de la física atómica y nuclear durante la primera mitad del siglo XX. Bohr sugirió que el modelo planetario podría salvarse si se hiciera una nueva suposición: ciertos “estados especiales de movimiento” del electrón, correspondientes a diferentes radios orbitales, no darían como resultado radiación, y por lo tanto podrían persistir indefinidamente sin que el electrón cayera en el núcleo. Específicamente, Bohr postuló que el momento angular del electrón, mvr (la masa y velocidad angular del electrón y en una órbita de radio\(r\)) se restringe a valores que son múltiplos integrales de\(h/2\pi\). El radio de una de estas órbitas de Bohr permitidas viene dado por
\ [r=\ dfrac {nh} {2\ pi m u}\]

en la que h es la constante de Planck, m es la masa del electrón, v es la velocidad orbital, y n solo puede tener los valores enteros 1, 2, 3, etc. El aspecto más revolucionario de esta suposición fue su uso de la variable entero n; esta fue la primera aplicación del concepto del número cuántico a la materia. Cuanto mayor sea el valor de n, mayor será el radio de la órbita del electrón, y mayor será la energía potencial del electrón.
A medida que el electrón se mueve hacia órbitas de radio creciente, lo hace en oposición a la fuerza restauradora debida al núcleo positivo, y su energía potencial se eleva con ello. Esto es totalmente análogo al aumento de energía potencial que se produce cuando cualquier sistema mecánico se mueve contra una fuerza restauradora, como, por ejemplo, cuando se estira una banda de goma o se levanta un peso.
Así lo que decía Bohr, en efecto, es que el átomo sólo puede existir en ciertos estados energéticos discretos: se cuantifica la energía del átomo. Bohr señaló que esta cuantificación explicaba muy bien el espectro de emisión observado del átomo de hidrógeno. El electrón normalmente se encuentra en su órbita permitida más pequeña, correspondiente a n = 1; al ser excitado en una descarga eléctrica o por luz ultravioleta, el átomo absorbe energía y el electrón es promovido a niveles cuánticos más altos. Estos estados superiores excitados del átomo son inestables, por lo que después de un tiempo muy corto (alrededor de 10 —9 s) el electrón cae en órbitas inferiores y finalmente en la más interna, que corresponde al estado fundamental del átomo. La energía perdida en cada salto se emite como fotón, y la frecuencia de esta luz proporciona una medición experimental directa de la diferencia en las energías de los dos estados, de acuerdo con la relación Planck-Einstein e = h ν.
Vibraciones, ondas estacionarias y estados ligados
La teoría de Bohr funcionó; explicó completamente el espectro observado del átomo de hidrógeno, y este triunfo luego le ganaría un premio Nobel. La principal debilidad de la teoría, como el propio Bohr fue el primero en admitir, es que no podría ofrecer una buena explicación de por qué estas órbitas especiales inmunizaron al electrón para que no irradiara su energía. La única justificación de la propuesta, aparte de la que parece funcionar, proviene de su analogía con ciertos aspectos del comportamiento de los sistemas mecánicos vibratorios.
Espectro de una cuerda de guitarra
Para producir un tono cuando se arranca, se debe fijar una cuerda de guitarra en cada extremo (es decir, debe ser un sistema encuadernado) y debe estar bajo cierta tensión. Solo bajo estas condiciones una perturbación transversal será contrarrestada por una fuerza restauradora (la tensión de la cuerda) para establecer una vibración sostenida. Tener la cuerda atada en ambos extremos coloca una condición de límite muy importante en el movimiento: los únicos modos permitidos de vibración son aquellos cuyas longitudes de onda producen cero desplazamientos en los extremos ligados de la cuerda; si la cuerda se rompe o se desata en un extremo, se vuelve silenciosa.
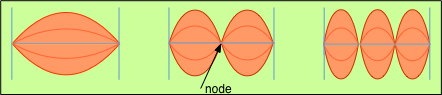
En su modo de vibración de menor energía existe una sola onda cuyo punto de desplazamiento máximo se coloca en el centro de la cuerda. En términos musicales, esto corresponde a la nota fundamental a la que se afina la cuerda; en términos de la teoría de las vibraciones, corresponde a un “número cuántico” de 1. Los modos superiores, conocidos como armónicos (y en la música, como octavas), contienen 2, 3, 4 y más puntos de desplazamiento máximo (antinodos) espaciados uniformemente a lo largo de la cadena, separados por puntos de desplazamiento cero (nodos). Estos corresponden a números cuánticos sucesivamente más altos y energías más altas.
Los estados vibracionales de la cuerda se cuantifican en el sentido de que debe estar presente un número integral de antinodos. Obsérvese nuevamente que esta condición es impuesta por la condición de límite de que los extremos de la cadena, al estar fijos en su lugar, deben ser nodos. Debido a que las ubicaciones de los nodos y antinodos no cambian a medida que la cuerda vibra, los patrones vibracionales se conocen como ondas estacionarias.
Un tipo similar de cuantificación ocurre en otros instrumentos musicales; en cada caso las vibraciones, ya sean de una cuerda estirada, una columna de aire, o de una membrana estirada.
Las ondas estacionarias viven en lugares distintos a los átomos e instrumentos musicales: cada vez que enciendes tu horno microondas, un complejo conjunto de ondas estacionarias llena el interior. Lo que es “ondear” aquí es el campo electrostático alterno en función de la ubicación; los patrones de onda están determinados por las dimensiones del interior del horno y por los objetos colocados dentro de él. Pero la parte de una pizza que pasa a estar ubicada en un nodo no se calentaría mucho, por lo que todos los hornos de microondas proporcionan un medio mecánico de rotar ya sea el alimento (sobre una plataforma circular) o el haz de microondas (por medio de un deflector giratorio) para que todas las partes pasen por partes de alta amplitud de las olas .Ondas estacionarias en el átomo de hidrógeno
La analogía con el átomo se puede ver imaginando una cuerda de guitarra que se ha cerrado en círculo. El círculo es la órbita electrónica, y la condición límite es que las ondas no deben interferir consigo mismas a lo largo del círculo. Esta condición solo se puede cumplir si la circunferencia de una órbita puede acomodar exactamente un número integral de longitudes de onda. Así, solo se permiten ciertos radios y energías orbitales discretos, como se representa en los dos diagramas siguientes.


Estados no vinculados
Si una cuerda de guitarra es arrancada con tanta dureza que se rompe, la fuerza restauradora y las condiciones límite que restringían sus movimientos a unas frecuencias discretas relacionadas armónicamente están repentinamente ausentes; sin restricción alguna en su movimiento, la energía mecánica de la cuerda se disipa de manera aleatoria sin música efecto. De la misma manera, si un átomo absorbe tanta energía que el electrón ya no está unido al núcleo, entonces los estados energéticos del átomo ya no se cuantifican; en lugar del espectro lineal asociado a saltos de energía discreta, el espectro degenera en un continuo en el que todas las energías de electrones posibles están permitidos. La energía a la que comienza el continuo de ionización de un átomo se observa fácilmente espectroscópicamente, y sirve como un método simple para medir experimentalmente la energía con la que el electrón se une al átomo.
Espectro del átomo de hidrógeno
El hidrógeno, el átomo más simple, también tiene el espectro lineal más simple (los espectros lineales se introdujeron brevemente en el capítulo anterior). El espectro de hidrógeno fue el primero en ser observado (por Ånders Ångström en la década de 1860). Johannn Balmer, un profesor alemán de secundaria, descubrió una fórmula matemática simple que relacionaba las longitudes de onda de las diversas líneas que son observables en las partes visibles y casi uv del espectro. Este conjunto de líneas ahora se conoce como la Serie Balmer.

Las cuatro líneas en el espectro visible (designadas por α a δ) fueron las primeras observadas por Balmer. Observe cómo las líneas se agrupan a medida que se acercan al límite de ionización en la parte casi ultravioleta del espectro. Una vez que el electrón ha salido del átomo, se encuentra en un estado no unido y su energía ya no se cuantifica. Cuando tales electrones regresan al átomo, poseen cantidades aleatorias de energías cinéticas por encima y por encima de la energía de unión. Esto se revela como la radiación en el extremo de longitud de onda corta del espectro conocido como radiación continua. Otros conjuntos de líneas nombradas en el espectro de hidrógeno son la serie Lyman (en el ultravioleta) y las series Paschen, Brackett, Pfund y Humphrey en el infrarrojo.
Cómo explica el modelo Bohr el espectro de la línea de hidrógeno
Cada línea espectral representa una diferencia de energía entre dos posibles estados del átomo. Cada uno de estos estados corresponde a que el electrón en el átomo de hidrógeno esté en una “órbita” cuyo radio aumenta con el número cuántico n. El valor más bajo permitido de n es 1; debido a que el electrón está lo más cerca del núcleo como puede llegar, la energía del sistema tiene su valor mínimo (más negativo). Este es el estado “normal” (más estable) del átomo de hidrógeno, y se llama estado fundamental.

Si un átomo de hidrógeno absorbe radiación cuya energía corresponde a la diferencia entre la de n =1 y algún valor mayor de n, se dice que el átomo está en estado excitado. Los estados excitados son inestables y decaen rápidamente al estado fundamental, pero no siempre en un solo paso. Por ejemplo, si el electrón es promovido inicialmente al estado n =3, puede decaer ya sea al estado fundamental o al estado n =2, que luego decae a n =1. Así, esta única excitación n =1→3 puede dar como resultado las tres líneas de emisión representadas en el diagrama anterior, correspondientes a n = 3→1, n = 3→2 y n = 2→1.
Si, en cambio, se suministra suficiente energía al átomo para eliminar completamente el electrón, terminamos con un ión hidrógeno y un electrón. Cuando estas dos partículas se recombinan (H + + e — → H), el electrón puede encontrarse inicialmente en un estado correspondiente a cualquier valor de n, lo que lleva a la emisión de muchas líneas.

Las líneas del espectro de hidrógeno se pueden organizar en diferentes series según el valor de n en el que termina la emisión (o en el que se origina la absorción). Las primeras series llevan el nombre de sus descubridores. La más conocida (y observada por primera vez) es la serie Balmer, que se encuentra principalmente en la región visible del espectro. Las líneas de Lyman están en el ultravioleta, mientras que las otras series se encuentran en el infrarrojo. Las líneas de cada serie se agrupan a medida que convergen hacia el límite de la serie que corresponde a la ionización del átomo y se observa como el inicio de la emisión continua. Tenga en cuenta que la energía de ionización del hidrógeno (a partir de su estado fundamental) es 1312 kJ mol —1. Si bien es posible un número infinito de n valores, el número de líneas observables está limitado por nuestra capacidad para resolverlas a medida que convergen en el continuum; este número es alrededor de mil.
Espectros de emisión y absorción
Los espectros de emisión de líneas que hemos estado discutiendo se producen cuando los electrones que previamente habían sido excitados a valores de n mayores a 1 vuelven al estado fundamental n =1, ya sea directamente, o por medio de estados intermedios. Pero si la luz de una fuente continua (un cuerpo caliente como una estrella) pasa a través de una atmósfera de hidrógeno (como la atmósfera exterior de la estrella), esas longitudes de onda que corresponden a las transiciones permitidas son absorbidas, y aparecen como líneas oscuras superpuestas sobre el espectro continuo.

Estas líneas de absorción oscuras fueron observadas por primera vez por William Wollaston en su estudio del espectro solar. En 1814, Joseph von Fraunhofner (1787-1826) los redescubrió e hizo mediciones precisas de 814 líneas, incluidas las cuatro más prominentes de las líneas de Balmer.



