6.2: Modelo de Gas Ideal - Las Leyes Básicas del Gas
- Page ID
- 70721
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente, y poder expresarlas en sus propias palabras.
- Ley de Boyle - El producto fotovoltaico para cualquier gas a temperatura fija tiene un valor constante. Entender cómo esto implica una relación inversa entre la presión y el volumen.
- Ley de Carlos - El volumen de un gas confinado por una presión fija varía directamente con la temperatura absoluta. Lo mismo ocurre con la presión de un gas confinado a un volumen fijo.
- Ley de Avogadro - Esto es bastante intuitivo: el volumen de un gas confinado por una presión fija varía directamente con la cantidad de gas.
- El principio E.V.E.N.- esta es sólo otra forma de expresar la Ley de Avogadro.
- Ley de Gay-Lussac de Combinar Volúmenes - deberías poder explicar cómo este principio, que se deriva del principio E.V.E.N. y la Ley de Combinar Pesos,
- La ecuación de gas ideal de estado - esta es una de las pocas relaciones matemáticas que debes conocer. No sólo define las propiedades de la sustancia hipotética conocida como gas ideal, sino que su importancia se extiende bastante más allá del tema de los gases.
La era “neumática” de la química comenzó con el descubrimiento del vacío alrededor de 1650 que establecía claramente que los gases son una forma de materia. La facilidad con que los gases pudieron estudiarse pronto llevó al descubrimiento de numerosas leyes empíricas (descubiertas experimentalmente) que resultaron fundamentales para el desarrollo posterior de la química y condujeron indirectamente a la visión atómica de la materia. Estas leyes son tan fundamentales para todas las ciencias naturales e ingeniería que todos los que aprenden estas materias necesitan estar familiarizados con ellas.
Relaciones presión-volumen: Ley de Boyle
Robert Boyle (1627-91) demostró que el volumen de aire atrapado por un líquido en la extremidad corta cerrada de un tubo en forma de J disminuyó en proporción exacta a la presión producida por el líquido en la parte larga del tubo. El aire atrapado actuaba como un resorte, ejerciendo una fuerza opuesta a su compresión. Boyle llamó a este efecto "la primavera del aire “, y publicó sus resultados en un panfleto de ese título.
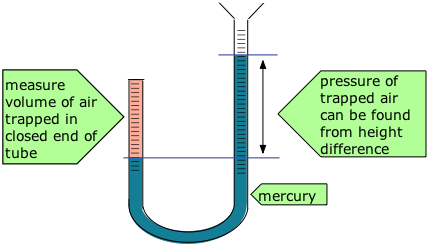
La diferencia entre las alturas de las dos columnas de mercurio da la presión (76 cm = 1 atm), y el volumen del aire se calcula a partir de la longitud de la columna de aire y el diámetro del tubo. Algunos de los datos reales de Boyle se muestran en la Tabla\(\PageIndex{1}\).
| volumen | presión | P × V |
|---|---|---|
| 96.0 | 2.00 | 192 |
| 76.0 | 2.54 | 193 |
| 46.0 | 4.20 | 193 |
| 26.0 | 7.40 | 193 |
La ley de Boyle puede expresarse como
\[PV = \text{constant} \nonumber\]
o, equivalentemente,
\[P_1V_1 = P_2V_2\]
Estas relaciones se mantienen verdaderas sólo si el número de moléculas n y la temperatura son constantes. Esta es una relación de proporcionalidad inversa; cualquier cambio en la presión es compensado exactamente por un cambio opuesto en el volumen. A medida que la presión disminuye hacia cero, el volumen aumentará sin límite. Por el contrario, a medida que aumenta la presión, el volumen disminuye, pero nunca puede llegar a cero. Habrá una gráfica P-V separada para cada temperatura; por lo tanto, una sola gráfica P-V se denomina isoterma.
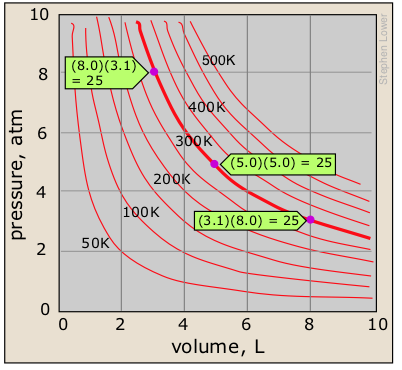
Aquí se muestran algunas isotermas para un mol de un gas ideal a varias temperaturas diferentes. Cada parcela tiene la forma de una hipérbola — el locus de todos los puntos que tiene la propiedad x y = a, donde a es una constante. Verás más adelante cómo se determina el valor de esta constante (PV =25 para la isoterma de 300K que se muestra aquí). Es muy importante que entiendas este tipo de trama que gobierna cualquier relación de proporcionalidad inversa. Debería poder esbozar una trama de este tipo cuando se le dé el valor de cualquier par (x, y).
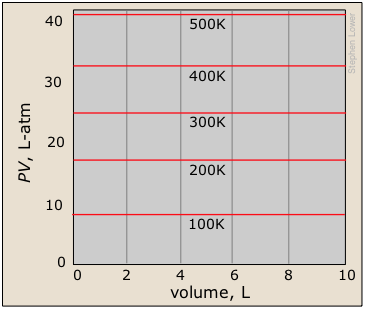
Un tipo de parcela relacionado con el que deberías estar familiarizado muestra el producto PV en función de la presión. Debes entender por qué esto produce una línea recta, y cómo este conjunto de parcelas se relaciona con la inmediatamente anterior.
En un proceso industrial, se permite que un gas confinado a un volumen de 1 L a una presión de 20 atm fluya hacia un contenedor de 12 litros abriendo la válvula que conecta los dos contenedores. ¿Cuál será la presión final del gas?
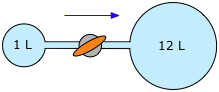
Solución
El volumen final del gas es (1 + 12) L = 13 L. El gas se expande en proporción inversa dos volúmenes
\[P_2 = (20 \,atm) (1 \,L ÷ 13 \,L) = 1.5 \,atm \nonumber\]
¡Tenga en cuenta que no hay necesidad de hacer uso explícito de ninguna “fórmula” en problemas de este tipo!
Cómo afecta la temperatura al volumen: Ley de Charles
Toda la materia se expande cuando se calienta, pero los gases son especiales ya que su grado de expansión es independiente de su composición. Los científicos franceses Jacques Charles (1746-1823) y Joseph Gay-Lussac (1778-1850) encontraron independientemente que si la presión se mantiene constante, el volumen de cualquier gas cambia en la misma cantidad fraccionaria (1/273 de su valor) por cada cambio de C° en la temperatura.
El volumen de un gas confinado contra una presión constante es directamente proporcional a la temperatura absoluta. Una expresión gráfica de la ley de Carlos y Gay-Lussac se puede apreciar en estas parcelas del volumen de un mol de un gas ideal en función de su temperatura a diversas presiones constantes.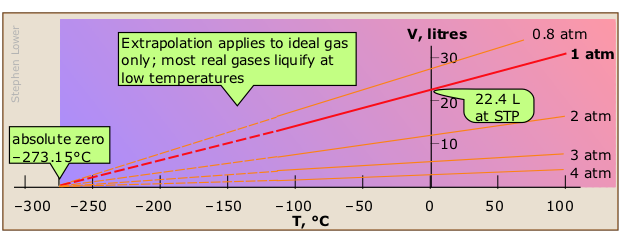
- ¿Qué muestran estas tramas?
- Las gráficas de línea recta muestran que la relación V/T (y por lo tanto dV/dT) es una constante a cualquier presión dada. Así podemos expresar la ley algebraicamente como V/T = constante o V 1 /T 1 = V 2 /T 2
- ¿Cuál es el significado de la extrapolación a volumen cero?
- Si un gas se contrae por 1/273 de su volumen por cada grado de enfriamiento, debe contraerse a volumen cero a una temperatura de —273°C, esto, por supuesto, es la temperatura del cero absoluto, y esta extrapolación de la ley de Carlos es la primera evidencia del significado especial de esta temperatura.
- ¿Por qué las parcelas para diferentes presiones tienen diferentes pendientes?
- Cuanto menor sea la presión, mayor será el volumen (ley de Boyle), por lo que a presiones bajas la fracción (V/273) tendrá un valor mayor. Se podría decir que el gas debe “contraerse más rápido” para alcanzar el volumen cero cuando su volumen inicial es mayor.
La presión del aire en una llanta de automóvil es de 30 psi (libras por pulgada cuadrada) a 10°C ¿Cuál será la presión después de que conducir haya elevado su temperatura a 45 °C? (Supongamos que el volumen permanece sin cambios.)
Solución
El gas se expande en proporción directa a la relación de las temperaturas absolutas:
\[P_2 = (30\, psi) × (318\,K ÷ 283\,K) = 33.7\, psi \nonumber\]
Notas históricas
La relación entre la temperatura de un gas y su volumen se conoce desde hace mucho tiempo. En 1702, Guillaume Amontons (1163-1705), quien es mejor conocido por sus primeros estudios de fricción, ideó un termómetro que relacionaba la temperatura con el volumen de un gas. Robert Boyle había observado esta relación inversa en 1662, pero la falta de una escala de temperatura uniforme en ese momento les impidió establecer la relación tal como la entendemos actualmente. Jacques Charles descubrió la ley que lleva su nombre en la década de 1780, pero no publicó su obra. John Dalton publicó una forma de la ley en 1801, pero la primera presentación minuciosa publicada la hizo Gay-Lussac en 1802, quien reconoció los estudios anteriores de Charles.

La flotabilidad que eleva un globo aerostático hacia el cielo depende de la diferencia entre la densidad (masa ÷ volumen) del aire atrapado dentro de la envoltura del globo, en comparación con la del aire que lo rodea. Cuando se prepara un globo en el suelo para volar, primero se infla parcialmente por un ventilador externo, y no posee flotabilidad en absoluto. Una vez que se inician los quemadores de propano, este aire comienza a expandirse de acuerdo con la ley de Charles. Después de que el aire calentado haya inflado completamente el globo, una mayor expansión simplemente fuerza el exceso de aire fuera del globo, dejando el peso de la masa disminuida de aire dentro de la envoltura más pequeño que el de la mayor masa de aire más frío que desplaza el globo.
Jacques Charles colaboró con los hermanos Montgolfier cuyo globo aerostático realizó el primer vuelo tripulado en globo del mundo en junio de 1783. Diez días después, el propio Carlos copilotó el primer globo lleno de hidrógeno. Gay-Lussac, que tenía un interés especial en la composición de la atmósfera, también vio el potencial del globo aerostático, y en 1804 ascendió a una altura entonces récord de 6.4 km.
Volumen y número de moléculas
Ley de combinación de volúmenes de Gay-Lussac
En el mismo artículo de 1808 en el que Gay-Lussac publicó sus observaciones sobre la expansión térmica de los gases, señaló que cuando dos gases reaccionan, lo hacen en proporciones de volumen que siempre pueden expresarse como pequeños números enteros. Esto llegó a conocerse como la Ley de combinar volúmenes. Estos “números enteros pequeños” son, por supuesto, los mismos que describen los “pesos de combinación” de los elementos para formar compuestos simples, como se describe en la lección que trata de las fórmulas más simples. El científico italiano Amedeo Avogadro (1776-1856) sacó la conclusión crucial: estas relaciones de volumen deben estar relacionadas con el número relativo de moléculas que reaccionan, y así el famoso “principio E.V.E.N”:
El Principio E.V.E.N
E qual v olumes de gases, medidos a la misma temperatura y presión, contienen e qual n umbers de moléculas
La ley de Avogadro predice así una relación directamente proporcional entre el número de moles de un gas y su volumen. Esta relación, originalmente conocida como Hipótesis de Avogadro, fue crucial para establecer las fórmulas de moléculas simples en una época (alrededor de 1811) en la que no se entendía claramente la distinción entre átomos y moléculas. En particular, no se reconoció la existencia de moléculas diatómicas de elementos como H 2, O 2 y Cl 2 hasta que los resultados de experimentos de volumen combinado como los que se describen a continuación pudieran interpretarse en términos del principio de E.V.E.N.
Cómo el principio E.V.E.N. condujo a la fórmula correcta del agua
Los primeros químicos cometieron el error de asumir que la fórmula del agua es HO. Esto los llevó a calcular mal el peso molecular del oxígeno como 8 (en lugar de 16). Si esto fuera cierto, la reacción H + O → HO correspondería a los siguientes resultados de combinación de volúmenes según el principio E.V.E.N:

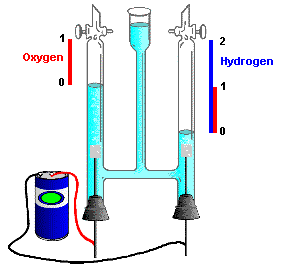
Pero un experimento similar sobre la formación de cloruro de hidrógeno a partir de hidrógeno y cloro arrojó el doble del volumen de HCl que se predijo por la supuesta reacción H + Cl → HCl. Esto podría explicarse solo si el hidrógeno y el cloro fueran moléculas diatómicas:

Esto hizo necesario volver a visitar la cuestión de la fórmula del agua. El experimento confirmó inmediatamente que la fórmula correcta del agua es H 2 O:

Esta conclusión también se consideró consistente con la observación, realizada unos años antes por los químicos ingleses Nicholson y Carlisle de que al revés de la reacción anterior, producida por la descomposición electrolítica del agua, se obtiene hidrógeno y oxígeno en una relación volumétrica 2:1.
Poniéndolo todo junto: La ecuación de gas ideal del estado
Si las variables P, V, T y n (el número de moles) tienen valores conocidos, entonces se dice que un gas está en un estado definido, lo que significa que también se definen todas las demás propiedades físicas del gas. La relación entre estas variables de estado se conoce como una ecuación de estado. Al combinar las expresiones de las leyes de Boyle, Charles y Avogadro (¡deberías poder hacer esto!) podemos escribir la muy importante ecuación de gas ideal de estado
\[PV=NRT\]
donde la constante de proporcionalidad R se conoce como la constante de gas. Esta es una de las pocas ecuaciones que debes comprometer a la memoria en este curso; también debes conocer el valor común y las unidades de\(R\).
Un gas ideal se define como una sustancia hipotética que obedece a la ecuación de estado del gas ideal.
Toma nota de la palabra “hipotético” aquí. Ningún gas real (cuyas moléculas ocupan el espacio e interactúan entre sí) puede comportarse de una manera verdaderamente ideal. Pero todos los gases nos comportaremos cada vez más como un gas ideal ya que la presión se acerca a cero. Una presión de solo 1 atm es lo suficientemente cercana a cero para que esta relación sea útil para la mayoría de los gases a esta presión.
Muchos libros de texto muestran fórmulas, como\(P_1V_1 = P_2V_2\) para la ley de Boyle. No te molestes en memorizarlas; si realmente entiendes los significados de estas leyes como se indicó anteriormente, puedes derivarlas fácilmente en las raras ocasiones en que se necesitan. La ecuación de gas ideal es la única que necesitas conocer.
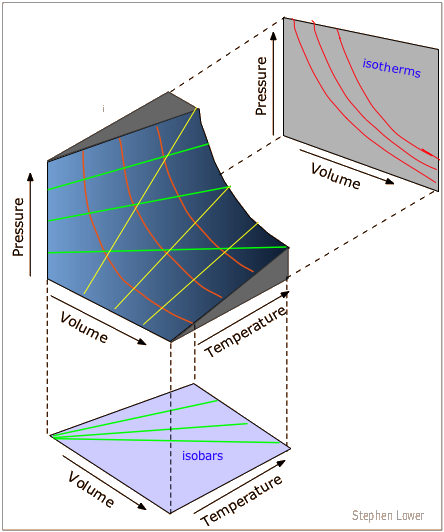
Superficie PVT para un gas ideal
Para representar las relaciones entre las tres variables P, V y T necesitamos una gráfica tridimensional.
Una galleta hecha con polvo de hornear tiene un volumen de 20 mL, de los cuales una cuarta parte consiste en espacio vacío creado por burbujas de gas producidas cuando el polvo de hornear se descompuso a CO 2. ¿Qué peso de\(\ce{NaHCO3}\) estaba presente en el polvo de hornear en la galleta? Supongamos que el gas alcanzó su volumen final durante el proceso de horneado cuando la temperatura era de 400°C.
(El polvo de hornear consiste en bicarbonato de sodio mezclado con algún otro sólido que produce una solución ácida al agregar agua, iniciando la reacción
\[\ce{NaHCO3(s) + H^{+} → Na^+ + H2O + CO2} \nonumber\]
Solución: Utilice la ecuación de gas ideal para encontrar el número de moles de gas CO 2; este será el mismo que el número de moles de NaHCO 3 (84 g mol —1) consumidos:
\[n=\frac{(1 \mathrm{atm})(0.005 \mathrm{L})}{\left(.082 \mathrm{L} \mathrm{atm} \mathrm{mol}^{-1} \mathrm{K}^{-1}\right)(673 \mathrm{K})}=9.1 \times 10^{-6} \,\mathrm{mol} \nonumber\]
\[9.1 \mathrm{E}-6 \mathrm{mol} \times 84 \mathrm{g} \mathrm{mol}^{-1}=0.0076 \mathrm{g} \nonumber\]


