6.3: Ley de Dalton
- Page ID
- 70707
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado a continuación.
- Un mol de un gas ocupa un volumen de 22.4 L a STP (temperatura y presión estándar, 273K, 1 atm = 103 kPa.)
- El hecho anterior permite relacionar la propiedad medible de la densidad de un gas con su masa molar.
- La composición de una mezcla de gases se expresa comúnmente en términos de fracciones molares; asegúrate de saber calcularlos.
- La Ley de presiones parciales de Dalton dice que cada gas en una mezcla actúa independientemente, por lo que la presión total que ejerce un gas contra las paredes de un contenedor es apenas la suma de las presiones parciales de los componentes individuales.
Aunque todos los gases siguen de cerca la ley de gas ideal PV = nRT en condiciones apropiadas, cada gas es también una sustancia química única que consiste en unidades moleculares que tienen masas definidas. En esta lección veremos cómo estas masas moleculares afectan las propiedades de los gases que se ajustan a la ley de gas ideal. Después de esto, veremos los gases que contienen más de un tipo de molécula, es decir, mezclas de gases. Comenzamos con una revisión del volumen molar y el principio E.V.E.N., que es fundamental para nuestra comprensión de las mezclas de gases.
El volumen molar de un gas
Recordará que la masa molar de una sustancia pura es la masa de 6.02 x 10 23 (número de Avogadro) de partículas o unidades moleculares de esa sustancia. Las masas molares se expresan comúnmente en unidades de gramos por mol (g mol —1) y a menudo se denominan pesos moleculares s. Como se explicó en la lección anterior, volúmenes iguales de gases, medidos a la misma temperatura y presión, contienen el mismo número de moléculas (este es el Principio “EVEN”, más formalmente conocido como ley de Avogadro. ) Temperatura y presión estándar: 273K, 1 atm
La magnitud de este volumen dependerá por supuesto de la temperatura y presión, por lo que como medio de comparación conveniente se acostumbra definir un conjunto de condiciones T = 273 K y P = 1 atm como temperatura y presión estándar, generalmente denotadas como STP. Sustituyendo estos valores en la ecuación de estado de gas ideal y resolviendo para V produce un volumen de 22.414 litros por 1 mol.
¿Cuál sería el volumen de un mol de aire a 20°C sobre Mauna Kea, Hawa'ii (altitud 4.2 km) donde la presión del aire es de aproximadamente 60 kPa?

Escoria y conos de ceniza en la cumbre de Mauna Kea en invierno. (Dominio público; USGS)
Solución
Aplicar las leyes de Boyle y Charles como sucesivos factores de corrección a la presión estándar del nivel del mar de 101.3 kPa:

El volumen molar estándar 22.4 L mol —1 es un valor que vale la pena memorizar, pero recuerde que es válido solo en STP. El volumen molar a otras temperaturas y presiones se puede encontrar fácilmente por simple proporción. El volumen molar de una sustancia puede decirnos algo sobre cuánto espacio ocupa cada molécula, como muestra el siguiente ejemplo.
Estimar la distancia promedio entre las moléculas en un gas a 1 atm de presión y 0°C.
Solución
Considere un volumen de 1-cm 3 del gas, que contendrá
\[\dfrac{6.02 \times 10^{23} \;mol^{–1}}{22,400\; cm^3 \;mol^{–1}} = 2.69 \times 10^{19} cm^{-3} \nonumber\]
El volumen por molécula (¡no es lo mismo que el volumen de una molécula, que para un gas ideal es cero!) es solo el recíproco de esto, o\(3.72 \times 10^{-20}\, cm^3\). Supongamos que las moléculas están distribuidas uniformemente para que cada una ocupe una caja imaginaria que tiene este volumen. La distancia promedio entre los centros de las moléculas se definirá por la longitud de esta caja, que es la raíz cúbica del volumen por molécula:
\[(3.72 \times 10^{–20})^{1/3} = 3.38 \times 10^{–7}\, cm = 3.4\, nm \nonumber\]
Bajo condiciones en las que es aplicable el modelo de gas ideal (es decir, casi siempre a menos que sea un ingeniero químico que se ocupe de altas presiones), “una molécula es una molécula”, por lo que el volumen del número de moléculas de Avogadro será independiente de la composición del gas. La razón, por supuesto, es que el volumen del gas es mayormente espacio vacío; los volúmenes de las propias moléculas son despreciables.
Masa Molar y Densidad de un Gas
El peso molecular (masa molar) de cualquier gas es la masa, expresada en gramos, del número de Avogadro de sus moléculas. Esto es cierto independientemente de si el gas está compuesto por una especie molecular o es una mezcla. Para una mezcla de gases, la masa molar dependerá de las masas molares de sus componentes, y de la abundancia fraccional de cada tipo de molécula en la mezcla. El término “peso molecular promedio” se usa a menudo para describir la masa molar de una mezcla de gases.
La masa molar promedio (\(\bar{m}\)) de una mezcla de gases es solo la suma de las fracciones molares de cada gas, multiplicada por la masa molar de esa sustancia:
\[\bar{m}=\sum_i \chi_im_i\]
Encontrar la masa molar promedio del aire seco cuya composición en volumen es O 2 (21%), N 2 (78%) y Ar (1%).
Solución
El peso molecular promedio es la suma ponderada por fracción molar de los pesos moleculares de sus componentes. Las fracciones molares, por supuesto, son las mismas que las fracciones de volumen (principio E.V.E.N.)
\[m = (0.21 \times 32) + (0.78 \times 28) + (0.01 \times 20) = 28 \nonumber\]
Los volúmenes molares de todos los gases son los mismos cuando se miden a la misma temperatura y presión. Sin embargo, las masas molares de diferentes gases variarán. Esto significa que diferentes gases tendrán diferentes densidades (diferentes masas por unidad de volumen). Si conocemos el peso molecular de un gas, podemos calcular su densidad.
El gas hexafluoruro de uranio UF 6 se utiliza en el enriquecimiento isotópico de uranio natural. Calcular su densidad en STP.
Solución
El peso molecular de UF 6 es 352.
\[\dfrac{352\; g \;mol^{–1}}{22.4\, L\, mol^{–1}} = 15.7\; g\; L^{–1} \nonumber\]
Nota: no es necesario buscar una “fórmula” para este cálculo; simplemente combine la masa molar y el volumen molar de tal manera que las unidades salgan correctamente.
Más importante aún, si podemos medir la densidad de un gas desconocido, tenemos un medio conveniente para estimar su peso molecular. Este es uno de los muchos ejemplos importantes de cómo una medición macroscópica (una realizada en materia a granel) puede producir información microscópica (es decir, sobre objetos a escala molecular).
Las densidades de gas ahora se miden en la industria mediante dispositivos electromecánicos, como las cañas vibratorias, que pueden proporcionar registros continuos en línea en ubicaciones específicas, como dentro de las tuberías. La determinación del peso molecular de un gas a partir de su densidad se conoce como el método Dumas, según el químico francés Jean Dumas (1800-1840) quien lo desarrolló. Uno simplemente mide el peso de un volumen conocido de gas y convierte este volumen a su equivalente STP, utilizando las leyes de Boyle y Charles. El peso del gas dividido por su volumen de STP produce la densidad del gas, y la densidad multiplicada por 22.4 mol —1 da el peso molecular. Preste mucha atención a los ejemplos de cálculos de densidad de gas que se muestran aquí y en su libro de texto. Se esperará que realice cálculos de este tipo, convirtiendo entre el peso molecular y la densidad del gas.
Calcular la masa molar aproximada de un gas cuya densidad medida es de 3.33 g/L a 30°C y 780 torr.
Solución
Encuentre el volumen que estaría ocupado por 1 L del gas en STP; tenga en cuenta que corregir a 273 K reducirá el volumen, mientras que corregir a 1 atm (760 torr) lo incrementará:
\[V=(1.00 \mathrm{L})\left(\frac{273}{303}\right)\left(\frac{780}{760}\right)=0.924 \mathrm{L} \nonumber\]
El número de moles de gas es
\[n = \dfrac{0.924\, L}{22.4\, L\, mol^{–1}}= 0.0412\, mol \nonumber\]
Por lo tanto, el peso molecular es
\[\dfrac{33\, g\, L^{–1}}{0.0412\, mol\, L^{–1}} = 80.7\, g\, mol^{–1} \nonumber\]
Densidad de una mezcla de gases
Las mediciones de densidad de gas pueden ser un medio útil para estimar la composición de una mezcla de dos gases diferentes; esto se realiza ampliamente en operaciones de química industrial en las que las composiciones de las corrientes de gas deben monitorearse continuamente.
Encontrar la composición de una mezcla de\(\ce{CO2}\) (44 g/mol) y metano\(\ce{CH4}\) (16 g/mol) que tenga una densidad de STP de 1.214 g/L.
Solución
La densidad de una mezcla de estos dos gases será directamente proporcional a su composición, variando entre la del metano puro y el CO 2 puro. Comenzamos por encontrar estas dos densidades:
Para CO 2:
(44 g/mol) ÷ (22.4 L/mol) = 1.964 g/L
Para CH 4:
(16 g/mol) ÷ (22.4 L/mol) = 0.714 g/L
Si x es la fracción molar de CO 2 y (1— x) es la fracción molar de CH 4, podemos escribir
1.964 x + 0.714 (1—x) = 1.214
(¿Tiene sentido esto? Observe que si x = 0, la densidad sería la de CH 4 puro, mientras que si fuera 1, sería la de CO 2 puro.)
Al expandir la ecuación anterior y resolver x se obtienen las fracciones molares de 0.40 para CO 2 y 0.60 para CH 4.
Expresar la composición de una mezcla de gases
Debido a que la mayor parte del volumen que ocupa un gas consiste en espacio vacío, no hay nada que impida que dos o más tipos de gases ocupen el mismo volumen. Las mezclas homogéneas de este tipo se conocen generalmente como soluciones, pero es costumbre referirse a ellas simplemente como mezclas gaseosas. Podemos especificar la composición de las mezclas gaseosas de muchas maneras diferentes, pero las más comunes son por volúmenes y por fracciones molares.
Fracciones de Volumen
De la Ley de Avogadro sabemos que “volúmenes iguales contienen igual número de moléculas”. Esto significa que los volúmenes de gases, a diferencia de los de sólidos y líquidos, son aditivos. Entonces, si un contenedor particionado tiene dos volúmenes de gas A en una sección y un mol de gas B en la otra (ambos a la misma temperatura y presión), y retiramos el tabique, el volumen permanece sin cambios.
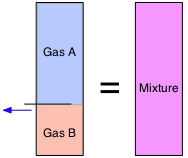
Las fracciones de volumen a menudo se denominan volúmenes parciales:
\[V_i = \dfrac{v_i}{\sum v_i}\]
¡No dejes que este tipo de notación te desplace! El signo de suma σ (Sigma griega) simplemente significa sumar las v's (volúmenes) de cada gas. Así, si el Gas A es la sustancia "i-ésima” como en la expresión inmediatamente anterior, la suma va desde i =1 hasta i =2. Tenga en cuenta que podemos emplear volúmenes parciales para especificar la composición de una mezcla aunque nunca se hubiera hecho realmente combinando los gases puros.
Cuando decimos que el aire, por ejemplo, es 21 por ciento de oxígeno y 78 por ciento de nitrógeno en volumen, esto es lo mismo que decir que estos mismos porcentajes de las moléculas en el aire consisten en O 2 y N 2. De igual manera, en 1.0 mol de aire, hay 0.21 mol de O 2 y 0.78 mol de N 2 (el otro 0.1 mol consiste en varios gases traza, pero en su mayoría es neón). Tenga en cuenta que nunca se podría asumir una equivalencia similar con mezclas de líquidos o sólidos, a lo que no se aplica el principio E.V.E.N.
Fracciones Mole
Estos dos últimos números (0.21 y 0.78) también expresan las fracciones molares de oxígeno y nitrógeno en el aire. Fracción molar significa exactamente lo que dice: la fracción de las moléculas que consisten en una sustancia específica. Esto se expresa algebraicamente por
\[X_i = \dfrac{n_i}{\sum_i n_i}\]
por lo que en el caso del oxígeno en el aire, su fracción molar es
\[ X_{O_2} = \dfrac{n_{O_2}}{n_{O_2}+n_{N_2}+n_{Ar}}= \dfrac{0.21}{1}=0.21 \nonumber\]
Una mezcla de\(O_2\) y óxido nitroso,\(N_2O\), a veces se utiliza como anestésico leve en cirugía dental. Cierta mezcla de estos gases tiene una densidad de 1.482 g L —1 a 25 y 0.980 atm. ¿Cuál era el porcentaje molar\(N_2O\) en esta mezcla?
Solución
Primero, encontrar la densidad que tendría el gas en STP:
\[\left(1.482 \mathrm{g} \mathrm{L}^{-1}\right) \times\left(\frac{298}{273}\right)\left(\frac{1}{980}\right)=1.65 \mathrm{g} \mathrm{L}^{-1}\nonumber \]
La masa molar de la mezcla es (1.65 g L —1) (22.4 L mol —1) = 37.0 g mol —1. Los pesos moleculares de\(O_2\) y\(N_2\) son 32 y 44, respectivamente. 37.0 es 5/12 de la diferencia entre las masas molares de los dos gases puros. Dado que la densidad de una mezcla de gases es directamente proporcional a su masa molar promedio, la fracción molar del gas más pesado en la mezcla también es 5/12:
\[\dfrac{37-32}{44-32}=\dfrac{5}{12}=0.42 \nonumber\]
¿Cuál es la fracción molar de dióxido de carbono en una mezcla que consiste en masas iguales de CO 2 (MW=44) y neón (MW=20.2)?
Solución
Asumir cualquier masa arbitraria, como 100 g, encontrar los números equivalentes de moles de cada gas, y luego sustituir en la definición de fracción molar:
- n CO2 = (100 g) ÷ (44 g mol —1) = 2.3 mol
- n Ne = (100 g) ÷ (20.2 g mol —1) = 4.9 mol
- X Ne = (2.3 mol) ÷ (2.3 mol + 4.9 mol) = 0.32
Ley de Dalton de Presiones Parciales
La ecuación de estado de gas ideal se aplica a las mezclas al igual que a los gases puros. De hecho fue con una mezcla de gases, aire ordinario, que Boyle, Gay-Lussac y Charles hicieron sus primeros experimentos. El único concepto nuevo que necesitamos para hacer frente a las mezclas de gases es la presión parcial, concepto inventado por el famoso químico inglés John Dalton (1766-1844). Dalton razonó que la baja densidad y alta compresibilidad de los gases indica que consisten principalmente en espacio vacío; de esto se deduce que cuando dos o más gases diferentes ocupan el mismo volumen, se comportan de manera totalmente independiente.
La contribución que hace cada componente de una mezcla gaseosa a la presión total del gas se conoce como la presión parcial de ese gas. El propio Dalton afirmó esta ley de la manera sencilla y vívida que se muestra a la izquierda.
La forma habitual de declarar la Ley de Presiones Parciales de Dalton es
La presión total de un gas es la suma de las presiones parciales de sus componentes
que se expresa algebraicamente como
\[P_{total}=P_1+P_2+P_3 ... = \sum_i P_i\]
o, equivalentemente
\[ P_{total} = \dfrac{RT}{V} \sum_i n_i\]
También existe una relación similar basada en fracciones de volumen, conocida como ley de volúmenes parciales de Amagat. Es exactamente análogo a la ley de Dalton, en el sentido de que establece que el volumen total de una mezcla es apenas la suma de los volúmenes parciales de sus componentes. Pero hay dos diferencias importantes: la ley de Amagat se sostiene solo para los gases ideales que deben estar todos a la misma temperatura y presión. La ley de Dalton no tiene ninguna de estas restricciones. Aunque la ley de Amagat parece intuitivamente obvia, a veces resulta útil en aplicaciones de ingeniería química. No vamos a hacer uso de ella en este curso.
Calcular la masa de cada componente presente en una mezcla de flúor (MW y xenón (MW 131.3) contenida en un matraz de 2.0-L. La presión parcial de Xe es 350 torr y la presión total es 724 torr a 25°C.
Solución
De la ley de Dalton, la presión parcial de F 2 es (724 — 350) = 374 torr:
Las fracciones molares son
\[\chi_{Xe} = \dfrac{350}{724} = 0.48 \nonumber\]
y
\[\chi_{F_2} = \dfrac{374}{724} = 0.52 \nonumber\]
El número total de moles de gas es
\[n=\dfrac{P V}{R T}=\frac{(724 / 60)(2)}{(.082)(298)}=0.078 \mathrm{mol}\nonumber\]
La masa de\(Xe\) es
\[(131.3\, g\, mol^{–1}) \times (0.48 \times 0.078\, mol) = 4.9\, g \nonumber\]
Tres matraces que tienen diferentes volúmenes y que contienen diferentes gases a diversas presiones están conectados por llaves de paso como se muestra. Cuando se abren las llaves de paso,
- ¿Cuál será la presión en el sistema?
- ¿Qué gas será más abundante en la mezcla?
Supongamos que la temperatura es uniforme y que el volumen de los tubos de conexión es despreciable.
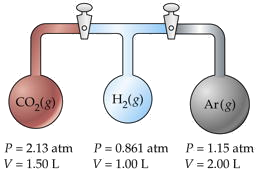
Solución
El truco aquí es señalar que el número total de moles n T y la temperatura permanecen sin cambios, por lo que podemos hacer uso de la ley de Boyle PV = constante. Trabajaremos los detalles para el CO 2 solamente, denotados por los subíndices a.
Para CO 2,
P a V a = (2.13 atm) (1.50 L) = 3.19 L-atm.
Agregando los productos fotovoltaicos para cada contenedor separado, obtenemos
\[\sum P_iV_i = 6.36 L-atm = n_T RT. \nonumber\]
A esta suma le llamaremos P 1 V 1. Después de que se hayan abierto las llaves de paso y se mezclen los gases, las nuevas condiciones se denotan con P 2 V 2.
De la ley de Boyle,
= 6.36 L-atm. V 2 = σ V i = 4.50 L.Resolviendo para la presión final P 2 que obtenemos
(6.36 L-atm)/(4.50 L) = 1.41 atm.
Para CO 2, esto funciona a (3.19/ RT)/(6.36/ RT) = 0.501. Debido a que esto supera 0.5, sabemos que este es el gas más abundante en la mezcla final.
Aplicación de la Ley de Dalton: Recolección de Gases sobre Agua
Un método común de laboratorio para recoger el producto gaseoso de una reacción química es conducirlo a un tubo invertido o botella llena de agua, cuya abertura se sumerge en un recipiente de agua más grande. Esta disposición se llama canal neumático, y fue ampliamente utilizada en los primeros días de la química. A medida que el gas entra en la botella desplaza el agua y queda atrapado en la parte superior.
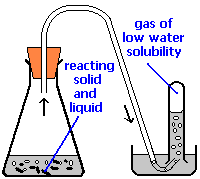
El volumen del gas se puede observar por medio de una escala calibrada en la botella, pero ¿qué pasa con su presión? La presión total que encierra el gas es justamente la de la atmósfera transmitiendo su fuerza a través del agua. (Un cálculo exacto también tendría que tomar en cuenta la altura de la columna de agua en el tubo invertido.) Pero el agua líquida en sí está siempre en equilibrio con su vapor, por lo que el espacio en la parte superior del tubo es una mezcla de dos gases: el gas que se está recogiendo, y el gaseoso H 2 O. La presión parcial de H 2 O se conoce como la presión de vapor del agua y depende de la temperatura. Para determinar la cantidad de gas que hemos recolectado, debemos usar la Ley de Dalton para encontrar la presión parcial de ese gas.
El gas oxígeno se colectó sobre el agua como se muestra arriba. La presión atmosférica fue de 754 torr, la temperatura fue de 22°C y el volumen del gas fue de 155 mL. La presión de vapor del agua a 22°C es de 19.8 torr. Utilice esta información para estimar el número de moles de los\(O_2\) producidos.
Solución
De la ley de Dalton,\(P_{O_2} = P_{total} – P_{H_2O} = 754 – 19.8 = 734 \; torr = 0.966\; atm\).
\[n=\frac{P V}{R T}=\frac{0.966 \mathrm{atm} \times(0.155 \mathrm{L})}{\left(.082 \mathrm{L} \mathrm{atm} \mathrm{mol}^{-1} \mathrm{K}^{-1}\right)(295 \mathrm{K})}=.00619 \mathrm{mol}\nonumber\]
Aplicación de la Ley de Dalton: Buceo
Nuestros sistemas respiratorios están diseñados para mantener la concentración adecuada de oxígeno en la sangre cuando la presión parcial de O 2 es de 0.21 atm, su valor normal del nivel del mar. Por debajo de la superficie del agua, la presión aumenta en 1 atm por cada 10.3 m de aumento de profundidad; así un buceador a 10.3 m experimenta un total de 2 atm de presión presionando sobre el cuerpo. Para evitar que los pulmones colapsen, el aire que respira el buzo también debe estar aproximadamente a la misma presión.
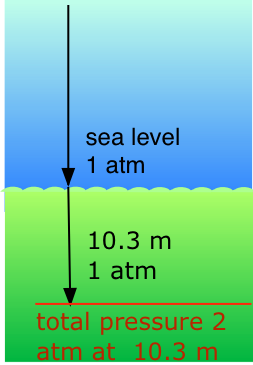
Pero a una presión total de 2 atm, la presión parcial del\(O_2\) aire ordinario sería de 0.42 atm; a una profundidad de 100 pies (unos 30 m), la\(O_2\) presión de .8 atm sería demasiado alta para la salud. Por esta razón, la mezcla de aire en los tanques presurizados que usan los buceadores debe contener una fracción menor de\(O_2\). Esto se puede lograr de la manera más simple elevando el contenido de nitrógeno, pero las altas presiones parciales de N 2 también pueden ser peligrosas, resultando en una condición conocida como narcosis de nitrógeno. El agente diluyente preferido para el buceo profundo sostenido es el helio, que tiene muy poca tendencia a disolverse en la sangre incluso a altas presiones.


