6.4: Teoría molecular cinética (visión general)
- Page ID
- 70720
Asegúrese de comprender a fondo las siguientes ideas esenciales que se presentan a continuación. Es especialmente importante que conozcas los principales supuestos de la teoría cinético-molecular. Estos se pueden dividir en aquellos que hacen referencia a la naturaleza de las moléculas mismas, y aquellos que describen la naturaleza de sus movimientos:
- Las moléculas - Volumen insignificante, ausencia de atracciones inermoleculares (piense en ellas como objetos muy duros, “no pegajosos”).
- Sus movimientos - Completamente aleatorios en dirección, solo en líneas rectas (esto es consecuencia de su falta de atracciones), velocidades medias proporcionales a la temperatura absoluta..
- La idea de que los movimientos aleatorios de moléculas individuales pueden resultar en un movimiento no aleatorio (dirigido) del gas en su conjunto es uno de los conceptos más importantes de la química, ejemplificado aquí como el principio de difusión.
- En la mayoría de los cursos se espera que conozcas y puedas usar (¡o mal uso!) Ley de Graham.
Las propiedades como temperatura, presión y volumen, junto con otras que dependen de ellas (densidad, conductividad térmica, etc.) se conocen como propiedades macroscópicas de la materia; estas son propiedades que se pueden observar en la materia a granel, sin referencia a su estructura subyacente o molecular naturaleza. A finales del siglo XIX la teoría atómica de la materia estaba suficientemente bien aceptada como para que los científicos comenzaran a relacionar estas propiedades macroscópicas con el comportamiento de las moléculas individuales, las cuales son descritas por las propiedades microscópicas de la materia. El resultado de este esfuerzo fue la teoría molecular cinética de los gases. Esta teoría se aplica estrictamente solo a una sustancia hipotética conocida como gas ideal; veremos, sin embargo, que bajo muchas condiciones describe el comportamiento de los gases reales a temperaturas y presiones ordinarias con bastante precisión, y sirve como punto de partida para tratar con más complicaciones estados de la materia.
Las ideas básicas de la teoría cinético-molecular
La “teoría cinético-molecular de los gases” puede sonar bastante imponente, pero se basa en una serie de suposiciones de fácil comprensión que, en conjunto, constituyen un modelo que simplifica enormemente nuestra comprensión del estado gaseoso de la materia. Los cinco principios básicos de la teoría cinético-molecular son los siguientes:
- Un gas está compuesto por moléculas que están separadas por distancias promedio que son mucho mayores que los tamaños de las propias moléculas. El volumen ocupado por las moléculas del gas es insignificante en comparación con el volumen del gas mismo.
- Las moléculas de un gas ideal no ejercen fuerzas atractivas entre sí, ni sobre las paredes del contenedor.
- Las moléculas están en constante movimiento aleatorio, y como cuerpos materiales, obedecen las leyes del movimiento de Newton. Esto significa que las moléculas se mueven en líneas rectas (ver ilustración demo a la izquierda) hasta que chocan entre sí o con las paredes del contenedor.
- Las colisiones son perfectamente elásticas; cuando dos moléculas chocan, cambian sus direcciones y energías cinéticas, pero la energía cinética total se conserva. Las colisiones no son “pegajosas”.
- La energía cinética promedio de las moléculas de gas es directamente proporcional a la temperatura absoluta. Observe que el término “promedio” es muy importante aquí; las velocidades y energías cinéticas de las moléculas individuales abarcarán una amplia gama de valores, y algunas incluso tendrán velocidad cero en un instante dado. Esto implica que todo movimiento molecular cesaría si la temperatura se redujera a cero absoluto.
Según este modelo, la mayor parte del volumen que ocupa un gas es el espacio vacío; esta es la característica principal que distingue a los gases de los estados condensados de la materia (líquidos y sólidos) en los que las moléculas vecinas están constantemente en contacto. Las moléculas de gas están en movimiento rápido y continuo; a temperaturas y presiones ordinarias sus velocidades son del orden de 0.1-1 km/seg y cada molécula experimenta aproximadamente 10 10 colisiones con otras moléculas cada segundo.
Explicación de las Leyes del Gas
Si los gases de hecho consisten en partículas ampliamente separadas, entonces las propiedades observables de los gases deben ser explicables en términos de la mecánica simple que gobierna los movimientos de las moléculas individuales. La teoría molecular cinética facilita ver por qué un gas debe ejercer presión sobre las paredes de un contenedor. Cualquier superficie en contacto con el gas es constantemente bombardeada por las moléculas.
En cada colisión, una molécula que se mueve con momentum mv golpea la superficie. Dado que las colisiones son elásticas, la molécula rebota con la misma velocidad en la dirección opuesta. Este cambio en la velocidad Δ V es equivalente a una n acelerati o n a; de acuerdo con la segunda ley de Newton, se ejerce así una fuerza f = ma sobre la superficie del área A ejerciendo una presión P = F/A.
Interpretación cinética de la temperatura
Según la teoría molecular cinética, la energía cinética promedio de un gas ideal es directamente proporcional a la temperatura absoluta. La energía cinética es la energía que tiene un cuerpo en virtud de su movimiento:
\[ K.E. = \dfrac{mv^2}{2}\]
A medida que sube la temperatura de un gas, la velocidad promedio de las moléculas aumentará; una duplicación de la temperatura incrementará esta velocidad en un factor de cuatro. Las colisiones con las paredes del contenedor transferirán más impulso, y por lo tanto más energía cinética, a las paredes. Si las paredes están más frías que el gas, se calentarán, devolviendo menos energía cinética al gas, y haciendo que se enfríe hasta alcanzar el equilibrio térmico. Debido a que la temperatura depende de la energía cinética promedio, el concepto de temperatura solo se aplica a una muestra estadísticamente significativa de moléculas. Tendremos más que decir sobre las velocidades moleculares y las energías cinéticas más adelante.
- Explicación cinética de la ley de Boyle: La ley de Boyle se explica fácilmente por la teoría molecular cinética. La presión de un gas depende del número de veces por segundo que las moléculas golpeen la superficie del contenedor. Si comprimimos el gas a un volumen menor, el mismo número de moléculas están actuando ahora contra una superficie menor, por lo que el número de golpes por unidad de área, y por lo tanto la presión, ahora es mayor.
- Explicación cinética de la ley de Charles: La teoría molecular cinética establece que un aumento en la temperatura eleva la energía cinética promedio de las moléculas. Si las moléculas se mueven más rápidamente pero la presión sigue siendo la misma, entonces las moléculas deben permanecer más separadas, de manera que el aumento en la velocidad a la que las moléculas chocan con la superficie del contenedor se compensa con un aumento correspondiente en el área de esta superficie a medida que el gas se expande.
- Explicación cinética de la ley de Avogadro: Si aumentamos el número de moléculas de gas en un contenedor cerrado, más de ellas colisionarán con las paredes por unidad de tiempo. Para que la presión se mantenga constante, el volumen debe aumentar en proporción, de manera que las moléculas golpeen las paredes con menor frecuencia, y sobre una mayor superficie.
- Explicación cinética de la ley de Dalton: “Cada gas es un vacío para cada otro gas”. Esta es la forma en que Dalton declaró lo que ahora conocemos como su ley de presiones parciales. Simplemente significa que cada gas presente en una mezcla de gases actúa independientemente de los demás. Esto tiene sentido debido a uno de los principios fundamentales de la teoría del KMT de que las moléculas de gas tienen volúmenes insignificantes. Entonces el Gas A en mezcla de A y B actúa como si el Gas B no estuviera ahí en absoluto. Cada uno aporta su propia presión a la presión total dentro del contenedor, en proporción a la fracción de las moléculas que representa.
Algunas aplicaciones prácticas importantes de KMT
Las moléculas de un gas se encuentran en un estado de movimiento perpetuo en el que la velocidad (es decir, la velocidad y dirección) de cada molécula es completamente aleatoria e independiente de la de las otras moléculas. Esta suposición fundamental del modelo cinético-molecular nos ayuda a comprender una amplia gama de fenómenos comúnmente observados.
Difusión: movimiento aleatorio con dirección
La difusión se refiere al transporte de la materia a través de un gradiente de concentración; la regla es que las sustancias se mueven (o tienden a moverse) de regiones de mayor concentración a las de menor concentración. La difusión del té de una bolsita de té al agua, o del perfume de una persona, son ejemplos comunes; ¡no esperaríamos ver que ninguno de los dos procesos sucediera a la inversa!
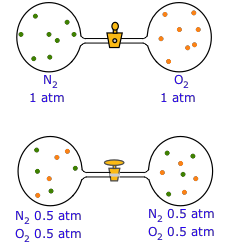
Cuando se abre la llave de paso, los movimientos aleatorios hacen que cada gas se difunda hacia el otro contenedor. Una vez completada la difusión (fondo), las moléculas individuales de ambos tipos continúan pasando entre los matraces en ambas direcciones.
Al principio podría parecer extraño que los movimientos aleatorios de las moléculas puedan conducir a una deriva completamente predecible en su distribución final. La clave de esta aparente paradoja es la distinción entre un individuo y la población. Si bien no podemos decir nada sobre el destino de una molécula individual, el comportamiento de una gran colección (“población”) de moléculas está sujeto a las leyes de la estadística. Esto es exactamente análogo a la manera en que las tablas actuariales de seguros pueden predecir con precisión la longevidad promedio de las personas a una edad determinada, pero no proporcionan información sobre el destino de una sola persona.
Derrame y la ley de Graham
Si se hace un pequeño agujero en la pared de un recipiente que contiene un gas, entonces la velocidad a la que las moléculas de gas se escapan del contenedor será proporcional al número de moléculas que chocan con la unidad de área de la pared por segundo, y así con el rms - velocidad promedio de las moléculas de gas. Este proceso, cuando se lleva a cabo en condiciones idealizadas, se conoce como derrame.
Alrededor de 1830, el químico inglés Thomas Graham (1805-1869) descubrió que las velocidades relativas a las que dos gases diferentes, a la misma temperatura y presión, emanarán a través de aberturas idénticas es inversamente proporcional a la raíz cuadrada de su masa molar.
\[v \propto \dfrac{1}{\sqrt{M}}\]
La ley de Graham, como se conoce a esta relación, es una consecuencia simple de la relación de raíz cuadrada entre la velocidad de un cuerpo y su energía cinética.
Según la teoría molecular cinética, las moléculas de dos gases a la misma temperatura poseerán la misma energía cinética promedio. Si v 1 y v 2 son las velocidades promedio de los dos tipos de moléculas, entonces a cualquier temperatura dada KE 1 = KE 2 y
\[\dfrac{m_1v_1^2}{2} = \dfrac{m_2v_2^2}{2}\]
o, en términos de masas molares\(M\),
\[ \color{red} { \dfrac{v_1}{v_2} = \sqrt{\dfrac{M_2}{M_1}}}\]
Así, la velocidad promedio de las moléculas más ligeras debe ser mayor que la de las moléculas más pesadas, y la relación de estas velocidades vendrá dada por la relación inversa de raíces cuadradas de los pesos moleculares. Aunque la ley de Graham se aplica exactamente solo cuando un gas se difunde en un vacío, la ley da estimaciones útiles de las tasas de difusión relativas en condiciones más prácticas, y proporciona una visión de una amplia gama de fenómenos que dependen de las velocidades medias relativas de moléculas de diferentes masas.
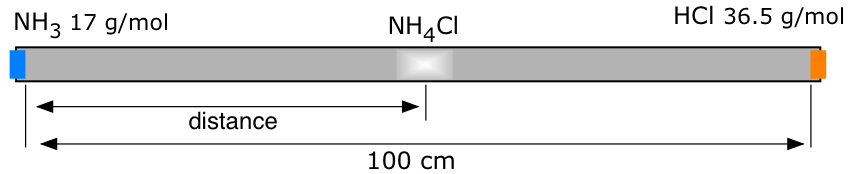
El tubo de vidrio que se muestra arriba tiene tapones de algodón insertados en cada extremo. El tapón de la izquierda se humedece con unas gotas de amoníaco acuoso, del cual se escapa lentamente el\(NH_3\) gas. El tapón de la derecha se humedece de manera similar con una solución fuerte de ácido clorhídrico, de la que se\(HCl\) escapa el gas. Los gases se difunden en direcciones opuestas dentro del tubo; en el punto donde se encuentran, se combinan para formar cloruro de amonio sólido, que aparece primero como una niebla blanca y luego comienza a recubrir el interior del tubo.
La reacción es
\[NH_{3(g)} + HCl_{(g)} \rightarrow NH_4Cl_{(s)}\]
- ¿En qué parte del tubo (izquierda, derecha, centro) se observará primero el NH 4 Cl?
- Si la distancia entre los dos extremos del tubo es de 100 cm, ¿a cuántos cm del extremo izquierdo del tubo se formará primero el NH 4 Cl?
Solución
a) Las moléculas de amoníaco más ligeras se difundirán más rápidamente, por lo que el punto donde se encuentran los dos gases será en algún lugar de la mitad derecha del tubo.
b) La relación de las velocidades de difusión de amoníaco (v 1) y cloruro de hidrógeno (v 2) puede estimarse a partir de la ley de Graham:
\[ \dfrac{v_1}{v_2} = \sqrt{\dfrac{36.5}{17}} = 1.46\]
Por lo tanto, podemos asignar velocidades relativas de los dos gases como\(v_1 = 1.46\) y\(v_2 = 1\). Claramente, el punto de encuentro será directamente proporcional al v 1. Será, de hecho, proporcional a la relación v 1/(v 1 + v 2) *:
\[ \dfrac{v_1}{v_1+v_2} \times 100\; cm = \dfrac{1.46}{1.46 + 1.00} \times 100\, cm = 59 \;cm \]
*Para ver cómo se dedujo esta relación, considere lo que sucedería en los tres casos especiales en los que v 1 =0, v 2 =0, y v 1 = v 2, para los cuales las distancias (desde el extremo izquierdo) serían 0, 50, y 100 cm, respectivamente. Debe quedar claro que la relación más simple v 1/v 2 conduciría a resultados absurdos.
Tenga en cuenta que el cálculo anterior es sólo una estimación. La ley de Graham es estrictamente válida sólo bajo condiciones especiales, siendo la más importante que no hay otros gases presentes. Contrario a lo que está escrito en algunos libros de texto y a menudo se enseña, la ley de Graham no predice con precisión las tasas relativas de escape de los diferentes componentes de una mezcla gaseosa al aire exterior, ni da las velocidades a las que dos gases se difundirán a través de otro gas como el aire. Ver Uso indebido de las leyes de Graham por Stephen J. Hawkes, J. Chem. Educación 1993 70 (10) 836-837
Enriquecimiento de uranio
Una aplicación de este principio que originalmente fue sugerida por el propio Graham pero que no se realizó de manera práctica hasta un siglo después es la separación de isótopos. El ejemplo más importante es el enriquecimiento de uranio en la producción de combustible de fisión nuclear.

La Planta de Difusión Gaseosa K-25 fue una de las principales fuentes de uranio enriquecido durante la Segunda Guerra Mundial. Se terminó en 1945 y empleó a 12 mil trabajadores. Debido al secreto del Proyecto Manhattan, las mujeres que operaban el sistema desconocían el propósito de la planta; fueron capacitadas para simplemente vigilar los medidores y girar las esferas para lo que se les dijo que era un “proyecto de gobierno”.
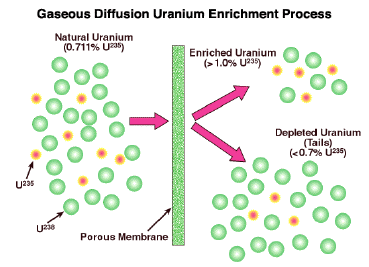
El uranio consiste principalmente en U 238, con sólo 0.7% del isótopo fisionable U 235. El uranio es por supuesto un metal, pero reacciona con flúor para formar un hexafluoruro gaseoso, UF 6. En el exitoso proceso de difusión gaseosa el UF 6 se difunde repetidamente a través de una pared porosa. Cada vez, el isótopo más ligero pasa un poco más rápido que el más pesado, produciendo una mezcla que es minuciosamente más rica en U 235. El proceso debe ser más de mil veces para lograr el grado de enriquecimiento deseado. El desarrollo de una planta de difusión a gran escala fue una parte clave del desarrollo estadounidense de la primera bomba atómica en 1945. Este proceso ya está obsoleto, habiendo sido sustituido por otros métodos.
Fluctuaciones de densidad: ¿Por qué el cielo es azul?
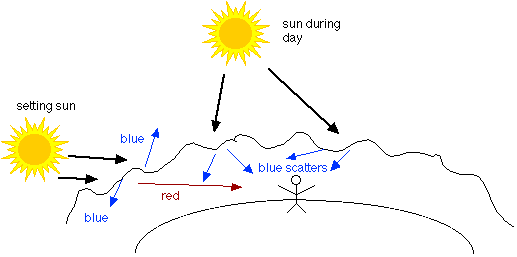
La difusión asegura que las moléculas se distribuirán rápidamente por todo el volumen ocupado por el gas de una manera completamente uniforme. Las posibilidades son prácticamente nulas de que suficientes moléculas se encuentren momentáneamente cerca de un lado de un recipiente que del otro para dar como resultado una densidad temporal observable o diferencia de presión. Esto es resultado de estadísticas simples. Pero las predicciones estadísticas sólo son válidas cuando la población muestral es grande.

Considera qué pasaría si consideramos volúmenes de espacio extremadamente pequeños: cubos que miden aproximadamente 10 —7 cm a cada lado, por ejemplo. Tal célula contendría sólo unas pocas moléculas, y en cualquier instante esperaríamos encontrar algunas conteniendo más o menos que otras, aunque con el tiempo promediarían al mismo valor. El efecto de este comportamiento estadístico es dar lugar a fluctuaciones aleatorias en la densidad de un gas a lo largo de distancias comparables a las dimensiones de las ondas de luz visible. Cuando la luz pasa a través de un medio cuya densidad no es uniforme, parte de la luz se dispersa. El tipo de dispersión debido a fluctuaciones de densidad aleatorias se llama dispersión de Rayleigh, y tiene la propiedad de afectar (dispersión) longitudes de onda más cortas de manera más efectiva que las longitudes de onda más largas. El cielo claro aparece de color azul porque el componente azul (longitud de onda más corta) de la luz solar se dispersa más. Las longitudes de onda más largas permanecen en el camino de la luz del sol, disponibles para deleitarnos al amanecer o al atardecer.
[fuente]
Lo que hemos estado discutiendo es una forma de lo que se conoce como fenómenos de fluctuación. Como muestra la animación, las fluctuaciones aleatorias en la presión de un gas a ambos lados no siempre se cancelan por completo cuando la densidad de las moléculas (es decir, las presiones) son bastante pequeñas.

Bombillas incandescentes
Una aplicación interesante que involucra varios aspectos del comportamiento molecular cinético de los gases es el uso de un gas, generalmente argón, para extender la vida útil de las bombillas incandescentes. A medida que se utiliza una bombilla, los átomos de tungsteno se evaporan del filamento y se condensan en la pared interna más fría de la bombilla, ennegreciéndola y reduciendo la salida de luz. A medida que el filamento se vuelve más delgado en ciertos puntos, el aumento de la resistencia eléctrica da como resultado una mayor disipación de potencia local, una evaporación más rápida y, finalmente, el filamento se rompe.
La presión dentro de una bombilla de lámpara debe ser suficientemente baja para que la trayectoria libre media de las moléculas de gas sea bastante larga; de lo contrario, el calor se conduciría desde el filamento con demasiada rapidez, y la bombilla se derretiría. (La conducción térmica depende de colisiones intermoleculares, y una trayectoria libre media más larga significa una frecuencia de colisión más baja). Un vacío completo minimizaría la conducción de calor, pero esto resultaría en una trayectoria libre media tan larga que los átomos de tungsteno migrarían rápidamente a las paredes, resultando en una vida del filamento muy corta y un extenso ennegrecimiento de la bombilla.
Alrededor de 1910, la General Electric Company contrató a Irving Langmuir como uno de los primeros químicos en ser empleado como científico industrial en América del Norte. Langmuir vio rápidamente que el ennegrecimiento del bulbo era una consecuencia del largo camino libre medio de los átomos de tungsteno vaporizados, y demostró que la adición de una pequeña cantidad de argón reducirá el camino libre medio, aumentando la probabilidad de que un átomo de tungsteno que se mueve hacia afuera colisione con un átomo de argón. Una cierta proporción de estos finalmente encontrarán su camino de regreso al filamento, reconstituyéndolo parcialmente.
El kriptón sería una mejor opción de gas que el argón, ya que su mayor masa sería más efectiva para cambiar la dirección del átomo de tungsteno bastante pesado. Desafortunadamente, el kriptón, al ser un gas más raro, es alrededor de 50 veces más caro que el argón, por lo que solo se usa en bombillas “premium”. La lámpara de ciclo de halógenos más recientemente desarrollada es un método interesante basado en la química para prolongar la vida útil de una lámpara de filamento de tungsteno.
Viscosidad de los gases
Los gases, como todos los fluidos, exhiben una resistencia al flujo, una propiedad conocida como viscosidad. La causa básica de la viscosidad es la naturaleza aleatoria del movimiento molecular inducido térmicamente. Para forzar un fluido a través de una tubería o tubo, se debe superponer un movimiento traslacional no aleatorio adicional sobre el movimiento térmico.
Sin embargo, hay un ligero problema. Las moléculas que fluyen cerca del centro de la tubería chocan principalmente con moléculas que se mueven en la misma dirección aproximadamente a la misma velocidad, pero aquellas que se encuentren cerca de la pared experimentarán frecuentes colisiones con la pared. Dado que las moléculas en la pared de la tubería no se mueven en la dirección del flujo, tenderán a absorber más energía cinética de la que regresan, con el resultado de que las moléculas de gas más cercanas a la pared de la tubería pierden parte de su impulso hacia adelante. Su movimiento térmico aleatorio eventualmente los llevará más profundamente a la corriente, donde chocarán con otras moléculas que fluyen y las ralentizarán. Esto da lugar a una resistencia al flujo conocida como viscosidad; esta es la razón por la cual los gasoductos largos de transmisión necesitan tener estaciones de bombeo cada 100 km más o menos.
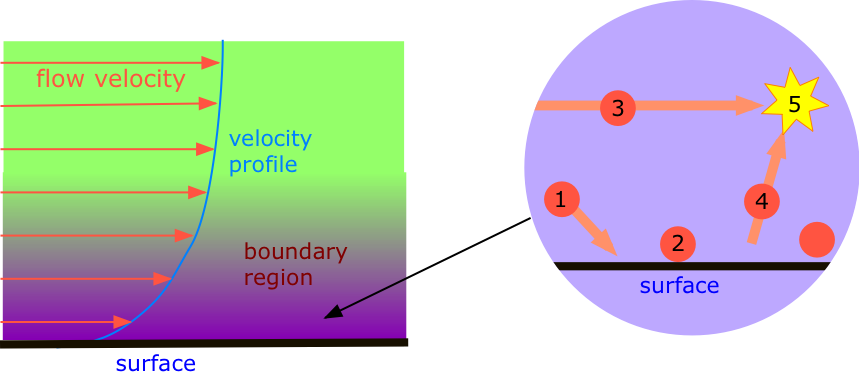
Como saben, los líquidos como el jarabe o la miel exhiben viscosidades más pequeñas a temperaturas más altas ya que el aumento de la energía térmica reduce la influencia de las atracciones intermoleculares, permitiendo así que las moléculas se deslicen entre sí más fácilmente. Los gases, sin embargo, se comportan de la manera opuesta; la viscosidad del gas surge de la transferencia de impulso inducida por colisión de moléculas que se mueven rápidamente a las más lentas que han sido liberadas de la capa límite. Cuanto mayor sea la temperatura, más rápidamente se mueven las moléculas y chocan entre sí, por lo que mayor es la viscosidad.
Distribución de moléculas de gas en un campo gravitacional
Todo el mundo sabe que la presión del aire disminuye con la altitud. Este efecto se entiende fácilmente cualitativamente a través de la teoría molecular cinética. El movimiento térmico aleatorio tiende a mover las moléculas de gas en todas las direcciones por igual. En presencia de un campo gravitacional, sin embargo, los movimientos en dirección descendente se ven ligeramente favorecidos. Esto hace que la concentración, y por lo tanto la presión de un gas sea mayor en elevaciones más bajas y disminuya sin límite a elevaciones más altas.
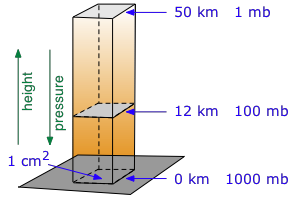
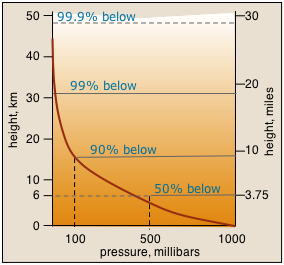
La presión a cualquier elevación en una columna vertical de un fluido se debe al peso del fluido por encima de él. Esto hace que la presión disminuya exponencialmente con la altura.
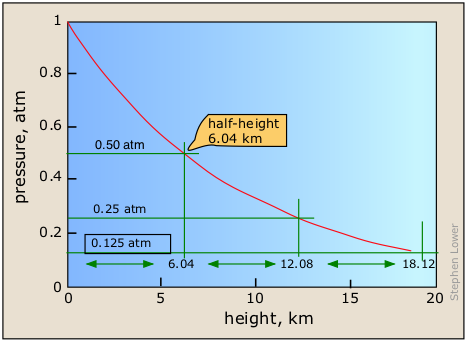
La relación funcional exacta entre presión y altitud se conoce como la ley de distribución barométrica. Se deriva fácilmente usando cálculo de primer año. Para el aire a 25°C la presión P h a cualquier altitud viene dada por
\[P_h = P_o e^{–.011h}\]
en la que\(P_o\) se encuentra la presión al nivel del mar.
Esta es una forma de la ley de decaimiento exponencial muy común que encontraremos en varios contextos diferentes en este curso. Una ley de decaimiento (o crecimiento) exponencial describe cualquier cantidad cuya tasa de cambio sea directamente proporcional a su valor actual, como la cantidad de dinero en una cuenta de ahorro de intereses compuestos o la densidad de una columna de gas a cualquier altitud. La característica más importante de cualquier cantidad descrita por esta ley es que la tasa fraccionaria de cambio de la cantidad en cuestión (en este caso, Δ P /P o en cálculo, dP/p) es una constante. Esto quiere decir que el incremento de altitud requerido para reducir la presión a la mitad es también una constante, de unos 6 km en el caso de la Tierra.
Debido a que las moléculas más pesadas se verán más fuertemente afectadas por la gravedad, sus concentraciones caerán más rápidamente con la elevación. Por esta razón las presiones parciales de los diversos componentes de la atmósfera tenderán a variar con la altitud. La diferencia de presión también se ve afectada por la temperatura; a temperaturas más altas hay más movimiento térmico, y de ahí una caída de presión menos rápida con la altitud. Debido a la convección atmosférica y la turbulencia, estos efectos no se observan en la parte inferior de la atmósfera, pero en las partes más altas de la atmósfera las moléculas más pesadas tienden a derivar hacia abajo.
La ionosfera y la radiocomunicación
A presiones muy bajas, las trayectorias libres medias son suficientemente grandes como para que las colisiones entre moléculas se vuelvan bastante infrecuentes. Bajo estas condiciones, especies altamente reactivas como iones, átomos y fragmentos moleculares que normalmente serían destruidos en cada colisión, pueden persistir por periodos de tiempo apreciables.
El ejemplo más importante de esto ocurre en la cima de la atmósfera terrestre, a una altitud de 200 km, a una presión de aproximadamente 10 —7 atm. Aquí el camino libre medio será 10 7 veces su valor a 1 atm, o aproximadamente 1 m. En esta parte de la atmósfera, conocida como la termosfera, la química está dominada por especies como O, O 2 + y HO que se forman por la acción de ultravioleta solar intenso luz sobre los gases atmosféricos normales cerca de la parte superior de la estratosfera. Las altas concentraciones de especies cargadas eléctricamente en estas regiones (a veces también llamadas ionosfera) reflejan ondas de radio y son responsables de la transmisión alrededor del mundo de señales de radio de frecuencia media.
La densidad iónica en la parte inferior de la ionosfera (unos 80 km de altitud) es tan grande que la radiación de las estaciones de radio de banda de transmisión es absorbida en esta región antes de que estas ondas puedan alcanzar las capas reflectantes de gran altitud. Sin embargo, la presión en esta región (conocida como la capa D) es lo suficientemente grande como para que los iones se recombinen poco después del atardecer local, haciendo que la capa D desaparezca y permitiendo que las ondas se reflejen en la parte superior (capa F) de la ionosfera. Esta es la razón por la que las emisoras distantes solo se pueden escuchar de noche.


