6.6: Gases reales y fenómenos críticos
- Page ID
- 70713
Asegúrese de comprender a fondo los siguientes conceptos esenciales que se han presentado anteriormente.
- Los gases reales están sujetos a los efectos del volumen molecular (fuerza repulsiva intermolecular) y las fuerzas de atracción intermoleculares.
- El comportamiento de un gas real se aproxima al de un gas ideal a medida que la presión se aproxima a cero.
- Los efectos del comportamiento no ideal se ven mejor cuando el producto PV se representa gráficamente en función de P. Deberían ser capaces de identificar las regiones de tal trama en las que dominan fuerzas atractivas y repulsivas.
- Cada gas real tiene su propia ecuación de estado única. Se han ideado diversas ecuaciones generales de estado en las que se utilizan constantes ajustables para aproximar el comportamiento de un gas en particular.
- La ecuación de estado más conocida es la de van der Waals. Aunque no es necesario memorizar esta ecuación, deberías poder explicar la significación de sus términos.
Las “leyes de gas ideales” tal como las conocemos hacen un trabajo notablemente bueno al describir el comportamiento de un gran número de sustancias químicamente diversas ya que existen en estado gaseoso bajo condiciones ambientales ordinarias, aproximadamente alrededor de 1 atm de presión y una temperatura de 300 K. Pero cuando la temperatura se reduce, o la se eleva la presión, la relación PV = constante que define el gas ideal comienza a descomponerse, y sus propiedades se vuelven impredecibles; eventualmente el gas se condensa en un líquido. ¿Por qué es importante esto? Es de evidente interés para un ingeniero químico que necesita predecir las propiedades de los gases involucrados en una reacción química realizada a varios cientos de atmósferas de presión. Esto es especialmente así cuando consideramos que algunos de los principios básicos del modelo de gas ideal tienen que ser abandonados para explicar propiedades tales como
- la distancia promedio entre colisiones (¡las moléculas realmente ocupan espacio!)
- a presiones suficientemente altas y bajas temperaturas, las atracciones intermoleculares asumen el control y el gas se condensa en un líquido;
- la viscosidad de un gas que fluye a través de una tubería (las moléculas se “atascan” temporalmente en la superficie de la tubería y, por lo tanto, se ven afectadas por fuerzas de atracción intermoleculares).
Aun así, muchas de las leyes comunes como la de Boyle y la de Charles continúan describiendo bastante bien estos gases incluso en condiciones donde estos fenómenos son evidentes. Bajo condiciones ambientales ordinarias (presiones moderadas y superiores a 0°C), las isotermas de sustancias que normalmente pensamos como gases no parecen diferir mucho de la forma hiperbólica
\[\dfrac{PV}{RT} = \text{constant} \label{6.6.1}\]
Sin embargo, a lo largo de una gama más amplia de condiciones, las cosas comienzan a complicarse más. Así, el isopentano (Figura\(\PageIndex{1}\)) se comporta de manera razonablemente ideal por encima de 210 K, pero por debajo de esta temperatura las isotermas se distorsionan algo, y a 185 K y por debajo dejan de ser continuas, mostrando segmentos horizontales peculiares en los que reducir el volumen no cambia la presión.
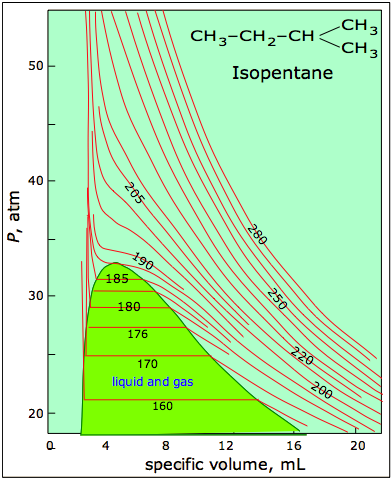
Dentro de esta región, cualquier intento de comprimir el gas simplemente “aprieta” parte del mismo al estado líquido cuya mayor densidad compensa exactamente el menor volumen, manteniendo así la presión en un valor constante. Resulta que los gases reales eventualmente comienzan a seguir sus propias ecuaciones únicas de estado, y en última instancia incluso dejan de ser gases. En esta unidad veremos por qué ocurre esto, cuáles son las consecuencias y cómo podríamos modificar la ecuación de estado de gas ideal para extender su utilidad sobre un mayor rango de temperaturas y presiones.
Efectos de las Fuerzas Intermoleculares
Según la ley de Boyle, el producto PV es una constante a cualquier temperatura dada, por lo que una gráfica de PV en función de la presión de un gas ideal produce una línea recta horizontal. Esto implica que cualquier aumento en la presión del gas se contrarresta exactamente con una disminución en el volumen a medida que las moléculas se apiñan más juntas. Pero sabemos que las propias moléculas son objetos finitos que tienen volúmenes propios, y esto debe colocar un límite inferior en el volumen en el que pueden ser exprimidas. Entonces debemos reformular la ecuación de estado de gas ideal como una relación que es cierta solo en el caso limitante de presión cero:
\[\lim_{P \rightarrow 0} PV=nRT \label{6.6.2}\]
Entonces, ¿qué sucede cuando un gas real es sometido a una presión muy alta? El desenlace varía tanto con la masa molar del gas como con su temperatura, pero en general podemos ver los efectos de las fuerzas intermoleculares tanto repulsivas como atractivas:
- Fuerzas repulsivas: A medida que se comprime un gas, las moléculas individuales comienzan a interponerse entre sí, dando lugar a una fuerza repulsiva muy fuerte que actúa para oponerse a cualquier disminución de volumen adicional. Por lo tanto, esperaríamos que la línea PV vs P se curve hacia arriba a altas presiones, y esto es de hecho lo que se observa para todos los gases a presiones suficientemente altas.
- Fuerzas atractivas: A distancias muy cercanas, todas las moléculas se repelen entre sí al entrar en contacto sus nubes de electrones. A mayores distancias, sin embargo, breves fluctuaciones estadísticas en la distribución de estas nubes de electrones dan lugar a una fuerza de atracción universal entre todas las moléculas. Cuantos más electrones haya en la molécula (y así cuanto mayor sea el peso molecular), mayor es esta fuerza atractiva. Mientras la energía del movimiento térmico domine esta fuerza atractiva, la sustancia permanece en estado gaseoso, pero a temperaturas suficientemente bajas dominan las atracciones y la sustancia se condensa en un líquido o sólido.
La fuerza de atracción universal descrita anteriormente se conoce como la dispersión, o fuerza londinense. También puede haber fuerzas atractivas adicionales (y generalmente más fuertes) relacionadas con el desequilibrio de carga en la molécula o con los enlaces de hidrógeno. Estas diversas fuerzas atractivas a menudo se denominan colectivamente fuerzas de van der Waals. Una gráfica de PV/RT en función de la presión es un indicador muy sensible de desviaciones del comportamiento ideal, ya que dicha gráfica es solo una línea horizontal para un gas ideal. Cifras\(\PageIndex{2}\) y\(\PageIndex{3}\) demuestran cómo estas gráficas varían con la naturaleza del gas y con la temperatura, respectivamente.
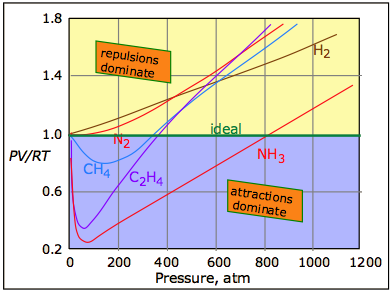
Las atracciones intermoleculares, que generalmente aumentan con el peso molecular, hacen que el producto PV disminuya a medida que presiones más altas acercan las moléculas y, por lo tanto, dentro del rango de estas fuerzas de atracción; el efecto es hacer que el volumen disminuya más rápidamente que de lo contrario lo haría. Las fuerzas repulsivas siempre ganan con el tiempo. Sin embargo, a medida que las moléculas comienzan a entrometerse en el territorio de las demás, las fuerzas repulsivas más fuertes hacen que la curva se doble hacia arriba.
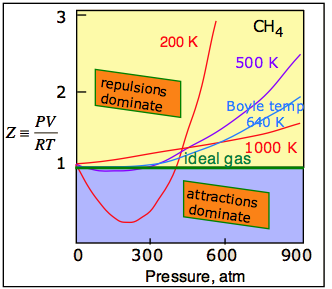
¡La temperatura hace una gran diferencia! A temperaturas más altas, los movimientos térmicos incrementados superan los efectos de las atracciones intermoleculares que normalmente dominan a presiones más bajas (Figura\(\PageIndex{3}\)). Así que todos los gases se comportan más idealmente a temperaturas más altas. Para cualquier gas, hay una temperatura especial (la temperatura de Boyle) a la que fuerzas atractivas y repulsivas se equilibran exactamente entre sí a presión cero. Como se puede ver en esta parcela para metano, parte de este saldo sí se mantiene a medida que aumenta la presión.
La ecuación de estado de van der Waals
¿Cómo podríamos modificar la ecuación de estado de gas ideal para tener en cuenta los efectos de las interacciones intermoleculares? La primera y más conocida respuesta a esta pregunta la ofreció el científico holandés J.D. van der Waals (1837-1923) en 1873. El modelo de gas ideal supone que las moléculas de gas son meramente puntos que no ocupan volumen; el término "V" en la ecuación es el volumen del contenedor y es independiente de la naturaleza del gas.
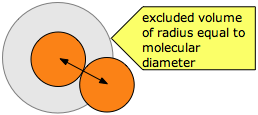
van der Waals reconoció que las propias moléculas ocupan espacio que resta del volumen del contenedor (Figura\(\PageIndex{4}\)), por lo que el “volumen del gas” V en la ecuación ideal del gas debe ser sustituido por el término (\(V–b\)), en el que\(b\) se relaciona con los excluidos volumen, típicamente del orden de 20-100 cm 3 mol —1. El volumen excluido que rodea cualquier molécula define el enfoque más cercano posible de dos moléculas durante la colisión. Obsérvese que el volumen excluido es mayor que el volumen de la molécula, siendo su radio la mitad nuevamente mayor que el de una molécula esférica.
El otro efecto que necesitaba corregir van der Waals son las fuerzas atractivas intermoleculares. Estos son ignorados en el modelo de gas ideal, pero en los gases reales ejercen una pequeña fuerza cohesiva entre las moléculas, ayudando así a mantener el gas unido y reduciendo la presión que ejerce sobre las paredes del contenedor.
Debido a que esta presión depende tanto de la frecuencia como de la intensidad de colisiones con las paredes, la reducción de la presión es proporcional al cuadrado del número de moléculas por volumen de espacio, y así para un número fijo de moléculas como un mol, la reducción en la presión es inversamente proporcional al cuadrado del volumen del gas. Cuanto menor sea el volumen, más cerca están las moléculas y mayor será el efecto. La ecuación de van der Walls reemplaza el\(P\) término en la ecuación de gas ideal con\(P + (a / V^2)\) la que la magnitud de la constante a aumenta con la fuerza de las fuerzas de atracción intermoleculares.
La ecuación de estado completa de van der Waals se puede escribir como
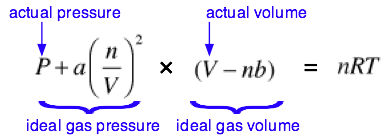
Aunque la mayoría de los estudiantes no están obligados a memorizar esta ecuación, se espera que la entiendas y expliques la significación de los términos que contiene. También hay que entender que las constantes van der Waals\(a\) y\(b\) deben determinarse empíricamente para cada gas. Esto se puede hacer trazando el comportamiento P-V del gas y ajustando los valores de\(a\) y\(b\) hasta que la ecuación de van der Waals resulte en una gráfica idéntica. La constante a se relaciona de manera sencilla con el radio molecular; por lo tanto, la determinación de\(a\) constituye una medición indirecta de una cantidad microscópica importante.
|
Sustancia
|
masa molar (g) |
a (L 2 -atm mol —2)
|
b (L mol —1)
|
|---|---|---|---|
| hidrógeno H 2 | 2 | 0.244 | 0.0266 |
| helio Él | 4 | 0.034 | 0.0237 |
| metano CH 4 | 16 | 2.25 | 0.0428 |
| agua H 2 O | 18 | 5.46 | 0.0305 |
| nitrógeno N 2 | 28 | 1.39 | 0.0391 |
| dióxido de carbono CO 2 | 44 | 3.59 | 0.0427 |
| tetracloruro de carbono CCl 4 | 154 | 20.4 | 0.1383 |
La ecuación de van der Waals es sólo una de las muchas ecuaciones de estado para gases reales. Se requieren ecuaciones más elaboradas para describir el comportamiento de los gases en rangos de presión más amplios. Estos generalmente toman en cuenta las fuerzas de atracción no lineales de orden superior, y requieren el uso de constantes más empíricas. Si bien no los haremos uso en este curso, son ampliamente empleados en trabajos de ingeniería química en los que se debe predecir con precisión el comportamiento de los gases a altas presiones.
Condensación y punto crítico
La característica más llamativa de los gases reales es que dejan de seguir siendo gases a medida que se baja la temperatura y se incrementa la presión. La figura\(\PageIndex{6}\) ilustra este comportamiento; a medida que disminuye el volumen, las isotermas de baja temperatura cambian repentinamente a líneas rectas. En estas condiciones, la presión permanece constante a medida que se reduce el volumen. Esto sólo puede significar que el gas está “desapareciendo” a medida que apretamos el sistema a un volumen menor. En su lugar, obtenemos un nuevo estado de la materia, el líquido. En la región verde-sombreada, dos fases, líquido y gas, están presentes simultáneamente. Finalmente, a un volumen muy pequeño todo el gas ha desaparecido y solo queda la fase líquida. En este punto las isotermas se doblan fuertemente hacia arriba, reflejando nuestra experiencia común de que un líquido es prácticamente incompresible.
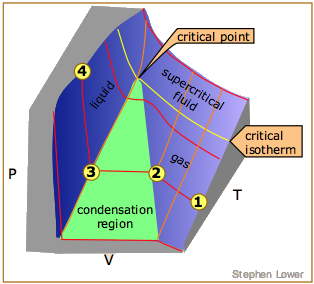
Para entender mejor esta trama, observe la isoterma etiquetada  . A medida que el gas se comprime de
. A medida que el gas se comprime de  a
a  , la presión aumenta de la misma manera que predice la ley de Boyle. La compresión más allá
, la presión aumenta de la misma manera que predice la ley de Boyle. La compresión más allá  , sin embargo, no causa ningún aumento en la presión. Lo que sucede en cambio es que parte del gas se condensa en un líquido. At
, sin embargo, no causa ningún aumento en la presión. Lo que sucede en cambio es que parte del gas se condensa en un líquido. At  , la sustancia se encuentra enteramente en su estado líquido. La subida muy pronunciada a
, la sustancia se encuentra enteramente en su estado líquido. La subida muy pronunciada a  corresponde a nuestra experiencia ordinaria de que los líquidos tienen compresibilidades muy bajas. El rango de volúmenes posibles para el líquido disminuye a medida que se acerca la temperatura crítica.
corresponde a nuestra experiencia ordinaria de que los líquidos tienen compresibilidades muy bajas. El rango de volúmenes posibles para el líquido disminuye a medida que se acerca la temperatura crítica.
El punto crítico
El líquido y el gas solo pueden coexistir dentro de las regiones indicadas por el área sombreada en verde en el diagrama anterior. A medida que la temperatura y la presión aumentan, esta región se vuelve más estrecha, llegando finalmente a cero ancho en el punto crítico. Los valores de P, T y V en esta coyuntura se conocen como las constantes críticas P c, T c y V c. La isoterma que pasa por el punto crítico se denomina isoterma crítica. Más allá de esta isoterma, el gas y los líquidos se vuelven indistinguibles; solo hay una sola fase fluida, a veces denominada líquido supercrítico (Figura\(\PageIndex{7}\)).
A temperaturas por debajo de 31°C (la temperatura crítica), el CO 2 actúa como un gas ideal incluso a una presión bastante alta ( ). Por debajo de 31°, un intento de comprimir el gas a un volumen menor eventualmente provoca que comience la condensación. Así, a 21°C, a una presión de aproximadamente 62 atm (
). Por debajo de 31°, un intento de comprimir el gas a un volumen menor eventualmente provoca que comience la condensación. Así, a 21°C, a una presión de aproximadamente 62 atm (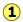 ), el volumen puede reducirse de 200 cm 3 a aproximadamente 55 cm 3 sin ningún aumento adicional en la presión. En lugar de comprimir el gas, se reemplaza con el líquido mucho más compacto ya que el gas está siendo esencialmente “exprimido” en su fase líquida. Después de que todo el gas ha desaparecido (
), el volumen puede reducirse de 200 cm 3 a aproximadamente 55 cm 3 sin ningún aumento adicional en la presión. En lugar de comprimir el gas, se reemplaza con el líquido mucho más compacto ya que el gas está siendo esencialmente “exprimido” en su fase líquida. Después de que todo el gas ha desaparecido ( ), la presión sube muy rápidamente porque ahora todo lo que queda es un líquido casi incompresible. Por encima de esta isoterma (
), la presión sube muy rápidamente porque ahora todo lo que queda es un líquido casi incompresible. Por encima de esta isoterma ( ), el CO 2 existe solo como un fluido supercrítico.
), el CO 2 existe solo como un fluido supercrítico.
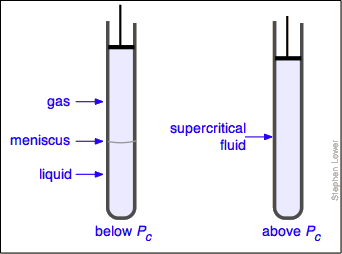
¿Qué pasa si tienes algo de dióxido de carbono líquido en un cilindro transparente justo por debajo de su P c de 62 atm, y luego lo comprimes ligeramente? Nada muy dramático hasta que notes que el menisco ha desaparecido. Al reducir y aumentar sucesivamente la presión, se puede “encender y apagar el menisco”.
Una consecuencia intrigante de los límites muy limitados del estado líquido es que se podría comenzar con un gas a gran volumen y baja temperatura, elevar la temperatura, reducir el volumen, y luego reducir la temperatura para llegar a la región líquida en la parte inferior izquierda, sin pasar nunca por los dos- región de fase, y por lo tanto sin sufrir condensación!
Fluidos supercríticos
El estado supercrítico de la materia, como suele llamarse al fluido por encima del punto crítico, posee las propiedades de flujo de un gas y las propiedades solventes de un líquido. La densidad de un fluido supercrítico se puede cambiar en un amplio rango ajustando la presión; esto, a su vez, cambia su solubilidad, que de esta manera se puede optimizar para una aplicación particular. La imagen de la derecha muestra un dispositivo de laboratorio comercial utilizado para llevar a cabo reacciones químicas en condiciones supercríticas.
El dióxido de carbono supercrítico es ampliamente utilizado para disolver la cafeína de los granos de café y como solvente de limpieza en seco. El agua supercrítica ha atraído recientemente el interés como medio para descomponer químicamente contaminantes ambientales peligrosos como los PCB. Los fluidos supercríticos se emplean cada vez más como sustitutos de solventes orgánicos (la llamada “química verde”) en una variedad de procesos industriales y de laboratorio. Las aplicaciones que involucran fluidos supercríticos incluyen extracciones, nano partículas y formación de película nanoestructurada, secado supercrítico, captura y almacenamiento de carbono, así como estudios mejorados de recuperación de petróleo.


