7.1: Materia bajo el Microscopio
- Page ID
- 70751
- Declarar el rasgo principal que caracteriza a un estado condensado de la materia.
- Describir algunas de las principales propiedades observables que distinguen gases, líquidos y sólidos, y establecen sus magnitudes relativas en estos tres estados de la materia.
- Describir las fuerzas dominantes y las propiedades físicas resultantes que distinguen los sólidos iónicos, covalentes, metálicos y moleculares.
- Explicar la diferencia entre sólidos cristalinos y amorfos, y citar algunos ejemplos de cada uno.
- Nombra algunas de las unidades moleculares básicas a partir de las cuales se pueden componer sólidos de diferente tipo.
- ¿Qué se entiende por un "extendido" o “sólido de molécula infinita”?
- Describir algunas de las propiedades especiales del grafito y sus bases estructurales.
Gases, líquidos y especialmente sólidos nos rodean y dan forma a nuestro mundo. La química en su nivel más fundamental es sobre los átomos y las fuerzas que actúan entre ellos para formar unidades estructurales más grandes. Pero la materia que experimentamos con nuestros sentidos está muy alejada de este nivel. Esta unidad te ayudará a ver cómo estas propiedades macroscópicas de la materia dependen de las partículas microscópicas de las que está compuesta.
Sólidos, Líquidos y Gases
¿Qué distingue entre sí a sólidos, líquidos y gases, los tres estados principales de la materia? Comencemos a nivel microscópico, revisando lo que sabemos sobre los gases, el estado más simple en el que puede existir la materia. A presiones ordinarias, las moléculas de un gas están tan separadas que las fuerzas intermoleculares tienen un efecto insignificante sobre los movimientos térmicos aleatorios de las partículas individuales. A medida que la temperatura disminuye y la presión aumenta, las atracciones intermoleculares se vuelven más importantes, y habrá una tendencia creciente a que las moléculas formen racimos temporales. Estos son tan efímeros, sin embargo, que incluso en condiciones extremas, no se puede decir que los gases posean “estructura” en el sentido habitual.

El contraste a nivel microscópico entre sólidos, líquidos y gases se ve más claramente en las vistas esquemáticas simplificadas anteriores. Las unidades moleculares de los sólidos cristalinos tienden a ser altamente ordenadas, ocupando cada unidad una posición fija con respecto a las demás. En los líquidos, las moléculas son capaces de deslizarse unas alrededor de otras, introduciendo un elemento de desorden y creando algunos espacios vacíos que disminuyen la densidad. Los gases presentan un cuadro de desorden casi total, prácticamente sin restricciones sobre dónde puede estar cualquier molécula.
Habiendo vivido nuestras vidas en un mundo compuesto por sólidos, líquidos y gases, pocos de nosotros tenemos alguna dificultad para decidir en cuál de estas categorías cae una muestra determinada de materia. Nuestra decisión se basa más comúnmente en señales puramente visuales:
- un gas no tiene límites definidos distintos de los que podrían ser impuestos por las paredes de un buque confinante.
- Los líquidos y sólidos poseen un límite de fase claramente delineado que le da a los sólidos sus formas definidas y cuyas propiedades reflectantes de la luz nos permiten distinguir una fase de otra.
- Los sólidos pueden tener cualquier forma concebible, y sus superficies suelen ser demasiado irregulares para mostrar un reflejo especular (similar a un espejo) de la luz. Los líquidos, por otro lado, son móviles; excepto cuando están en forma de pequeñas gotas, los líquidos no tienen forma inherente propia, sino que asumen la forma de su contenedor y muestran una superficie superior aproximadamente plana.
Nuestra experiencia también nos dice que estas categorías son bastante distintas; una fase, que recordará es una región de materia que tiene propiedades intensivas uniformes, es ya sea un gas, un líquido o un sólido. Así, los tres estados de la materia no son simplemente tres puntos en un continuo; cuando un sólido ordinario se funde, suele hacerlo a una temperatura definida, sin que aparentemente pase por ningún estado que sea intermedio entre un sólido y un líquido.
Comportamiento limitante
Aunque estas percepciones de sentido común suelen ser correctas, no son infalibles, y de hecho hay sólidos como los vidrios y muchos plásticos que no tienen puntos de fusión agudos, sino que experimentan una transición gradual de sólido a líquido conocido como ablandamiento, y cuando están sujetos a suficientes presión, los sólidos pueden exhibir algo de las propiedades de flujo de los líquidos (hielo glacial, por ejemplo).

Un enfoque más científico sería comparar las propiedades físicas macroscópicas de los tres estados de la materia, pero incluso aquí nos encontramos con dificultades. Es cierto, por ejemplo, que la densidad de un gas suele ser aproximadamente una milésima parte de la del líquido o sólido a la misma temperatura y presión; así un gramo de vapor de agua a 100°C y 1 atm de presión ocupa un volumen de 1671 mL; cuando se condensa a agua líquida a la misma temperatura, ocupa solo 1 .043 mL.
| Fase | Densidad |
|---|---|
| gas | 22,400 cm 3 /mol volumen total (42 cm 3 /mol de volumen excluido) |
| líquido | 16.8 cm 3 /mol |
| sólido | 13.9 cm 3 /mol |
Tabla\(\PageIndex{1}\) compara los volúmenes molares de neón en sus tres estados. Para el estado gaseoso, P = 1 atm y T = 0°C El volumen excluido es el volumen realmente absorbido por los átomos de neón según la ecuación de van der Waals del modelo de estado. Es este contraste extremo con los estados gaseosos lo que lleva a la denominación “estados condensados de la materia” para líquidos y sólidos. Sin embargo, los gases a presiones muy altas pueden tener densidades que superan las de otras sustancias sólidas y líquidas, por lo que la densidad por sí sola no es un criterio suficientemente completo para distinguir entre los estados gaseoso y condensado de la materia. De igual manera, la densidad de un sólido suele ser mayor que la del líquido correspondiente a la misma temperatura y presión, pero no siempre: ¡ciertamente has visto hielo flotando en el agua!
Comparar la densidad del xenón gaseoso (masa molar 131 g) a 100 atm y 0°C con la de un hidrocarburo líquido para el cual\(ρ = 0.104\, g/mL\) a la misma temperatura.
Solución
Por simplicidad, asumiremos que el xenón se aproxima a un gas ideal bajo estas condiciones, lo que realmente no lo hace.
El volumen molar ideal a 0° C y 1 atm es 22.4 L; a 100 atm, este se reduciría a 0.22 L o 220 mL, dando una densidad
\[ρ = \dfrac{131\, g}{224\, mL} = 0.58\, g/mL. \nonumber\]
En su autobiográfico Tío Tungsten, el médico/autor Oliver Sacks describe su experiencia con globos llenos de xenón de “asombrosa densidad —tan cerca de 'globos de plomo” como podría [imaginarse]. Si uno girara estos globos de xenón en la mano, luego se detuviera, el gas pesado, por su propio impulso, seguiría rotando por un minuto, casi como si se tratara de un líquido”.
Otras propiedades físicas, como la compresibilidad, la tensión superficial y la viscosidad, son algo más útiles para distinguir entre los diferentes estados de la materia. Incluso estos, sin embargo, no proporcionan líneas divisorias bien definidas entre los diversos estados. En lugar de tratar de desarrollar un esquema estricto para clasificar los tres estados de la materia, será más útil simplemente presentar algunas generalizaciones.
| propiedad |
|
|
|
|---|---|---|---|
| densidad | muy pequeño | grande | grande |
| coeficiente de expansión térmica | grande (= R/P) | pequeño | pequeño |
| cohesividad | nulo | pequeño | grande |
| tensión superficial | nulo | mediano | muy grande |
| viscosidad | pequeño | mediano | muy grande |
| energía cinética por molécula | grande | pequeño | más pequeños |
| trastorno | aleatorio | mediano | pequeño |
Estados condensados de la materia
Algunos de estos tratan de propiedades macroscópicas (es decir, propiedades como la densidad que se relaciona con la materia a granel), y otros con propiedades microscópicas que hacen referencia a las unidades moleculares individuales. Incluso la inspección más casual de la tabla anterior muestra que los sólidos y líquidos poseen una importante comunalidad que los distingue de los gases: en sólidos y líquidos, las moléculas están en contacto con sus vecinos. Como consecuencia, estos estados condensados de la materia generalmente poseen densidades mucho mayores que los gases.
En nuestro estudio de gases, demostramos que las propiedades macroscópicas de un gas (presión, volumen y temperatura) están relacionadas a través de una ecuación de estado, y que para el caso limitante de un gas ideal, esta ecuación de estado puede derivarse del conjunto relativamente pequeño de supuestos de la teoría molecular cinética. En la medida en que un volumen de gas consiste principalmente en espacio vacío, todos los gases tienen propiedades muy similares. Las ecuaciones de estado funcionan para los gases porque los gases consisten principalmente en espacio vacío, por lo que las interacciones intermoleculares pueden descuidarse en gran medida. En la materia condensada, estas interacciones dominan, y tienden a ser únicas para cada sustancia en particular, por lo que no existe tal cosa como una ecuación generalmente útil de estado de líquidos y sólidos.
¿Existe una teoría algo más elaborada que pueda predecir el comportamiento de los otros dos estados principales de la materia, los líquidos y los sólidos? Muy simple, la respuesta es “no”; a pesar de mucho esfuerzo, nadie ha podido todavía derivar una ecuación general de estado para estados condensados de la materia. Lo mejor que se puede hacer es construir modelos basados en la interacción imaginada de fuerzas atractivas y repulsivas, para luego probar estos modelos mediante simulación por computadora. Sin embargo, los mismos factores que parecerían complicar increíblemente una ecuación de estado para líquidos y sólidos también dan lugar a nuevos efectos que se observan fácilmente, y que finalmente definen las características distintivas de los estados gaseoso, líquido y sólido de la materia. En esta unidad, trataremos de aprender algo sobre estas distinciones, y cómo se ven afectadas por la constitución química de una sustancia.
Líquidos
Los sólidos y gases cristalinos se encuentran en los dos extremos del espectro de orden perfecto y caos completo. Los líquidos muestran elementos de ambas cualidades, y tanto de manera limitada como imperfecta. Líquidos y sólidos comparten la mayor parte de las propiedades de tener sus unidades moleculares en contacto directo como se discutió en la sección anterior sobre estados condensados de la materia. Al mismo tiempo, los líquidos, como los gases, son fluidos, lo que significa que sus unidades moleculares pueden moverse más o menos independientemente unas de otras. Pero mientras que el volumen de un gas depende completamente de la presión (y por lo tanto generalmente del volumen dentro del cual está confinado), el volumen de un líquido es en gran medida independiente de la presión. Aquí te ofrecemos lo justo para ayudarte a ver cómo se relacionan con los otros estados importantes de la materia.
Sólidos
De los cuatro elementos antiguos de “fuego, aire, tierra y agua”, son las muchas formas de sólidos (“tierras”) que encontramos en la vida cotidiana y que dan forma, color y variedad a nuestro mundo visual. El estado sólido, al ser la forma de cualquier sustancia que prevalezca a temperaturas más bajas, es aquel en el que el movimiento térmico juega un papel aún menor que en los líquidos. La energía cinética térmica que las unidades moleculares individuales sí tienen a temperaturas por debajo de sus puntos de fusión les permite oscilar alrededor de un centro fijo cuya ubicación está determinada por el equilibrio entre las fuerzas locales de atracción y repulsión debido a las unidades vecinas, pero solo muy raramente se salto de molécula fuera del espacio fijo asignado a ella en la celosía. Así, los sólidos, a diferencia de los líquidos, exhiben orden de largo alcance, cohesión y rigidez, y poseen formas definidas.
Clasificación de sólidos
La mayoría de las personas que han vivido en el mundo el tiempo suficiente para leer esto ya han desarrollado una forma aproximada de categorizar los sólidos sobre la base de propiedades macroscópicas que pueden observar fácilmente; todos saben que una pieza de metal es fundamentalmente diferente de una roca o un trozo de madera. Desafortunadamente, el ingenio de la naturaleza es demasiado versátil para encajar en cualquier sistema simple de clasificación de sólidos, especialmente aquellos compuestos por más de una sola sustancia química.
Esquema de clasificación 1: Según tipo de enlace
La clasificación más utilizada se basa en los tipos de fuerzas que unen las unidades moleculares de un sólido entre sí. Por lo general, podemos distinguir cuatro categorías principales sobre la base de propiedades como apariencia general, dureza y punto de fusión.
|
|
|
|
|
|---|---|---|---|
| iónico | iones | culombic | alto punto de fusión, duro, quebradizo |
| covalente | átomos de elementos electronegativos | enlaces químicos | no fundir (descomponer), extremadamente duro |
| metálico | átomos de elementos electropositivos | electrones móviles | Punto de fusión moderado a alto, deformable, conductor, brillo metálico |
| molecular | moléculas | van der Waals | mp bajo a moderado, dureza baja |
Es importante entender que estas cuatro categorías son en cierto sentido idealizaciones que no reflejan la diversidad que se encuentra en la naturaleza. El diagrama triangular que se muestra aquí ilustra esto muy bien al mostrar ejemplos de compuestos binarios cuyas propiedades sugieren que caen en algún lugar que no sea en un vértice del triángulo.
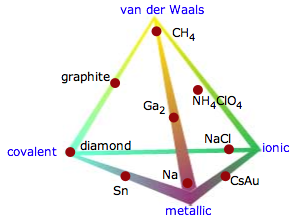
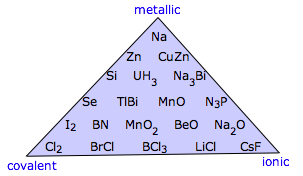
El triángulo mostrado anteriormente excluye lo que probablemente sea la categoría más grande: los sólidos moleculares que están unidos por fuerzas de van der Waals. Una forma de incluirlos es expandir el triángulo a un tetraedro (el llamado tetraedro Laing). Aunque esto ilustra el concepto, resulta visualmente incómodo incluir muchos ejemplos de los casos intermedios.
Esquema de clasificación 2: Por tipo de unidad molecular
Los sólidos, al igual que los demás estados de la materia, pueden clasificarse según si sus unidades moleculares fundamentales son átomos, moléculas eléctricamente neutras o iones. Pero los sólidos poseen una propiedad adicional que los gases y líquidos no tienen: una disposición estructural duradera de sus unidades moleculares. Sobresimplificando solo un poco, podemos elaborar una clasificación aproximada de sólidos de acuerdo con el siguiente esquema:
|
|
|
|
|---|---|---|
| matriz de unidades discretas | sólidos de gas noble, metales | sólidos moleculares |
| matriz de unidades enlazadas | metales y sólidos covalentes | Compuestos de “molécula extendida” |
| arreglo desordenado | formas alternativas de algunos elementos (por ejemplo, S, Se) | polímeros, vidrios |
Esquema de clasificación 3: Clasificación por Fuerza Atractiva Dominante
Observe cómo los puntos de ebullición en los siguientes ejemplos seleccionados reflejan el tipo principal de fuerza de atracción que une las unidades moleculares juntas. Tenga en cuenta, sin embargo, que más de un tipo de fuerza de atracción puede ser operativa en muchas sustancias.
| sustancia | bp °C | unidades moleculares | fuerza atractiva dominante | distancia de separación (pm) | energía de atracción (kJ/mol) |
|---|---|---|---|---|---|
| fluoruro de sodio | 990 | Na + F — | culombic | 18.8 | 657 |
| hidróxido de sodio | 318 | Na + OH — | ión-dipolo | 21.4 | 90.4 |
| agua | 100 | H 2 O | dipolo-dipolo | 23.7 | 20.2 |
| neón | 249 | Ne | dispersión | 33.0 | 0.26 |
Sólidos cristalinos
En un sólido compuesto por unidades moleculares idénticas, las ubicaciones más favorecidas (energía potencial más baja) ocurren a intervalos regulares en el espacio. Si cada una de estas ubicaciones está realmente ocupada, el sólido se conoce como un cristal perfecto. Lo que realmente define a un sólido cristalino es que su estructura está compuesta por células unitarias repetitivas, cada una de las cuales contiene un pequeño número de unidades moleculares que llevan una relación geométrica fija entre sí. El orden de largo alcance resultante define un marco geométrico tridimensional conocido como celosía.
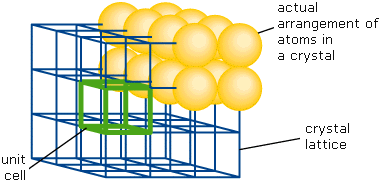
La teoría geométrica muestra que solo catorce tipos diferentes de celosías son posibles en tres dimensiones, y que solo seis arreglos diferentes de celdas unitarias pueden generar estas celosías. La regularidad de las caras externas de los cristales, que de hecho corresponden a planos de celosía, refleja el orden de largo alcance inherente a la estructura subyacente. La perfección no es más alcanzable en un cristal que en cualquier otra cosa; los cristales reales contienen defectos de diversos tipos, como las posiciones de celosía que están vacantes u ocupadas por impurezas, o por desplazamientos bruscos o dislocaciones de la estructura reticular. La mayoría de las sustancias puras, incluyendo los elementos metálicos, forman sólidos cristalinos. Pero hay algunas excepciones importantes.
Sólidos Metálicos
En los metales los electrones de valencia son libres de vagar por todo el sólido, en lugar de estar localizados en un átomo y compartidos con uno vecino. Los electrones de valencia se comportan muy como un fluido móvil en el que se sumerge la red fija de átomos. Esto proporciona lo último en intercambio de electrones, y crea un efecto de unión muy fuerte en sólidos compuestos por elementos que tienen el número requerido de electrones en sus conchas de valencia. Las propiedades físicas características de los metales, como su capacidad para doblarse y deformarse sin romperse, sus altas conductividades térmicas y eléctricas y su brillo metálico, se deben al comportamiento fluido de los electrones de valencia.
Sólidos moleculares
Recordemos que una “molécula” se define como un agregado discreto de átomos unidos entre sí suficientemente apretadamente (es decir, por fuerzas covalentes dirigidas) para permitirle retener su individualidad cuando la sustancia se disuelve, funde o vaporiza.
Las dos palabras cursivas en la oración anterior son importantes; la unión covalente implica que las fuerzas que actúan entre los átomos dentro de la molécula son mucho más fuertes que las que actúan entre moléculas, y la propiedad direccional del enlace covalente confiere a cada molécula una forma distintiva que afecta a varias de sus propiedades. La mayoría de los compuestos de carbono —y por tanto, la mayoría de las sustancias químicas, entran en esta categoría.
Muchos compuestos más simples también forman moléculas; H 2 O, NH 3, CO 2 y PCl 5 son ejemplos familiares. Algunos de los elementos, como H 2, O 2, O 3, P 4 y S 8 también se presentan como moléculas discretas. Los líquidos y sólidos que están compuestos por moléculas se mantienen unidos por las fuerzas de van der Waals, y muchas de sus propiedades reflejan esta débil unión. Así, los sólidos moleculares tienden a ser blandos o deformables, tienen puntos de fusión bajos y a menudo son suficientemente volátiles para evaporarse (sublime) directamente en la fase gaseosa; esta última propiedad a menudo da a tales sólidos un olor distintivo.
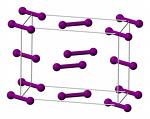
Yodo
El yodo es un buen ejemplo de un cristal molecular volátil. El sólido (mp 114° C, bp 184°) consiste en I 2 moléculas unidas entre sí solo por fuerzas de dispersión. Si alguna vez has trabajado con yodo sólido en el laboratorio, probablemente recordarás el olor y la vista de su vapor púrpura que se ve fácilmente en un recipiente cerrado.

Debido a que las fuerzas de dispersión y las otras fuerzas de van der Waals aumentan con el número de átomos, las moléculas más grandes son generalmente menos volátiles, y tienen puntos de fusión más altos, que las más pequeñas. Además, a medida que se mueve hacia abajo una columna en la tabla periódica, los electrones externos están más ligados al núcleo, aumentando la polarizabilidad del átomo y por lo tanto su susceptibilidad a las interacciones de tipo van der Waals. Este efecto es particularmente evidente en la progresión de los puntos de ebullición de los elementos de gas noble sucesivamente más pesados.
Sólidos Covalentes
Se trata de una clase de compuestos de celosía extendida (ver Sección 6 a continuación) en los que cada átomo está unido covalentemente a sus vecinos más cercanos. Esto significa que todo el cristal es en efecto una “molécula” súper gigante. Las fuerzas de unión extraordinariamente fuertes que unen todos los átomos adyacentes explican la extrema dureza de tales sustancias; estos sólidos no pueden romperse ni erosionarse sin escindir un gran número de enlaces químicos covalentes. Del mismo modo, un sólido covalente no puede “fundirse” en el sentido habitual, ya que todo el cristal es su propia molécula gigante. Cuando se calientan a temperaturas muy altas, estos sólidos generalmente se descomponen en sus elementos.
Diamante
El diamante es el material más duro conocido, definiendo el extremo superior de la escala 1-10 conocida como Dureza Mohs. El diamante no puede fundirse; por encima de 1700°C se convierte en grafito la forma más estable de carbono.
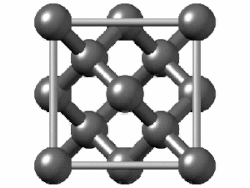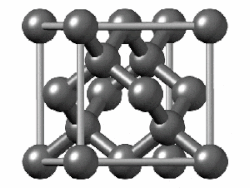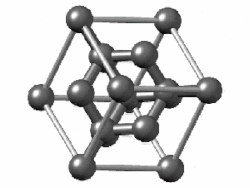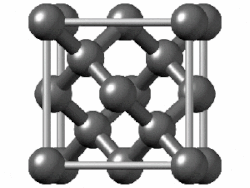
La celda unitaria de diamante es cúbica centrada en la cara y contiene 8 átomos de carbono. Los cuatro oscuros sombreados están contenidos dentro de la celda y están completamente unidos a otros miembros de la celda. Los otros átomos de carbono (6 en caras y 4 en las esquinas) tienen algunos enlaces que se extienden a átomos en otras celdas. (Dos de los carbonos más cercanos al espectador se muestran como círculos abiertos para revelar más claramente la disposición de unión).
Otros sólidos covalentes
El nitruro de boro BN es similar al carbono en que existe como un polimorfo cúbico similar al diamante, así como en una forma hexagonal análoga al grafito. El BN cúbico es el segundo material más duro después del diamante, y encuentra uso en abrasivos industriales y herramientas de corte. El interés reciente en BN se ha centrado en su capacidad similar al carbono para formar nanotubos y nanoestructuras relacionadas.
Carburo de silicio SiC también se conoce como carborundo. Su estructura es muy parecida a la del diamante con cada otro carbono reemplazado por silicio. Al calentar a presión atmosférica, se descompone a 2700°C, pero nunca se ha observado que se derrita. Estructuralmente, es muy complejo; se han identificado al menos 70 formas cristalinas. Su extrema dureza y facilidad de síntesis han llevado a una diversidad de aplicaciones: en herramientas de corte y abrasivos, semiconductores de alta temperatura y otras aplicaciones de alta temperatura, fabricación de aceros especiales, joyería y muchos más. El carburo de silicio es un mineral extremadamente raro en la tierra, y proviene principalmente de meteoritos que se cree que tienen su origen en estrellas carbonosas. El primer SiC sintético fue fabricado de manera accidentada por E.G. Acheson en 1891 quien inmediatamente reconoció sus perspectivas industriales y fundó la Carborundum Co.
El WC de carburo de tungsteno es probablemente el sólido covalente más ampliamente encontrado debido a su uso en herramientas de corte de “carburo” y como material utilizado para hacer las bolas giratorias en bolígrafos. Su forma de alto punto de fusión (2870°C) tiene una estructura similar a la del diamante y es solo un poco menos dura. En muchas de sus aplicaciones está incrustado en una matriz más blanda de cobalto o recubierta con compuestos de titanio.
Sólidos amorfos
En algunos sólidos hay tan poco orden de largo alcance que la sustancia no puede considerarse cristalina en absoluto; se dice que tal sólido es amorfo. Los sólidos amorfos poseen orden de corto alcance pero están desprovistos de cualquier estructura organizada en distancias más largas; en este sentido se asemejan a líquidos. Sin embargo, su rigidez y cohesión les permiten conservar una forma definida, por lo que para la mayoría de los propósitos prácticos pueden considerarse sólidos.
Los vidrios se refieren generalmente a sólidos formados a partir de sus fundidos que no regresan a sus formas cristalinas al enfriarse, sino que forman sólidos amorfos duros y a menudo transparentes. Si bien algunas sustancias orgánicas como el azúcar pueden formar vidrios (“caramelo de roca”), el término describe más comúnmente compuestos inorgánicos, especialmente los basados en sílice, SiO 2. Los vidrios naturales a base de sílice, conocidos como obsidiana, se forman cuando ciertos magmas volcánicos se enfrían rápidamente.
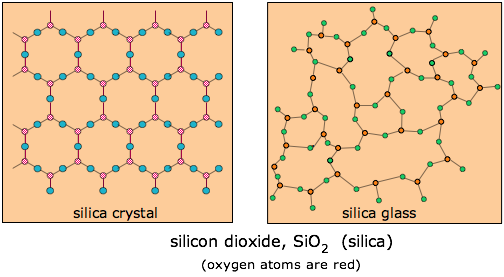
El vidrio ordinario está compuesto principalmente por SiO 2, que generalmente existe en la naturaleza en una forma cristalina conocida como cuarzo. Si el cuarzo (en forma de arena) se funde y se deja enfriar, se vuelve tan viscoso que las moléculas son incapaces de moverse a las posiciones de energía de bajo potencial que ocuparían en la red cristalina, de manera que el desorden presente en el líquido se “congela” en el sólido. En cierto sentido, el vidrio puede considerarse como un líquido superenfriado. Los vidrios son transparentes porque las distancias sobre las que aparece el desorden son pequeñas en comparación con la longitud de onda de la luz visible, por lo que no hay nada para dispersar la luz y producir nubosidad.
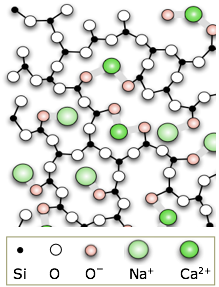
El vidrio ordinario se elabora fundiendo arena de sílice a la que se le han agregado algunos carbonatos de calcio y sodio. Estos aditivos reducen el punto de fusión y dificultan que las moléculas de SiO2 se dispongan en orden cristalino a medida que la mezcla se enfría. Se cree que el vidrio se hizo por primera vez en el Medio Oriente al menos tan pronto como 3000 BCE. Su trabajabilidad y facilidad de coloración lo han convertido en uno de los materiales más importantes y versátiles de la humanidad.
Tipos de unidades moleculares
Moléculas
Las moléculas, no es sorprendente, son los bloques de construcción más comunes de sustancias puras. La mayoría de las sustancias químicas de más de 15 millones actualmente conocidas existen como moléculas distintas. Los químicos comúnmente dividen los compuestos moleculares en tipos “pequeños” y “de molécula grande”, estos últimos generalmente caen dentro de la clase de polímeros (ver más abajo). La línea divisoria entre las dos categorías no está muy bien definida, y tiende a basarse más en las propiedades de la sustancia y cómo se aísla y purifica.
Átomos
Por lo general, pensamos en los átomos como los bloques de construcción de las moléculas, por lo que las únicas sustancias puras que consisten en átomos simples son las de algunos de los elementos, principalmente los elementos metálicos, y también los elementos de gas noble. Estos últimos forman líquidos y sólidos cristalinos, pero sólo a temperaturas muy bajas. Aunque los elementos metálicos forman sólidos cristalinos de naturaleza esencialmente atómica, las propiedades especiales que dan lugar a su naturaleza “metálica” los colocan en una categoría propia. La mayoría de los elementos no metálicos existen en condiciones ordinarias como moléculas pequeñas como O 2 o S 6, o como estructuras extendidas que pueden tener una naturaleza algo polimérica. Muchos de estos elementos pueden formar más de un tipo de estructura, cada una estable bajo diferentes rangos de temperatura y presión. Múltiples estructuras del mismo elemento se conocen como alótropos, aunque ahora se prefiere el término más general polimorfo.
Iones
Los iones, recordarán, son átomos o moléculas que tienen uno o más electrones faltantes (iones positivos) o en exceso (iones negativos), y por lo tanto poseen una carga eléctrica. Una ley básica de la naturaleza, el principio de electroneutralidad, establece que la materia a granel no puede adquirir más que una carga eléctrica neta insignificante (y químicamente insignificante). Entonces, una cosa importante que hay que saber sobre los iones es que en la materia ordinaria, ya sea en estado sólido, líquido o gaseoso, cualquier ion positivo debe ir acompañado de un número compensador de iones negativos. Las sustancias iónicas como el cloruro de sodio forman sólidos cristalinos que pueden considerarse hechos de iones. Estos sólidos tienden a ser bastante duros y tienen altos puntos de fusión, reflejando las fuertes fuerzas entre los iones con carga contraria. Los óxidos metálicos sólidos, como el CaO y el MgO, que están compuestos por iones doblemente cargados, no se funden en absoluto, sino que simplemente se disocian en los elementos a temperaturas muy altas.
Polímeros
Los plásticos y materiales naturales como el caucho o la celulosa están compuestos por moléculas muy grandes llamadas polímeros; muchas biomoléculas importantes también son de naturaleza polimérica. Debido a su gran longitud, estas moléculas tienden a enredarse en estado líquido, y son incapaces de separarse para formar una red cristalina al enfriarse. En general, es muy difícil conseguir que tales sustancias formen otra cosa que no sean sólidos amorfos.
Sólidos extendidos
realmente existen en sus formas sólidas como conjuntos enlazados de estas unidades básicas dispuestas en cadenas o capas que se extienden indefinidamente en una, dos o tres dimensiones. Así, los modelos muy simples de unión química que se aplican a las moléculas aisladas en forma gaseosa deben modificarse para dar cuenta de la unión en algunos de estos sólidos. Los términos “unidimensional” y “bidimensional”, comúnmente empleados en este contexto, deberían estar precedidos con mayor precisión por "cuasi- “; después de todo, ¡incluso un solo átomo ocupa el espacio tridimensional!
Sólidos unidimensionales
Los átomos de algunos elementos como el azufre y el selenio pueden unirse en largas cadenas de longitud indefinida, formando así sólidos poliméricos amorfos. El más conocido de ellos es el “azufre plástico” amorfo que se forma cuando el azufre fundido se enfría rápidamente vertiéndolo en agua.Estas nunca son las formas más comunes (o estables) de estos elementos, que prefieren formar moléculas discretas.


Hebras similares a caucho de azufre de plástico formadas vertiendo azufre fundido caliente en agua fría. Después de unos días, volverá al azufre cristalino ordinario. Pero las moléculas pequeñas también pueden formar cadenas extendidas. El trióxido de azufre es un gas por encima de la temperatura ambiente, pero cuando se congela a 17°C el sólido forma cadenas largas en las que cada átomo S se coordina a cuatro átomos de oxígeno.
Sólidos multidimensionales
Muchas sustancias inorgánicas forman sólidos cristalinos que se construyen a partir de cadenas paralelas en las que las unidades de fórmula básica están unidas por enlaces débiles que involucran interacciones dipolo-dipolo y dipolo inducidas por dipolo. Las cadenas vecinas están unidas principalmente por fuerzas de dispersión.
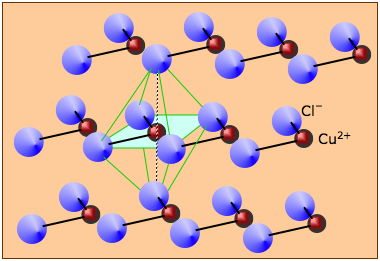
Estructuras en capas o en forma de lámina
El cloruro de cadmio sólido es un buen ejemplo de una estructura de capas. Los átomos de Cd y Cl ocupan capas separadas; cada una de estas capas se extiende en una tercera dimensión para formar una lámina. El cristal CdCl 2 se construye a partir de pilas de estas capas unidas por las fuerzas de van der Waals.
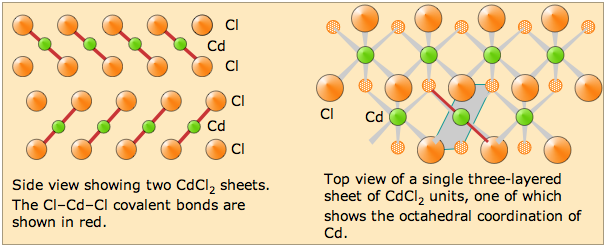
Cabe señalar que aunque sales como CuCl 2 y CDCl 2 se disocian en iones cuando están en solución acuosa, los propios sólidos no deben considerarse como “sólidos iónicos”. Consulte también esta sección de la lección sobre sólidos iónicos.
Grafito
El grafito es un polimorfo de carbono y su forma más estable. Consiste en láminas de anillos de benceno fundido apilados en capas. El espaciamiento entre capas es suficiente para admitir moléculas de vapor de agua y otros gases atmosféricos que se absorben en los espacios interlamelares y actúan como lubricantes, permitiendo que las capas se deslicen entre sí. Por lo tanto, el grafito en sí mismo suele tener un carácter de escamas y se usa comúnmente como lubricante sólido, aunque pierde esta propiedad en el vacío.
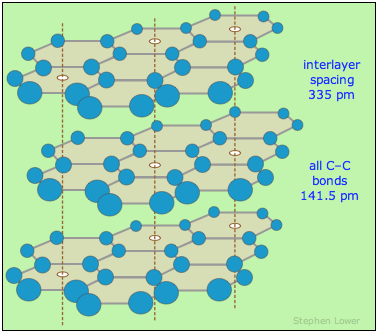
Como se esperaría de su estructura anistópica, la conductividad eléctrica y térmica del grafito son mucho mayores en direcciones paralelas a las capas que a través de las capas. El punto de fusión de 4700-5000°C hace que el grafito sea útil como material refractario de alta temperatura.
El grafito es la forma más común de carbono relativamente puro que se encuentra en la naturaleza. Su nombre proviene de la misma raíz que la palabra griega para “escribir” o “dibujar”, reflejando su uso como lápiz “plomo” desde el siglo XVI. (El nombre inapropiado, que sobrevive en uso común, se debe a su identificación errónea como mineral del elemento metálico del mismo nombre en un tiempo mucho antes de que se hubiera desarrollado la química moderna).
Grafeno
El grafeno es un material bidimensional que consiste en una sola capa de grafito, esencialmente “alambre de pollo hecho de carbono” que fue descubierto en 2004. Se pueden obtener pequeños fragmentos de grafeno por varios métodos; uno es unir un trozo de Scotch Tape™ a un trozo de grafito y luego extraerlo cuidadosamente (un proceso conocido como exfoliación). Los fragmentos de grafeno probablemente se producen cada vez que se escribe con un lápiz.
El grafeno tiene propiedades que son singularmente diferentes de todos los demás sólidos. Es el material más fuerte conocido, y exhibe una conductividad eléctrica extremadamente alta debido a sus electrones sin masa que aparentemente son capaces de viajar a velocidades relativistas a través de la capa.


