7.8: Celosías Cúbicas y Empaque Cerrado
- Page ID
- 70776
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- La diferencia entre empaque cuadrado y hexagonal en dos dimensiones.
- La definición y significación de la celda unitaria.
- Esbozar las tres celosías Bravais del sistema cúbico y calcular el número de átomos contenidos en cada una de estas celdas unitarias.
- Muestre cómo formas alternativas de apilar tres capas empaquetadas pueden conducir a las estructuras hexagonales o cúbicas empaquetadas.
- Explicar el origen y significado de los agujeros octaédricos y tetraédricos en capas apiladas y empaquetadas, y mostrar cómo pueden surgir.
Empaque de Esferas Idénticas
Los cristales son, por supuesto, objetos tridimensionales, pero comenzaremos explorando las propiedades de las matrices en el espacio bidimensional. Esto hará que sea más fácil desarrollar algunas de las ideas básicas sin la complicación añadida de conseguir que se visualice en 3-D, algo que a menudo requiere un poco de práctica. Supongamos que tiene una docena de canicas. ¿Cómo se pueden organizar en una sola capa compacta sobre una mesa? Obviamente, deben estar en contacto entre sí para minimizar el área que cubren. Resulta que existen dos formas eficientes de lograr esto:

La diferencia esencial aquí es que cualquier mármol dentro del interior de la matriz cuadrada está en contacto con otras cuatro canicas, mientras que este número se eleva a seis en la disposición empaquetada hexagonal. También debe ser evidente que este último esquema cubre un área más pequeña (contiene menos espacio vacío) y por lo tanto es un arreglo de empaque más eficiente. Si eres bueno en geometría, puedes demostrar que el empaque cuadrado cubre el 78 por ciento del área, mientras que el empaque hexagonal produce 91 por ciento de cobertura.
Si pasamos del mundo de los mármoles al de los átomos, ¿qué tipo de empaque preferirían los átomos de un elemento dado?
Si los átomos son idénticos y están unidos entre sí principalmente por fuerzas de dispersión que son completamente no direccionales, favorecerán una estructura en la que tantos átomos puedan estar en contacto directo como sea posible. Esta será, por supuesto, la disposición hexagonal.
Los enlaces químicos dirigidos entre los átomos tienen un efecto importante en el empaque. La versión de empaque hexagonal que se muestra a la derecha ocurre en forma de carbono conocido como grafito que forma láminas bidimensionales. Cada átomo de carbono dentro de una lámina está unido a otros tres átomos de carbono. El resultado es solo la estructura hexagonal básica con algunos átomos faltantes.
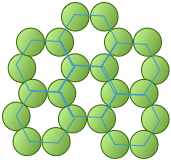
El número de coordinación de 3 refleja la hibridación sp 2 de carbono en grafito, dando como resultado la unión plano-trigonal y por lo tanto la estructura laminar. Las láminas adyacentes están unidas por fuerzas de dispersión débiles, lo que permite que las láminas se deslicen una sobre otra y dando lugar a las propiedades lubricantes y descamadas del grafito.
Celosías
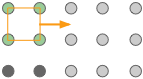
El orden subyacente de un sólido cristalino puede ser representado por una matriz de puntos regularmente espaciados que indican las ubicaciones de las unidades estructurales básicas del cristal. Esta matriz se llama celosía cristalina. Se puede pensar que las celosías cristalinas se construyen a partir de unidades repetitivas que contienen solo unos pocos átomos. Estas unidades repetitivas actúan como un sello de goma: presionarlo sobre el papel, moverlo (“traducir”) en una cantidad igual al espaciado de la celosía, y estampar nuevamente el papel.
|
Los círculos grises representan una matriz cuadrada de puntos de celosía. |
El cuadrado naranja es la celda unitaria más simple que se puede utilizar para definir la celosía bidimensional. |
Construyendo la celosía moviendo (“traduciendo”) la celda unitaria en una serie de pasos, |
Aunque los cristales reales en realidad no crecen de esta manera, este proceso es conceptualmente importante porque nos permite clasificar un tipo de celosía en términos de la simple unidad repetitiva que se utiliza para “construirla”. A esto llamamos a esta forma la celda unitaria. Se puede usar cualquier número de formas primitivas para definir la celda unitaria de una red cristalina dada. El que realmente se usa es en gran parte una cuestión de conveniencia, y puede contener un punto de celosía en su centro, como se ve en dos de las celdas unitarias que se muestran aquí. En general, la mejor celda unitaria es la más simple que es capaz de construir la celosía.
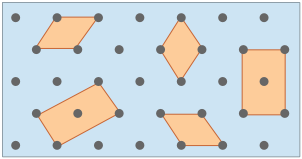

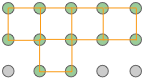
Se muestran arriba celdas unitarias para las celosías cuadradas y hexagonales empaquetadas que discutimos cerca del inicio de esta lección. Aunque podríamos usar un hexágono para la segunda de estas celosías, se prefiere el rombo porque es más simple.
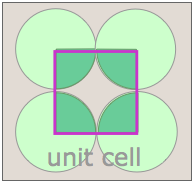
Observe que en ambas celosías, las esquinas de las celdas unitarias están centradas en un punto de celosía. Esto significa que un átomo o molécula ubicada en este punto en una red cristalina real se comparte con sus células vecinas. Como se muestra más claramente aquí para una red bidimensional empaquetada cuadrada, una sola célula unitaria puede reclamar “propiedad” de solo una cuarta parte de cada molécula, y así “contiene” 4 × ¼ = 1 molécula.
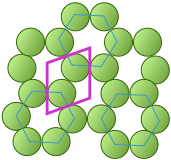
La celda unitaria de la forma grafito de carbono también es un rombo, de acuerdo con la simetría hexagonal de esta disposición. Observe que para generar esta estructura a partir de la celda unitaria, necesitamos desplazar la celda en ambas direcciones x - e y - para dejar espacios vacíos en los puntos correctos. Alternativamente, podríamos usar hexágonos regulares como celdas unitarias, pero aún se requerirían los desplazamientos x + y, por lo que generalmente se prefiere el rombo más simple. Como verá en la siguiente sección, los espacios vacíos dentro de estas celdas unitarias juegan un papel importante cuando pasamos de celosías bidimensionales a tridimensionales.
Cristales cúbicos
Para mantener esta lección dentro de límites razonables, la estamos limitando principalmente a cristales pertenecientes al llamado sistema cúbico. Al hacerlo, podemos desarrollar los principales conceptos que son útiles para entender estructuras más complicadas (¡como si no hubiera suficientes complicaciones solo en los cubículos!) Pero además, sucede que los cristales cúbicos se encuentran muy comúnmente; la mayoría de los elementos metálicos tienen estructuras cúbicas, y también lo hace la sal ordinaria, el cloruro de sodio.
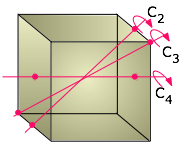
Generalmente pensamos en una forma cúbica en términos de la igualdad de sus longitudes de borde y los ángulos de 90° entre sus lados, pero hay otra forma de clasificar formas que los químicos encuentran muy útil. Esto es para mirar qué transformaciones geométricas (como las rotaciones alrededor de un eje) podemos realizar que dejan la apariencia inalterada. Por ejemplo, puede girar un cubo 90° alrededor de un eje perpendicular a cualquier par de sus seis caras sin hacer ningún cambio aparente en él. Decimos que el cubo posee tres ejes rotacionales cuatro veces mutuamente perpendiculares, abreviados C 4 ejes. Pero si lo piensas, también se puede girar un cubo alrededor de los ejes que se extienden entre esquinas opuestas; en este caso, se necesitan tres rotaciones de 120° para pasar por un círculo completo, por lo que estos ejes (también cuatro en número) son ejes triples o C 3.
Los cristales cúbicos pertenecen a uno de los siete sistemas cristalinos cuyos puntos de celosía pueden extenderse indefinidamente para llenar el espacio tridimensional y que pueden construirse mediante sucesivas traducciones (movimientos) de una celda unitaria primitiva en tres dimensiones. Como veremos a continuación, el sistema cúbico, así como algunos de los otros, pueden tener variantes en las que se pueden colocar puntos de celosía adicionales en el centro de la unidad o en el centro de cada cara.
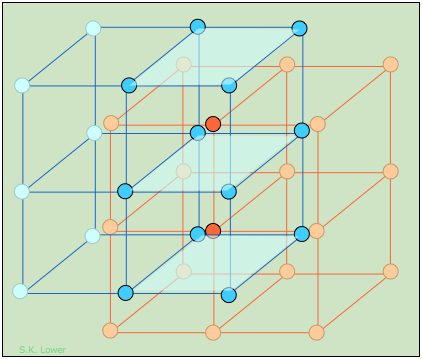
Los tres tipos de celosías cúbicas
Aquí se muestran las tres celosías Bravais que forman el sistema de cristal cúbico.
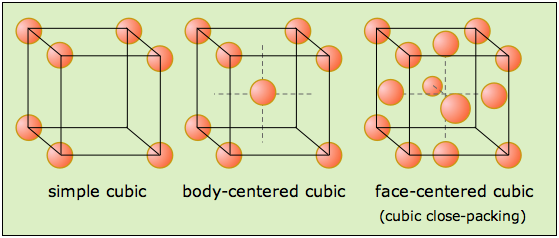
Se conocen ejemplos estructurales de los tres, siendo mucho más comunes los centrados en el cuerpo y la cara (BCC y FCC); la mayoría de los elementos metálicos cristalizan en una de estas últimas formas. Pero aunque la estructura cúbica simple es poco común por sí misma, resulta que muchas estructuras BCC y FCC compuestas por iones pueden considerarse como combinaciones interpenetrantes de dos simples celosías cúbicas, una compuesta por iones positivos y la otra por iones negativos. Observe que solo la estructura FCC, que describiremos a continuación, es una celosía empaquetada dentro del sistema cúbico.
Celosías empaquetadas en tres dimensiones
Las celosías compactas permiten la máxima cantidad de interacción entre los átomos. Si estas interacciones son principalmente atractivas, entonces el empaquetamiento cerrado generalmente conduce a estructuras más estables energéticamente. Estas geometrías de celosía se ven ampliamente en cristales metálicos, atómicos y simples iónicos.
Como señalamos anteriormente, el empaque hexagonal de una sola capa es más eficiente que el empaque cuadrado, por lo que aquí es donde comenzamos. Imagínese que comenzamos con la capa única de átomos verdes que se muestra a continuación. A esto lo llamaremos la capa A. Si colocamos una segunda capa de átomos (naranja) encima de la capa A, esperaríamos que los átomos de la nueva capa aniden en los huecos de la primera capa. Pero si todos los átomos son idénticos, sólo algunos de estos espacios vacíos serán accesibles.
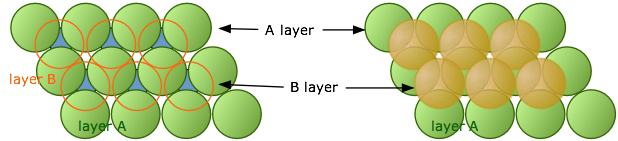
En el diagrama de la izquierda, observe que hay dos clases de espacios vacíos entre los átomos A; un conjunto (de color azul) tiene un vértice apuntando hacia arriba, mientras que el otro conjunto (no coloreado) tiene vértices apuntando hacia abajo. Cada espacio vacío constituye una depresión en la que los átomos de una segunda capa (la capa B) pueden anidar. Los dos conjuntos de espacios vacíos son completamente equivalentes, pero solo uno de estos conjuntos puede ser ocupado por una segunda capa de átomos cuyo tamaño es similar a los de la capa inferior. En la ilustración de la derecha arriba hemos colocado arbitrariamente los átomos de la capa B en los huecos azules, pero bien podríamos haber seleccionado los blancos.
Dos opciones para la tercera capa conducen a dos tipos diferentes de celosía empaquetados
Ahora considera lo que sucede cuando colocamos una tercera capa de átomos. Estos encajarán en los espacios vacíos dentro de la capa B. Como antes, existen dos conjuntos de estas posiciones, pero a diferencia del caso descrito anteriormente, no son equivalentes.
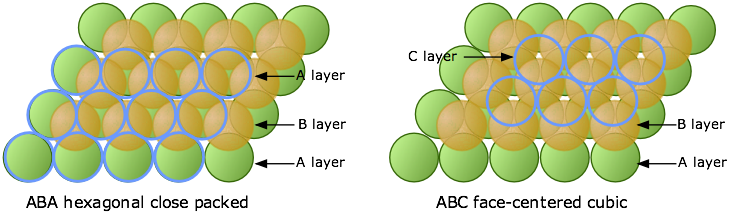
Los átomos en la tercera capa están representados por círculos azules abiertos para evitar oscurecer las capas debajo. En la ilustración de la izquierda, esta tercera capa se coloca sobre la capa B en ubicaciones que están directamente por encima de los átomos de la capa A, por lo que nuestra tercera capa es solo otra capa A. Si añadimos aún más capas, la secuencia vertical A-B-A-B-A-B-A... se repite indefinidamente.
En el diagrama de la derecha de arriba, los átomos azules se han colocado sobre los espacios vacíos blancos (desocupados) en la capa A. Debido a que esta tercera capa se desplaza horizontalmente (en nuestra opinión) de la capa A, la llamaremos capa C. A medida que agregamos más capas de átomos, la secuencia de capas es A-B-C-A-B-C-A-B-C..., así llamamos es ABC empacando.


Estos dos diagramas que muestran vistas explosionadas del apilamiento vertical ilustran aún más la pequeña diferencia fundamental entre estos dos arreglos, pero, como verá a continuación, tienen consecuencias estructurales ampliamente divergentes. Observe las orientaciones opuestas de las capas A y C
La estructura hexagonal cerrada
El apilamiento de HCP que se muestra a la izquierda justo arriba nos saca del sistema de cristal cúbico al sistema hexagonal, por lo que no diremos mucho más al respecto aquí excepto para señalar que cada átomo tiene 12 vecinos más cercanos: seis en su propia capa, y tres en cada capa por encima y por debajo de él.
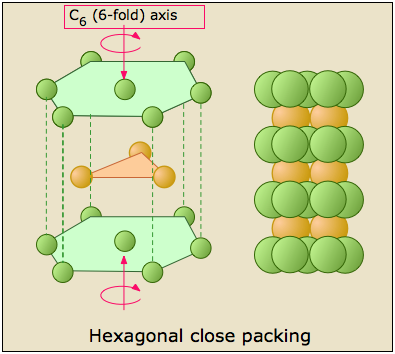
La estructura cúbica cerrada
A continuación reproducimos la estructura FCC que se mostró arriba.

Notarás que los átomos de la capa B forman un hexágono, pero esta es una estructura cúbica. ¿Cómo puede ser esto? La respuesta es que la pila FCC está inclinada con respecto a las caras del cubo, y de hecho es coincidente con uno de los ejes triples que pasa por esquinas opuestas. Se requiere un poco de estudio para ver la relación, y hemos brindado dos puntos de vista para ayudarte. El de la izquierda muestra el cubo en la proyección isométrica normal; el de la derecha mira hacia abajo sobre la parte superior del cubo en un ángulo ligeramente inclinado.
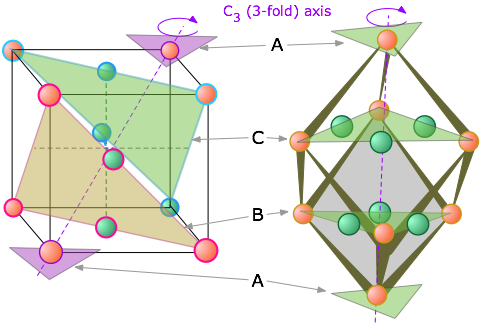
Tanto las estructuras CCP como HCP llenan 74 por ciento del espacio disponible cuando los átomos tienen el mismo tamaño. Deberías ver que los dos planos sombreados que recortan a lo largo de diagonales dentro del interior del cubo contienen átomos de diferentes colores, es decir, que pertenecen a diferentes capas de la pila CCP. Cada plano contiene tres átomos de la capa B y tres de la capa C, reduciendo así la simetría a C 3, que debe tener una red cúbica.
La celda unitaria FCC
La siguiente figura muestra la celda unitaria cúbica centrada en la cara de una celosía empaquetada de cierre cúbico.
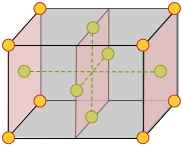
¿Cuántos átomos están contenidos en una celda unitaria? Cada átomo de esquina se comparte con ocho celdas unitarias adyacentes y por lo tanto una sola celda unitaria puede reclamar solo 1/8 de cada uno de los ocho átomos de esquina. De manera similar, cada uno de los seis átomos centrados en una cara es solo a la mitad propiedad de la célula. El total general es entonces (8 × 1/8) + (6 × ½) = 4 átomos por celda unitaria.
Espacios vacíos intersticiales
Los átomos en cada capa en estas pilas de empaquetamiento cerrado se asientan en una depresión en la capa debajo de ella. Como explicamos anteriormente, estos espacios vacíos no están completamente llenos. (Es geométricamente imposible que más de dos esferas idénticas estén en contacto en un solo punto.) Veremos más adelante que estos espacios vacíos intersticiales a veces pueden acomodar átomos o iones adicionales (pero generalmente más pequeños).
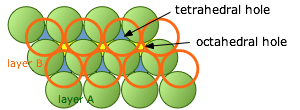
Si miramos hacia abajo encima de dos capas de esferas empaquetadas, podemos elegir dos clases de espacios vacíos que llamamos agujeros tetraédricos y octaédricos.
Agujeros tetraédricos
Si dirigimos nuestra atención a una región en el diagrama anterior donde un solo átomo está en contacto con los tres átomos en las capas directamente debajo de él, el espacio vacío se conoce como un agujero tetraédrico. Se encontrará un espacio similar entre este solo átomo y los tres átomos (no mostrados) que estarían encima de él en una red extendida. Cualquier átomo intersticial que pueda ocupar este sitio interactuará con los cuatro átomos que lo rodean, por lo que también se denomina espacio intersticial de cuatro coordenadas.
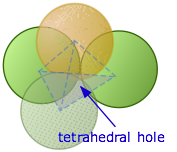
No se deje engañar por este nombre; los límites del espacio vacío son secciones esféricas, no tetraedros. El tetraedro no es más que una construcción imaginaria cuyas cuatro esquinas apuntan a los centros de los cuatro átomos que están en contacto.
Agujeros octaédricos
De igual manera, cuando dos conjuntos de tres esferas orientadas trigonalmente están en contacto estrecho, se orientarán 60° de separación y los centros de las esferas definirán las seis esquinas de un octaedro imaginario centrado en el espacio vacío entre las dos capas, así llamamos a estos agujeros octaédricos o sitios intersticiales de seis coordenadas. Los sitios octaédricos son más grandes que los sitios tetraédricos.
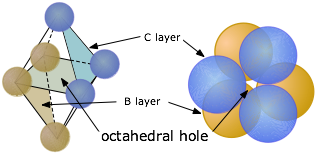
Un octaedro tiene seis esquinas y ocho lados. Por lo general dibujamos octaedros como una pirámide cuadrada doble de pie en una esquina (izquierda), pero para visualizar la forma octaédrica en una celosía muy compacta, es mejor pensar en el octaedro como acostado sobre una de sus caras (derecha).

Cada esfera en una celosía compacta está asociada con un sitio octaédrico, mientras que solo hay la mitad de sitios tetraédricos. Esto se puede ver en este diagrama que muestra el átomo central en la capa B alineado con los huecos en las capas C y A arriba y abajo.
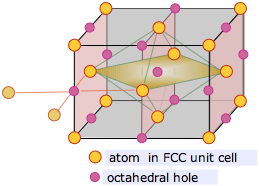
La celda unitaria cúbica centrada en la cara contiene un solo orificio octaédrico dentro de sí misma, pero los agujeros octaédricos compartidos con celdas adyacentes existen en los centros de cada borde. Cada uno de estos doce sitios ubicados en el borde se comparte con cuatro celdas adyacentes, y así contribuye (12 × ¼) = 3 átomos a la celda. Agregado al único orificio contenido en el centro de la celda, esto hace un total de 4 sitios octaédricos por celda unitaria. Esto es lo mismo que el número que calculamos anteriormente para el número de átomos en la celda.
Estructuras cúbicas comunes empaquetadas
Se puede demostrar a partir de la trigonometría elemental que un átomo encajará exactamente en un sitio octaédrico si su radio es 0.414 tan grande como el de los átomos hospedadores. La cifra correspondiente para los orificios tetraédricos más pequeños es de 0.225.
Muchos metales puros y compuestos forman estructuras cúbicas centradas en la cara (cúbicas empaquetadas). La existencia de agujeros tetraédricos y octaédricos en estas celosías presenta una oportunidad para que los átomos “extraños” ocupen algunos o todos estos sitios intersticiales. Para retener el empaquetamiento cerrado, los átomos intersticiales deben ser lo suficientemente pequeños como para encajar en estos agujeros sin interrumpir la red de CCP huésped. Cuando estos átomos son demasiado grandes, lo que suele ser el caso en los compuestos iónicos, los átomos en los sitios intersticiales separarán a los átomos hospedadores para que la red cúbica centrada en la cara se abra algo y pierda su carácter de empaquetamiento cerrado.
La estructura roca-sal
Los haluros alcalinos que cristalizan con la estructura “roca-sal” ejemplificada por el cloruro de sodio pueden considerarse como una estructura FCC de un tipo de ion en el que los orificios octaédricos están ocupados por iones de carga opuesta, o como dos redes FCC interpenetrantes compuestas por los dos tipos de iones. Los dos octaedros sombreados ilustran la coordinación idéntica de los dos tipos de iones; cada átomo o ion de un tipo dado está rodeado por seis del tipo opuesto, resultando en una coordinación expresada como (6:6).
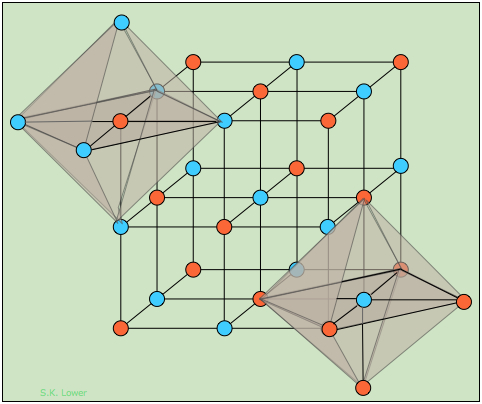
¿Cuántas unidades de NaCl están contenidas en la celda unitaria? Si ignoramos los átomos que se colocaron fuera de la celda para construir los octaedros, deberías poder contar catorce átomos “naranjas” y trece “azules”. Pero muchos de estos se comparten con celdas unitarias adyacentes.
Un átomo en la esquina del cubo es compartido por ocho cubos adyacentes, y así hace una contribución de 1/8 a cualquier celda. De manera similar, el centro de un borde es común a otras cuatro células, y un átomo centrado en una cara se comparte con dos celdas. Tomando todo esto en consideración, debería poder confirmar el siguiente recuento que demuestre que hay cuatro unidades AB en una celda unitaria de este tipo.
| Naranja | Azul |
|---|---|
| 8 en esquinas: 8 x 1/8 = 1 | 12 en centros de borde: 12 x ¼ = 3 |
| 6 en centros faciales: 6 x ½ = 3 | 1 en el centro del cuerpo = 1 |
| total: 4 | total: 4 |
Si tomamos en consideración los tamaños reales de los iones (Na + = 116pm, Cl — = 167pm), es evidente que ninguno de los iones encajará en los agujeros octaédricos con una red CCP compuesta por el otro ion, por lo que la estructura real del NaCl se expande algo más allá del modelo de empaquetamiento cerrado.
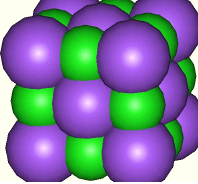
El modelo de relleno de espacio a la derecha representa una celda unitaria cúbica centrada en la cara de iones cloruro (púrpura), con los iones sodio (verdes) ocupando los sitios octaédricos.
La estructura zinc-blenda: usando algunos agujeros tetraédricos
Dado que hay dos sitios tetraédricos por cada átomo en una red compacta, podemos tener compuestos binarios de estequiometría 1:1 o 1:2 dependiendo de si la mitad o la totalidad de los agujeros tetraédricos están ocupados. Zinc-blenda es el nombre mineralógico para sulfuro de zinc, ZnS. Una forma impura conocida como esfalerita es el mineral principal del que se obtiene el zinc.
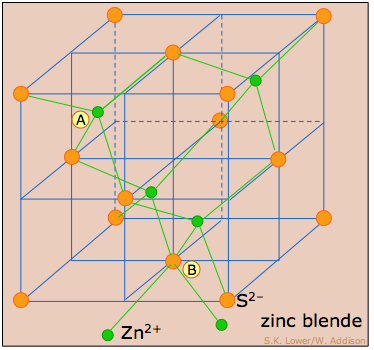
Esta estructura consiste esencialmente en una red FCC (CCP) de átomos de azufre (naranja) (equivalente a la red de iones cloruro en NaCl) en la que los iones zinc (verdes) ocupan la mitad de los sitios tetraédricos. Al igual que con cualquier red de FCC, hay cuatro átomos de azufre por celda unitaria, y los cuatro átomos de zinc están totalmente contenidos en la celda unitaria. Cada átomo en esta estructura tiene cuatro vecinos más cercanos, y así se coordina tetraédricamente.
Es interesante señalar que si todos los átomos son reemplazados por carbono, esto correspondería a la estructura diamantada.
La estructura de la fluorita: todos los sitios tetraédricos ocupados
Fluorita, CaF 2, que tiene el doble de iones de fluoruro que de calcio, hace uso de los ocho agujeros tetraédricos en la red de CPP de iones de calcio (naranja) representados aquí. Para ayudarte a entender esta estructura, hemos mostrado algunos de los sitios octaédricos en la siguiente celda de la derecha; puedes ver que el ion calcio en A está rodeado por ocho iones fluoruro, y este es, por supuesto, el caso de todos los sitios de calcio. Dado que cada ion fluoruro tiene cuatro iones de calcio más cercanos, la coordinación en esta estructura se describe como (8:4).
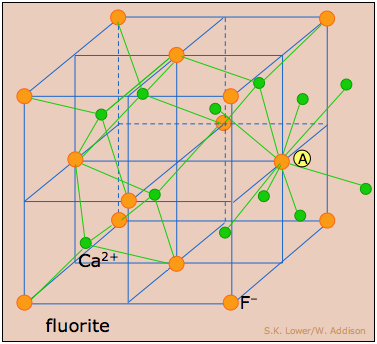
Aunque los radios de los dos iones (F — = 117pm, Ca 2 + = 126pm no permiten un verdadero empaquetamiento cercano, son lo suficientemente similares como para que se pueda describir la estructura como una red FCC de iones fluoruro con iones calcio en los agujeros octaédricos.
Estructuras cúbicas simples y centradas en el cuerpo
En la Sección 4 vimos que la única celosía cúbica que puede permitir un empaque cercano es la estructura cúbica centrada en la cara. El más simple de los tres tipos de celosía cúbica, la celosía cúbica simple, carece de las capas dispuestas hexagonalmente que se requieren para un empaque cercano. Pero como se muestra en esta vista despiezada, el espacio vacío entre las dos capas cuadradas empaquetadas de esta celda constituye un agujero octaédrico que puede acomodar otro átomo, produciendo una disposición de empaquetamiento que en casos favorables puede aproximarse a un verdadero empaquetamiento cerrado. Cada átomo B de segunda capa (azul) reside dentro de la celda unitaria definida por las capas A por encima y por debajo de ella.
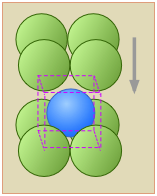
Los átomos A y B pueden ser del mismo tipo o pueden ser diferentes. Si son iguales, tenemos una celosía cúbica centrada en el cuerpo. Si son diferentes, y especialmente si son iones con carga opuesta (como en la estructura CsCl), existen restricciones de tamaño: si el átomo B es demasiado grande para encajar en el espacio intersticial, o si es tan pequeño que las capas A (que todas llevan la misma carga eléctrica) entran en contacto sin suficiente A -B atracciones coulómbicas, esta disposición estructural puede no ser estable.
La estructura del cloruro de cesio
CsCl es el modelo común para la estructura BCC. Al igual que con tantas otras estructuras que involucran dos átomos o iones diferentes, podemos considerar la misma estructura básica de diferentes maneras. Así, si miramos más allá de una sola celda unitaria, vemos que CsCl puede representarse como dos celosías cúbicas simples interpenetrantes en las que cada átomo ocupa un agujero octaédrico dentro de los cubos de la otra celosía.