7.9: Polímeros y Plásticos
- Page ID
- 70733
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente. Es especialmente importante que conozcas los significados precisos de todos los términos audaces en el contexto de este tema.
- Aparte de sus altas masas molares, ¿en qué se diferencian los polímeros sintéticos de los sólidos moleculares ordinarios?
- Los polímeros pueden clasificarse según su composición química, sus propiedades físicas y su aplicación general. Para cada una de estas tres categorías, nombra dos ejemplos que podrían considerarse al adaptar un polímero a un uso final particular.
- y un termoestable, y comentar sobre las bases moleculares por sus diferentes propiedades, incluyendo la cristalinidad.
- Describir los dos métodos generales de síntesis de polímeros.
- Nombrar dos tipos de termoplásticos sintéticos y termoestables de importancia comercial, y especificar algunos de sus principales usos.
- Nombrar dos tipos de polímeros naturales de importancia comercial.
- Describir algunas de las preocupaciones y fuentes de liberación de moléculas pequeñas a partir de polímeros.
- ¿Cuáles son algunos de los problemas relacionados con el reciclaje o reutilización de materiales poliméricos?
Los plásticos y materiales naturales como el caucho o la celulosa están compuestos por moléculas muy grandes llamadas polímeros. Los polímeros se construyen a partir de fragmentos moleculares relativamente pequeños conocidos como monómeros que se unen entre sí. La lana, el algodón, la seda, la madera y el cuero son ejemplos de polímeros naturales que se conocen y utilizan desde la antigüedad. Este grupo incluye biopolímeros como proteínas y carbohidratos que son constituyentes de todos los organismos vivos.
Los polímeros sintéticos, que incluye al gran grupo conocido como plásticos, cobraron protagonismo a principios del siglo XX. La capacidad de los químicos para diseñarlos para producir un conjunto deseado de propiedades (resistencia, rigidez, densidad, resistencia al calor, conductividad eléctrica) ha ampliado enormemente los muchos roles que desempeñan en la economía industrial moderna. Este Módulo trata principalmente de polímeros sintéticos, pero incluirá una sinopsis de algunos de los polímeros naturales más importantes. Se cerrará con un resumen de algunos de los problemas ambientales muy significativos creados por el amplio uso de plásticos.
Polímeros y “sustancias puras”
Empecemos por mirar un polímero artificial que es conocido por todos en forma de bolsas de plástico flexibles y transparentes: polietileno. También es el polímero más simple, que consiste en cadenas de longitud aleatoria (pero generalmente muy largas) compuestas por unidades de dos carbonos.
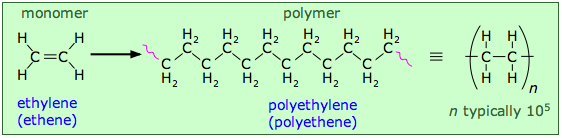
Notarás algo de “fuzziness” en la forma en que las estructuras de polietileno están representadas arriba. Las líneas onduladas en los extremos de la estructura larga indican que el mismo patrón se extiende indefinidamente. La notación más compacta de la derecha muestra la unidad de repetición mínima encerrada entre paréntesis sobreimpresa con un guión; esto significa lo mismo y es la forma preferida de representar estructuras poliméricas.
En la mayoría de las áreas de la química, una “sustancia pura” tiene una estructura definida, masa molar y propiedades. Resulta, sin embargo, que pocas sustancias poliméricas son uniformes de esta manera. Este es especialmente el caso de los polímeros sintéticos, cuyos pesos moleculares cubren un rango de valores, así como la secuencia, orientación y conectividad de los monómeros individuales. Así que la mayoría de los polímeros sintéticos son realmente mezclas en lugar de sustancias puras en el sentido químico ordinario del término. Sus pesos moleculares se distribuyen típicamente en un amplio rango.
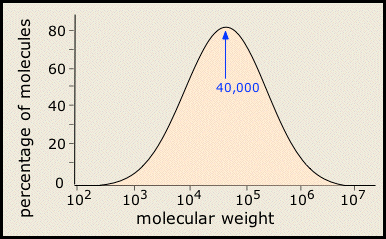
Figura\(\PageIndex{1}\): Polímeros
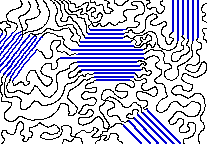
No se deje engañar por las fórmulas químicas que representan polímeros como el polietileno como cadenas razonablemente rectas de átomos de carbono sustituidos. La rotación libre alrededor de los enlaces C-C permite que las moléculas de polímero largas se enrollen y se enreden muy como los espaguetis (Figura\(\PageIndex{2}\)). Así, los polímeros generalmente forman sólidos amorfos. Sin embargo, existen formas en las que ciertos polímeros pueden orientarse parcialmente.
Clasificación de polímeros
Los polímeros se pueden clasificar de manera que reflejen su composición química, o quizás lo más importante, sus propiedades y aplicaciones. Muchos de estos factores son fuertemente interdependientes, y la mayoría se discuten con mucho más detalle en secciones posteriores de esta página.
Química
- Naturaleza de las unidades monoméricas
- Longitud media de la cadena y peso molecular
- Homopolímeros (un tipo de unidad monomérica) o copolímeros;
- Topología de cadena: cómo se conectan las unidades monoméricas
- Presencia o ausencia de ramificación cruzada
- Método de polimerización
Propiedades
- Densidad
- Propiedades térmicas: ¿pueden ablandarse o fundirse cuando se calientan?
- Grado de cristalinidad
- Propiedades físicas como dureza, resistencia, maquinabilidad.
- Solubilidad, permeabilidad a los gases
Aplicaciones
- objetos moldeados y conformados (“plásticos”)
- láminas y películas
- elastómeros (es decir, polímeros elásticos como el caucho)
- adhesivos
- recubrimientos, pinturas, tintas
- fibras e hilos
Propiedades físicas de los polímeros
Las propiedades físicas de un polímero como su resistencia y flexibilidad dependen de:
- longitud de la cadena: en general, cuanto más largas sean las cadenas, más fuerte es el polímero;
- grupos laterales: los grupos laterales polares (incluidos los que conducen a enlaces de hidrógeno) dan una atracción más fuerte entre las cadenas de polímero, haciendo que el polímero sea más fuerte;
- ramificación: las cadenas rectas y no ramificadas pueden empaquetarse más estrechamente que las cadenas altamente ramificadas, dando polímeros que tienen mayor densidad, son más cristalinos y, por lo tanto, más fuertes;
- reticulación - si las cadenas de polímero están unidas entre sí extensamente por enlaces covalentes, el polímero es más duro y más difícil de fundir.
Polímeros amorfos y cristalinos
Los enredos tipo espaguetti de las moléculas poliméricas tienden a producir sólidos amorfos, pero a menudo sucede que algunas partes pueden alinearse suficientemente para producir una región que exhibe orden cristalino, por lo que no es raro que algunos sólidos poliméricos consista en una mezcla aleatoria de amorfos y regiones cristalinas. Como cabría esperar, las cadenas poliméricas más cortas y menos ramificadas pueden organizarse más fácilmente en capas ordenadas que las cadenas largas. La unión de hidrógeno entre cadenas adyacentes también ayuda, y es muy importante en polímeros formadores de fibras tanto sintéticos (Nylon 6.6) como naturales (celulosa de algodón).
Los sólidos cristalinos puros tienen puntos de fusión definidos, pero los polímeros, si se funden, exhiben un comportamiento más complejo. A bajas temperaturas, las cadenas de polímero enredadas tienden a comportarse como vidrios rígidos. Por ejemplo, el polímero natural que llamamos caucho se vuelve duro y quebradizo cuando se enfría a temperatura de nitrógeno líquido. Muchos polímeros sintéticos permanecen en este estado muy por encima de la temperatura ambiente.
La fusión de un compuesto cristalino corresponde a una pérdida repentina de orden de largo alcance; esta es la razón fundamental por la que dichos sólidos presentan puntos de fusión definidos, y es por ello que no existe una forma intermedia entre el estado líquido y el sólido. En los sólidos amorfos no existe un orden de largo alcance, por lo que no hay punto de fusión en el sentido habitual. Dichos sólidos simplemente se vuelven cada vez menos viscosos a medida que aumenta la temperatura.
En algunos polímeros (conocidos como termoplásticos) existe un punto de reblandecimiento bastante definido que se observa cuando la energía cinética térmica llega a ser lo suficientemente alta como para permitir que se produzca una rotación interna dentro de los enlaces y permitir que las moléculas individuales se deslicen independientemente de sus vecinas, así haciéndolos más flexibles y deformables. Esto define la temperatura de transición vítrea t g.
Dependiendo del grado de cristalinidad, habrá una temperatura más alta, el punto de fusión t m, en el que las regiones cristalinas se separan y el material se convierte en un líquido viscoso. Dichos líquidos pueden inyectarse fácilmente en moldes para fabricar objetos de diversas formas, o extruirse en láminas o fibras. Otros polímeros (generalmente aquellos que están altamente reticulados) no se funden en absoluto; estos se conocen como termoestables. Si se van a convertir en objetos moldeados, la reacción de polimerización debe tener lugar dentro de los moldes, un proceso mucho más complicado. Alrededor del 20% de los polímeros producidos comercialmente son termoestables; el resto son termoplásticos.
2 Estructuras de polímeros termoplásticos
Homopolímeros y heteropolímeros
La copolimerización es una herramienta invaluable para “afinar” polímeros para que tengan la combinación correcta de propiedades para una aplicación. Por ejemplo, el poliestireno homopolimérico es un termoplástico transparente rígido y muy quebradizo con una temperatura de transición vítrea de 97°C, copolimerizándolo con acrilonitrilo produce un copolímero “SAN” alterno en el que t g se eleva a 107°, lo que lo hace útil para recipientes de bebidas transparentes.

Un polímero que está compuesto por unidades monoméricas idénticas (como es el polietileno) se llama homopolímero. Los heteropolímeros se construyen a partir de más de un tipo de monómero. Los heteropolímeros artificiales se conocen más comúnmente como copolímeros.
Topología de cadena
Los polímeros también pueden clasificarse como de cadena lineal o ramificada, dando lugar a formas tales como las siguientes:
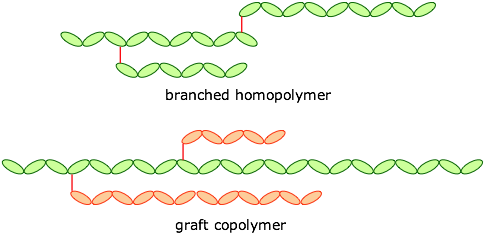
Los monómeros se pueden unir de extremo a extremo, y también se pueden reticular para proporcionar un material más duro:
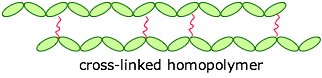
Si las reticulaciones son bastante largas y flexibles, las cadenas adyacentes pueden moverse una con respecto a la otra, produciendo un polímero o elastómero elástico
Configuración y tacticidad de la cadena
En un polímero lineal como el polietileno, las rotaciones alrededor de los enlaces simples carbono-carbono pueden permitir que las cadenas se doblen o se enrollen de varias maneras, dando como resultado la mezcla espaguetti de estas diferentes conformaciones a las que aludimos anteriormente. Pero si uno de los átomos de hidrógeno es reemplazado por alguna otra entidad como un grupo metilo, las orientaciones relativas de las unidades monoméricas individuales que conforman una sección lineal de cualquier cadena carbonada se convierten en una característica importante del polímero.
El isomerismo cis-trans ocurre porque la rotación alrededor de los dobles enlaces carbono-carbono no es posible, a diferencia del caso de los enlaces simples. Cualquier par de sustituyentes diferentes unidos a los dos carbonos se bloquea permanentemente en el mismo lado (cis) o lados opuestos (trans) del doble enlace.
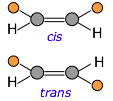
Si la cadena carbonada contiene dobles enlaces, entonces se hace posible la isomería cis-trans, dando lugar a dos configuraciones posibles diferentes (conocidas como diastereómeros) en cada unidad de la cadena. Esta variable aparentemente pequeña puede afectar profundamente la naturaleza del polímero. Por ejemplo, el látex en el caucho natural está hecho principalmente de cis - poliisopreno, mientras que el isómero trans (conocido como látex de gutapercha) tiene propiedades muy diferentes (y generalmente inferiores).
Chiralidad
La naturaleza tetraédrica del enlace de carbono tiene una consecuencia importante que no se revela por simples fórmulas estructurales bidimensionales: los átomos unidos al carbono pueden estar en un lado o en el otro, y estos no serán geométricamente equivalentes si los cuatro grupos unidos a un solo átomo de carbono son diferente. Dichos carbonos (y los grupos unidos a ellos) se dice que son quirales, y pueden existir en dos formas tridimensionales diferentes conocidas como enantiómeros.
Para un átomo de carbono individual en una cadena de polímero, dos de sus grupos unidos normalmente serán los segmentos de cadena a cada lado del carbono. Si los dos grupos restantes son diferentes (digamos uno hidrógeno y el otro metilo), entonces se cumplen las condiciones anteriores y esta parte de la cadena puede dar lugar a dos formas enantioméricas.
Una cadena que se puede representar como (en la que los círculos naranja y verde representan diferentes grupos) tendrá múltiples centros quirales, dando lugar a una gran cantidad de enantiómeros posibles. En la práctica, suele ser suficiente clasificar los polímeros quirales en las siguientes tres clases de estereorregularidad, generalmente denominadas tacticidad.
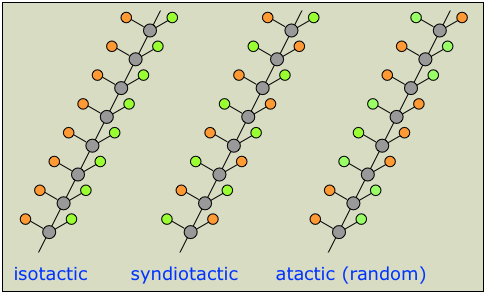
La tacticidad de una cadena de polímero puede tener una influencia importante en sus propiedades. Los polímeros atácticos, por ejemplo, al ser más desordenados, no pueden cristalizar.
Uno de los principales avances en la química de polímeros ocurrió a principios de la década de 1950 cuando el químico alemán Karl Ziegler descubrió un grupo de catalizadores que podían polimerizar etileno de manera eficiente. Casi al mismo tiempo, Giulio Natta (italiano) fabricó el primer polietileno isotáctico (y cristalino). Los catalizadores Ziegler-Natta revolucionaron la química de los polímeros al permitir controlar la estereorregularidad de estas moléculas gigantes. Ambos compartieron el Premio Nobel de Química 1963
3 Cómo se hacen los polímeros
Los polímeros se fabrican uniendo moléculas pequeñas en otras grandes. Pero la mayoría de estas moléculas monoméricas son perfectamente estables tal como son, por lo que los químicos han ideado dos métodos generales para hacerlas reaccionar entre sí, construyendo la cadena principal a medida que avanza la reacción.
Polimerización por condensación y
Este método (también conocido como crecimiento escalonado) requiere que los monómeros posean dos o más tipos de grupos funcionales que sean capaces de reaccionar entre sí de tal manera que partes de estos grupos se combinen para formar una molécula pequeña (a menudo H 2 O) que se elimina de las dos piezas. Las posiciones de unión ahora vacías en los dos monómeros pueden entonces unirse entre sí.
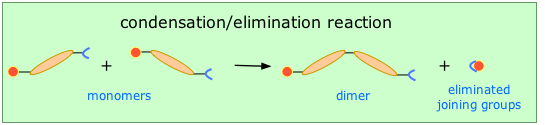
Esto ocurre, por ejemplo, en la síntesis de la familia de polímeros Nylon en la que la molécula H 2 O eliminada proviene del grupo hidroxilo del ácido y uno de los hidrógenos amino:
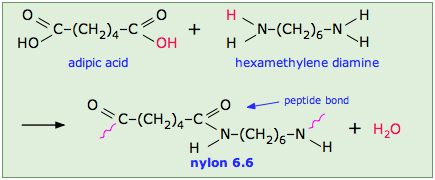
Obsérvese que las unidades monoméricas que componen el polímero no son idénticas a los componentes de partida.
Polimerización
La polimerización por adición o crecimiento de cadena implica el reordenamiento de los enlaces dentro del monómero de tal manera que los monómeros se enlazan directamente entre sí:
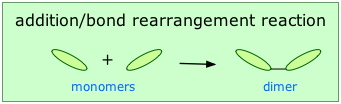
Para que esto suceda, se necesita una molécula químicamente activa (llamada iniciador) para iniciar lo que se conoce como reacción en cadena. La fabricación de polietileno es un ejemplo muy común de tal proceso. Emplea un iniciador de radicales libres que dona su electrón desapareado al monómero, lo que hace que este último sea altamente reactivo y capaz de formar un enlace con otro monómero en este sitio.
En teoría, solo se necesita llevar a cabo un proceso de iniciación de una sola cadena, y la etapa de propagación de cadena se repite indefinidamente, pero en la práctica se requieren múltiples etapas de iniciación, y eventualmente dos radicales reaccionan (terminación de cadena) para detener la polimerización.
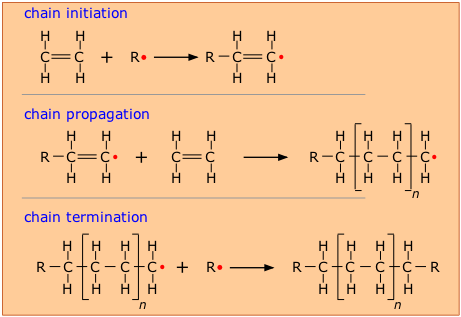
Al igual que con todas las polimerizaciones, se producen cadenas que tienen un rango de pesos moleculares, y este rango puede alterarse controlando la presión y temperatura del proceso.
4 Galería de polímeros sintéticos comunes
Termoplásticos
Nota: los paneles de la izquierda muestran el nombre y sinónimos del polímero, la fórmula estructural, la temperatura de transición vítrea, el punto de fusión/temperatura de descomposición y (en su caso) el símbolo de identificación de resina utilizado para facilitar el reciclaje.
|
Policarbonato (Lexan®) T g = 145°C, T m = 225°C. |
Este polímero fue descubierto independientemente en Alemania y Estados Unidos en 1953. Lexan es excepcionalmente duro y fuerte; lo vemos más comúnmente en forma de discos compactos. Alguna vez fue ampliamente utilizado en botellas de agua, pero la preocupación por la lixiviación del monómero sin reaccionar (bisfenol-A) ha suprimido en gran medida este mercado. |
|
Tereftalato de polietileno (PET, Mylar) T g = 76°C, T m = 250°C. |
Las películas delgadas y muy fuertes de este material se realizan extrayendo el polímero fundido en ambas direcciones, orientando así las moléculas a un estado altamente cristalino que se “bloquea” al enfriarse. Sus muchas aplicaciones incluyen el envasado de alimentos (en envases de bebidas laminadas con papel de aluminio y recipientes de alimentos congelables para microondas), películas para proyectores, globos meteorológicos y como material reflectante recubierto de aluminio en naves espaciales y otras aplicaciones. |
|
Nylon (una poliamida) T g = 50°C, T m = 255°C. |
El nylon tiene una historia fascinante, tanto científica como cultural. Fue inventado por el químico de DuPont Wallace Carothers (1896-1937). La forma común Nylon 6.6 tiene seis átomos de carbono en ambas partes de su cadena; hay varios otros tipos. Observe que las dos subunidades de copolímero se mantienen unidas por enlaces peptídicos, los mismos tipos que unen aminoácidos en proteínas. El Nylon 6.6 tiene buena resistencia a la abrasión y es autolubricante, lo que lo convierte en un buen material de ingeniería. También es ampliamente utilizado como fibra en alfombras, ropa y cordón de neumáticos. Para una interesante cuenta del desarrollo del Nylon, ver Suficiente para una vida útil: Wallace Carothers, Inventor of Nylon de Ann Gaines (1971) |
|
Poliacrilonitrilo (Orlon, Acrilan, fibra “acrílica”) T g = 85°C, T m = 318°C. |
Se usa en forma de fibras en alfombras, mantas y ropa, especialmente suéteres tipo cachemir. La tela es muy suave, pero tiende a “píldora”, es decir, produce manchas similares a pelusas. Debido a su baja temperatura de transición vítrea, requiere un tratamiento cuidadoso en la limpieza y planchado. |
|
Polietileno T g = —78°C, T m = 100°C.
|
El control de la polimerización por medio de catalizadores y aditivos ha dado lugar a una gran variedad de materiales a base de polietileno que presentan diferencias en densidades, grados de ramificación de cadena y cristalinidad, y reticulación. Algunos tipos principales son baja densidad (LDPE), baja densidad lineal (LLDPE), alta densidad (HDPE). El LDPE fue la primera forma comercial (1933) y se utiliza principalmente para “bolsas de plástico” ordinarias, pero también para envases de alimentos y en anillos de latas de refresco de seis paquetes. Su baja densidad se debe a la ramificación de cadena larga que inhibe el empaquetamiento cerrado. El LLDPE tiene menos ramificación; su mayor dureza permite su uso en esas bolsas de plástico molestas delgadas que a menudo se encuentran en los mercados de alimentos. Ahora se usa una forma de “muy baja densidad” (VLDPE) con ramificación extensa de cadena corta para envoltura elástica de plástico (reemplazando el componente original de Saran Wrap) y en tubos flexibles. El HDPE tiene principalmente cadenas rectas y, por lo tanto, es más fuerte Es ampliamente utilizado en jarras de leche y recipientes similares, contenedores de basura y como “plástico de ingeniería” para piezas de máquinas. |
|
Polimetilmetacrilato (Plexiglás, Lucite, Perpex) T g = 114°C, T m = 130-140°C. |
Este polímero transparente e incoloro es ampliamente utilizado en lugar del vidrio, donde su mayor resistencia al impacto, menor peso y maquinabilidad son ventajas. Normalmente se copolimeriza con otras sustancias para mejorar sus propiedades. Las ventanas de los aviones, las señales de plástico y los paneles de iluminación son aplicaciones muy comunes. Su compatibilidad con tejidos humanos ha dado lugar a diversas aplicaciones médicas, como lentes de reemplazo para pacientes con cataratas. |
|
Polipropileno T g = —10°C, T m = 173°C.
|
El polipropileno se usa solo o como copolímero, generalmente con etileno. Estos polímeros tienen una gama excepcionalmente amplia de usos: cuerda, cubiertas de aglutinante, botellas de plástico, hilos básicos, telas no tejidas, hervidores eléctricos. Cuando no está coloreado, es translúcido pero no transparente. Su resistencia a la fatiga lo hace útil para envases de alimentos y sus tapas, y tapas abatibles en productos embotellados como el ketchup. |
|
poliestireno T g = 95°C, T m = 240°C.
|
El poliestireno es transparente pero más bien quebradizo, y amarillos bajo luz ultravioleta. Ampliamente utilizado para materiales de empaque económicos y “bandejas para llevar”, “maní de empaque” de espuma, estuches para CD, vasos para bebidas con paredes de espuma y otras partes moldeables y de paredes delgadas. |
|
acetato de polivinilo T g = 30°C |
El PVA es demasiado blando y de bajo punto de fusión para ser utilizado por sí mismo; comúnmente se emplea como emulsión a base de agua en pinturas, pegamento para madera y otros adhesivos. |
|
cloruro de polivinilo (“vinilo”, “PVC”) T g = 85°C, T m = 240°C.
|
Este es uno de los polímeros más utilizados en el mundo. Por sí mismo es bastante rígido y se utiliza en materiales de construcción como tuberías, revestimiento de casas, pisos. La adición de plastificantes lo hacen suave y flexible para su uso en tapicería, aislamiento eléctrico, cortinas de ducha y telas impermeables. Se están haciendo algunos esfuerzos para eliminar gradualmente este polímero debido a preocupaciones ambientales (ver más adelante). |
|
Cauchos sintéticos Neopreno (policloropreno) Polibutadieno T g < —90°C |
El neopreno, inventado en 1930, fue el primer caucho sintético producido en masa. Se utiliza para cosas tales como membranas para techos y trajes húmedos. El polibutadieno sustituye a un hidrógeno por el cloro; es el componente principal (generalmente mezclado con otros cauchos) de las llantas. Los cauchos sintéticos jugaron un papel crucial en la Segunda Guerra Mundial El caucho SBS (estireno-butadieno-estireno) es un copolímero de bloques cuya durabilidad especial lo hace valorado para las bandas de los neumáticos. |
|
Politetrafluroetileno (Teflon, PTFE) Se descompone por encima de 350°C. |
Este fluorocarbono altamente cristalino es excepcionalmente inerte a los productos químicos y solventes. El agua y los aceites no lo humedecen, lo que explica su uso en utensilios de cocina y otras aplicaciones antiadherentes, incluidos los productos para el cuidado personal. Estas propiedades —no adhesión a otros materiales, no humectabilidad y muy bajo coeficiente de fricción (“deslizamiento” )— tienen su origen en la naturaleza altamente electronegativa del flúor cuyos átomos protegen parcialmente la cadena de carbono. Los electrones externos del flúor son tan fuertemente atraídos por su núcleo que están menos disponibles para participar en las interacciones de Londres (fuerza de dispersión). |
|
Poliaramida (Kevlar) Temperatura de sublimación 450°C. |
El Kevlar es conocido por su capacidad de hilarse en fibras que tienen cinco veces la resistencia a la tracción del acero. Se utilizó por primera vez en la década de 1970 para reemplazar los cables de acero para llantas. Los chalecos antibalas son uno de sus usos más coloridos, pero otras aplicaciones incluyen cascos de botes, cabezales de tambor, equipo deportivo y como reemplazo del asbesto en las pastillas de freno. A menudo se combina con fibras de carbono o vidrio en materiales compuestos. La alta resistencia a la tracción se debe en parte al extenso enlace de hidrógeno entre las cadenas adyacentes. Kevlar también tiene la distinción de haber sido inventado por una mujer química, Stephanie Kwolek. |
Termoestables
Los materiales termoplásticos descritos anteriormente son cadenas basadas en unidades monoméricas relativamente simples que tienen diversos grados de polimerización, ramificación, flexión, reticulación y cristalinidad, pero siendo cada cadena molecular una unidad discreta. En los termoestables, el concepto de unidad molecular individual se pierde en gran medida; el material se vuelve más como una gigantesca molécula extendida propia, de ahí la falta de algo como una temperatura de transición vítrea o un punto de fusión.
Estas propiedades tienen su origen en la naturaleza de los monómeros utilizados para producirlas. La característica más importante es la presencia de múltiples sitios reactivos que son capaces de formar qué cantidad de reticulaciones en cada centro. Las resinas fenólicas, tipificadas por la reacción del fenol con el formaldehído, ilustran la multiplicidad de enlaces que se pueden construir.

Resinas fenólicas
Estos se hacen condensando uno o más tipos de fenoles (anillos de benceno sustituidos con hidroxi) con formaldehído, como se ilustra anteriormente. Este fue el primer plástico sintético de moldeo comercializado. Fue desarrollado en 1907-1909 por el químico belga Leo Baekeland, de ahí el nombre común baquelita. El material marrón (generalmente abultado con polvo de madera) fue valorado por sus propiedades de aislamiento eléctrico (luminarias, enchufes y otros dispositivos de cableado) así como por artículos de consumo antes de mediados de siglo. Desde entonces, los polímeros desarrollados más recientemente han desplazado en gran medida estos usos. Los fenólicos siguen siendo ampliamente utilizados como adhesivos en la fabricación de contrachapados, y para la fabricación de pinturas y barnices.
- Resinas de urea
La condensación de formaldehído con urea produce materiales de colores más claros y menos costosos que los fenólicos. El uso principal si las resinas de urea-formaldehído es en la unión de partículas de madera en tableros de partículas. Otros usos son como recubrimientos de esmalte horneado para electrodomésticos de cocina y para recubrir fibras de algodón y rayón para impartir resistencia a las arrugas, agua y manchas a las telas terminadas.
- Resinas Melaminadas
La melamina, con aún más grupos amino (—NH 2) que la urea, reacciona con el formaldehído para formar sólidos incoloros que son más duros que las resinas de urea. Se encuentran más ampliamente en vajillas (platos de plástico, vasos y cuencos para servir) y en laminados plásticos como Formica.
- Resinas alquídico-poliéster
Un éster es el producto de la reacción de un ácido orgánico con un alcohol, por lo que los poliésteres resultan cuando los ácidos multifuncionales como el ácido ftálico reaccionan con alcoholes polihídricos como el glicerol. El término alquídico deriva de las dos palabras alc ohol y ac id.
- Las resinas alquídicas fueron elaboradas por primera vez por Berzelius en 1847, y se comercializaron por primera vez como barnices Glyptal (gly cerine + p hth al ic acid) para la industria de la pintura en 1902.
- El desarrollo posterior de otros poliésteres expandió enormemente sus usos en una amplia variedad de fibras y productos moldeados, que van desde telas de ropa y rellenos de almohadas hasta plásticos reforzados con vidrio.
- Resinas Epoxi
 Este grupo grande e industrialmente importante de resinas comienza típicamente condensando bisfenol-A con epiclorhidrina en presencia de un catalizador. (El prefijo - epi se refiere al grupo epóxido en el que un átomo de oxígeno que une dos carbonos). Estas resinas suelen combinarse con otras para producir las propiedades deseadas. Los epóxidos son especialmente valorados como pegamentos y adhesivos, ya que su fraguado no depende de la evaporación y el tiempo de fraguado se puede variar en un amplio rango. En las resinas de dos partes que se venden comúnmente para uso doméstico, la mezcla no polimerizada y el catalizador endurecedor se envasan por separado para mezclarlos justo antes de su uso. En algunas formulaciones la polimerización se inicia por calor (“termocurado”). Los empastes dentales epoxi se curan por irradiación con luz ultravioleta.
Este grupo grande e industrialmente importante de resinas comienza típicamente condensando bisfenol-A con epiclorhidrina en presencia de un catalizador. (El prefijo - epi se refiere al grupo epóxido en el que un átomo de oxígeno que une dos carbonos). Estas resinas suelen combinarse con otras para producir las propiedades deseadas. Los epóxidos son especialmente valorados como pegamentos y adhesivos, ya que su fraguado no depende de la evaporación y el tiempo de fraguado se puede variar en un amplio rango. En las resinas de dos partes que se venden comúnmente para uso doméstico, la mezcla no polimerizada y el catalizador endurecedor se envasan por separado para mezclarlos justo antes de su uso. En algunas formulaciones la polimerización se inicia por calor (“termocurado”). Los empastes dentales epoxi se curan por irradiación con luz ultravioleta.
- Poliuretanos
Los isocianatos orgánicos R-NCO reaccionan con alcoholes multifuncionales para formar carbamatos poliméricos, comúnmente conocidos como poliuretanos. Su mayor uso es en espumas plásticas para aislamiento térmico y tapicería, pero un gran número de otras aplicaciones, incluyendo pinturas y barnices y ruedas de plástico utilizadas en carretillas elevadoras, carritos de compras y monopatines.
- Siliconas
- Los polisiloxanos (—Si—O—Si-) son los polímeros inorgánicos más importantes de la clase pequeña. Los polímeros de silicona comerciales generalmente contenían grupos laterales orgánicos unidos que ayudan a la reticulación. Las siliconas se pueden hacer en una amplia variedad de formas; las que tienen pesos moleculares más bajos son líquidos, mientras que los materiales más altamente polimerizados son sólidos gomosos. Estos polímeros tienen una variedad similar de aplicaciones: lubricantes, materiales de calafateo y selladores, implantes médicos, recubrimientos antiadherentes para utensilios de cocina, acondicionadores para el cabello y otros productos para el cuidado personal.
Polímeros Naturales
Los polímeros derivados de plantas han sido componentes esenciales de la existencia humana durante miles de años. En esta encuesta veremos únicamente aquellos que tienen mayores usos industriales, por lo que no estaremos discutiendo las proteínas y ácidos nucleicos muy importantes de los biopolímeros.
Polisacáridos
Los polisacáridos son polímeros de azúcares; desempeñan papeles esenciales en el almacenamiento de energía, señalización y como componentes estructurales en todos los organismos vivos. Los únicos que nos ocuparemos aquí son los compuestos de glucosa, la más importante de las hexosas de seis carbonos. La glucosa sirve como combustible principal de la mayoría de los organismos.
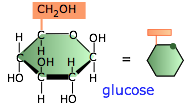
La glucosa, sin embargo, es altamente soluble y no se puede almacenar fácilmente, por lo que los organismos elaboran formas poliméricas de glucosa para reservar como almacenamiento de reserva, de las cuales se pueden extraer las moléculas de glucosa según sea necesario.
Glucógeno
En humanos y animales superiores, el polímero de reserva de almacenamiento es glucógeno. Consta de aproximadamente 60,000 unidades de glucosa en una configuración altamente ramificada. El glucógeno se produce principalmente en el hígado bajo la influencia de la hormona insulina que desencadena un proceso en el que la glucosa digerida se polimeriza y se almacena principalmente en ese órgano. Pocas horas después de una comida, el contenido de glucosa de la sangre comienza a disminuir, y el glucógeno comienza a descomponerse para mantener el nivel de glucosa requerido por el organismo.
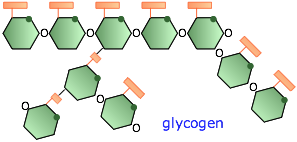
Almidón
En las plantas, estas reservas de glucosa-polímero se conocen como almidón. Los gránulos de almidón se almacenan en semillas o tubérculos para proporcionar glucosa para las necesidades energéticas de las plantas recién germinadas, y en las ramitas de plantas caducifolias para moverlas durante el invierno cuando se fotosíntesis (proceso en el que la glucosa se sintetiza a partir de CO 2 y H 2 O) no se lleva a cabo. Los almidones en los granos alimenticios como el arroz y el trigo, y en tubérculos como la papa, son una fuente nutricional importante para los humanos.
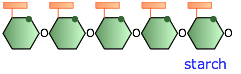
Los almidones vegetales son mezclas de dos formas principales, amilosa y amilopectina. La amilosa es un polímero en gran medida no ramificado de 500 a 20,000 moléculas de glucosa que se enrolla en una forma helicoidal que se estabiliza mediante enlaces de hidrógeno internos. La amilopectina es un polímero mucho más grande que tiene hasta dos millones de residuos de glucosa dispuestos en ramas de 20 a 30 unidades.
Celulosa y sus derivados
La celulosa es el compuesto orgánico más abundante en la tierra. Los extensos enlaces de hidrógeno entre las cadenas hacen que la celulosa nativa sea aproximadamente 70% cristalina. También eleva el punto de fusión (>280°C) por encima de su temperatura de combustión. Las estructuras del almidón y la celulosa parecen ser muy similares; en esta última, todas las demás moléculas de glucosa están “al revés”. Pero las consecuencias de esto son de gran alcance; el almidón puede disolverse en agua y puede ser digerido por animales superiores, incluidos los humanos, mientras que la celulosa es insoluble e indigestión. La celulosa sirve como componente estructural principal de las plantas verdes y (junto con la lignina) en la madera.

El algodón es una de las formas más puras de celulosa y se cultiva desde la antigüedad. Su capacidad para absorber agua (lo que aumenta su resistencia) hace que los tejidos de algodón sean especialmente útiles para la ropa en climas muy cálidos.
El algodón también sirve (junto con la pulpa de madera tratada) como fuente de producción industrial de materiales derivados de celulosa que fueron los primeros materiales “plásticos” de importancia comercial.
- La nitrocelulosa se desarrolló en la última parte del siglo XIX. Se prepara tratando el algodón con ácido nítrico, el cual reacciona con los grupos hidroxilo en la cadena de celulosa. Primero se utilizó para hacer que los objetos moldeados fueran el primer material utilizado para una base de película fotográfica por Eastman Kodak. Su extrema inflamabilidad planteaba un peligro considerable en las salas de cine, y su lenta descomposición espontánea a lo largo del tiempo había degradado seriamente muchas películas tempranas antes de ser transferidas a medios más estables. La nitrocelulosa también se utilizó como explosivo y propelente, para lo cual se le conoce como guncotton.
- El acetato de celulosa se desarrolló a principios del siglo XX y se convirtió en la primera fibra artificial que se tejió en telas que se volvieron apreciadas por su aspecto lustroso y comodidad de uso. Kodak la desarrolló como una base de “película de seguridad” en la década de 1930 para reemplazar la nitrocelulosa, pero no entró en amplio uso para este propósito hasta 1948. Unos años más tarde, se convirtió en el material base para la cinta magnética de grabación.
Viscosa es el término general para las formas “regeneradas” de celulosa hechas a partir de soluciones del polímero en ciertos solventes fuertes. Cuando se extruye en una película delgada se convierte en celofán que se ha utilizado como envoltura de alimentos desde 1912 y es la base para cintas adhesivas transparentes como Scotch Tape. Las soluciones de viscosa extruidas a través de una hilera producen fibras conocidas como rayón. El rayón (derecha) fue la primera “seda artificial” y se ha utilizado para cordón de neumáticos, ropa y alfombras. Era popular para las medias de mujer antes de que Nylon estuviera disponible para este propósito.
Caucho
Una variedad de plantas producen una savia que consiste en una dispersión coloidal de cis-poliisopreno. Este líquido lechoso es especialmente abundante en el árbol de caucho (Hevea), del que gotea cuando se hiere la corteza. Después de la recolección, el látex se coagula para obtener el caucho sólido. El caucho natural es termoplástico, con una temperatura de transición vítrea de —70°C.
cis-poliisopreno
El caucho natural crudo tiende a ser pegajoso cuando está caliente y quebradizo cuando está frío, por lo que era poco más que un material novedoso cuando se introdujo por primera vez en Europa alrededor de 1770. No se volvió generalmente útil hasta mediados del siglo XIX cuando Charles Goodyear descubrió que calentarlo con azufre —un proceso que llamó vulcanización — podría mejorar en gran medida sus propiedades.
La vulcanización crea enlaces disulfuro que evitan que las cadenas de poliisopreno se deslicen entre sí. El grado de reticulación se puede controlar para producir un caucho que tenga la elasticidad y dureza deseadas. Más recientemente, se han desarrollado otros tipos de tratamiento químico (como la epoxidación) para producir cauchos para fines especiales.
Mejores cosas para vivir mejor... a través de la química "es un famoso eslogan comercial que capturó la actitud del público hacia 1940 cuando los polímeros sintéticos comenzaban a tener un gran impacto en la vida de las personas. Lo que no se realizó en su momento, sin embargo, fueron algunos de los problemas que estos materiales crearían a medida que sus usos se multiplicaran y el mundo se volvía más cauteloso con los “químicos”. (DuPont dejó caer la parte “a través de la química” en 1982.)
Liberación de moléculas pequeñas
Muchos tipos de polímeros contienen moléculas pequeñas, ya sea monómeros sin reaccionar o sustancias específicamente agregadas (plastificantes, absorbentes de UV, retardantes de llama, etc.) para modificar sus propiedades. Muchas de estas moléculas más pequeñas son capaces de difundirse a través del material y ser liberadas en cualquier líquido o aire en contacto con el plástico, y eventualmente en el medio acuático. Aquellos que se utilizan para materiales de construcción (en casas móviles, por ejemplo) pueden acumularse en ambientes cerrados y contribuir a la contaminación del aire interior.
Monómero residual
La formación de cadenas poliméricas largas es un proceso complicado y algo aleatorio que nunca es perfectamente estequiométrico. Por lo tanto, no es raro que algún monómero sin reaccionar permanezca en el producto terminado. Algunos de estos monómeros, como el formaldehído, el estireno (de poliestireno, incluidos los recipientes de comida para llevar de espuma de poliestireno), el cloruro de vinilo y el bisfenol-A (a partir de policarbonatos) son carcinógenos conocidos. Si bien hay poca evidencia de que las pequeñas cantidades que se difunden al aire o se filtran hacia los fluidos representan un riesgo cuantificable para la salud, la gente es comprensiblemente reacia a tolerar estas exposiciones, y la política pública poco a poco comienza a regularlas.
El ácido perfluorooctanoico (PFOA), el monómero del que se elabora el teflón, ha sido objeto de una demanda de 2004 contra una fábrica de DuPont que contaminó las aguas subterráneas. Se han detectado pequeñas cantidades de PFOA en las emisiones gaseosas de productos de fluorocarbono calientes.
Plastificantes
Estas sustancias se componen en ciertos tipos de plásticos para hacerlos más flexibles al disminuir la temperatura de transición vítrea. Logran esto ocupando espacio entre las cadenas de polímero y actuando como lubricantes para permitir que las cadenas se deslicen más fácilmente entre sí. Muchos (pero no todos) son lo suficientemente pequeños como para ser difusibles y una fuente potencial de problemas de salud.
Los polímeros de cloruro de polivinilo son uno de los tipos más plastificados, y los olores asociados a menudo con materiales vinílicos flexibles como mangueras de jardín, camas de agua, cortinas de ducha baratas, impermeables y tapicería son testimonio de su capacidad para migrar al medio ambiente.
El conocido “olor a auto nuevo” se debe en gran parte a la liberación de plastificante de la tapicería y el borde interno.
Ahora hay un movimiento activo para desarrollar plastificantes no difusibles y “verdes” que no presenten estos peligros.
Interruptores endocrinos
Para complicar aún más las cosas, se ha encontrado que muchas de estas pequeñas moléculas son fisiológicamente activas debido a su capacidad para imitar la acción de hormonas u otras moléculas de señalización, probablemente encajando y uniéndose a los sitios receptores especializados presentes en muchos tejidos. La evidencia de que muchos de estos químicos son capaces de actuar de esta manera a nivel celular es bastante clara, pero aún existe cierta disputa si muchos de estos plantean riesgos reales para la salud de los humanos adultos en las concentraciones relativamente bajas en las que comúnmente ocurren en el ambiente.
Sin embargo, existe cierta preocupación por los efectos de estas sustancias en los no adultos y especialmente en los fetos, dado que los endocrinos están íntimamente relacionados con la diferenciación sexual y el desarrollo neurológico que continúa hasta finales de la adolescencia.
Productos de descomposición
Los polímeros más utilizados no son fácilmente biodegradables, particularmente bajo las condiciones anaeróbicas de la mayoría de los vertederos. Y lo que sí se produzca la descomposición se combinará con el agua de lluvia para formar lixiviados que puedan contaminar arroyos cercanos y suministros de agua subterránea. La fotodescomposición parcial, iniciada por la exposición a la luz solar, es un destino más probable a largo plazo para los plásticos expuestos, lo que resulta en pequeños fragmentos fragmentados. Muchos de estos materiales son menos densos que el agua de mar, y una vez que ingresan a los océanos a través de las aguas residuales costeras o de desechos de embarcaciones marinas, tienden a permanecer allí indefinidamente.
Se sabe que la quema abierta de materiales poliméricos que contienen cloro (cloruro de polivinilo, por ejemplo) libera compuestos como las dioxinas que persisten en el ambiente. La incineración en las condiciones adecuadas puede eliminar efectivamente este peligro.
Los productos desechados que contienen fluorocarbonos (artículos recubiertos de teflón, algunos materiales para el cuidado personal, impermeabilizantes y antiadherentes) se descomponen en sulfonato de perfluorooctano que se ha demostrado que daña a los animales acuáticos.
Peligros para los animales
Existen dos tipos generales de peligros que los polímeros pueden introducir en el medio acuático. Uno de estos se refiere a la liberación de moléculas pequeñas que actúan como disruptores hormonales como se describió anteriormente. Está bien establecido que los pequeños animales acuáticos como los peces están siendo seriamente afectados por tales sustancias en muchos ríos y sistemas estuarinos, pero no se han identificado detalles de las fuentes e identidades de estas moléculas. Un factor de confusión es la liberación de aguas residuales que contienen drogas anticonceptivas humanas (que tienen un efecto feminizador en el desarrollo sexual) en muchas vías fluviales.
El otro peligro se relaciona con los trozos de desechos plásticos que los animales acuáticos confunden con la comida o se enredan en ellos.
Esta bolsa de plástico (probablemente confundida con una medusa, el único alimento de la tortuga marina) no puede regurgitarse y provoca un bloqueo intestinal y una muerte lenta. |
 Restos de un albatros que confundieron trozos de basura plástica con comida |
Estos peligros ocurren en todo el océano, pero se acentúan mucho en regiones conocidas como giras. Se trata de regiones del océano en las que una combinación de corrientes oceánicas impulsa vórtices permanentes que tienden a recolectar y concentrar materiales flotantes. Los más notorios de estos son los Great Pacific Gyres que han acumulado cantidades asombrosas de desechos plásticos.
|
|
Reciclaje
La enorme cantidad (una estimación es de 10 8 toneladas métricas al año) de materiales plásticos producidos para uso consumidor e industrial ha creado un problema gigantesco de qué hacer con los desechos plásticos que son difíciles de incinerar de manera segura y que, al ser en gran parte no biodegradables, amenaza con abrumar la capacidad de los vertederos. Una consideración adicional es que la producción de novo la mayoría de los polímeros principales consume recursos de hidrocarburos no renovables.
Las botellas de agua de plástico (izquierda) presentan un problema especial de reciclaje debido a su uso generalizado en lugares fuera de casa.
El reciclaje de plásticos se ha convertido en una industria importante, ayudada en gran medida por políticas ilustradas de manejo de basura en las principales naciones desarrolladas. Sin embargo, está plagado de algunos problemas especiales propios:
- El reciclaje solo es rentable cuando existe un mercado para el material regenerado. Dichos mercados varían con el ciclo económico (prácticamente desaparecieron durante la recesión que comenzó en 2008).
- Los costos relacionados con la energía de la recolección y transporte de residuos plásticos, y especialmente de procesarlos para su reutilización, son frecuentemente el factor decisivo para evaluar la viabilidad del reciclaje.
- La recolección de desechos plásticos de diversas fuentes y ubicaciones y su transporte a centros de procesamiento consume energía y presenta numerosos problemas operativos.
- La mayoría de los procesos de reciclaje están optimizados para clases particulares de polímeros. La diversidad de tipos de plástico requiere su separación en diferentes corrientes de desechos, lo que generalmente requiere mano de obra manual (es decir, de bajo costo). Esto a su vez fomenta el envío de estos desechos a países de bajos salarios, reduciendo así la disponibilidad de materiales reciclados en los países en los que se originaron los plásticos.
Algunos de los principales procesos de reciclaje incluyen
- Los procesos de descomposición térmica que pueden acomodar tipos mixtos de plásticos y convertirlos en fuel oil, pero los grandes insumos de energía que requieren han sido un problema.
- Se puede despolimerizar un número muy pequeño de polímeros de condensación para que los monómeros puedan recuperarse y reutilizarse.
- Los termopolímeros se pueden fundir y peletizar, pero los de tipos muy diferentes deben tratarse por separado para evitar problemas de incompatibilidad.
- Los termoestables generalmente se trituran y se utilizan como material de relleno en termopolímeros reciclados.
Para facilitar el reciclaje eficiente, se ha establecido un conjunto de siete códigos de identificación de resina (el séptimo, que no se muestra a continuación, es “otro”).

Estos códigos están estampados en el fondo de muchos contenedores de productos ampliamente distribuidos. No todas las categorías son aceptadas por todas las autoridades locales de reciclaje, por lo que los residentes necesitan ser informados sobre qué tipos deben colocarse en contenedores de reciclaje y cuáles deben combinarse con la basura ordinaria.
Reciclaje de llantas
La gran cantidad de llantas de caucho que se desechan, junto con la creciente renuencia de los vertederos a aceptarlas, ha estimulado una innovación considerable en la reutilización de este material, especialmente en la industria de la construcción.



