7.10: Coloides y sus Usos
- Page ID
- 70777
- Resumir las principales propiedades distintivas de soluciones, dispersiones coloidales y suspensiones.
- Para los diversos tipos de dispersión (emulsión, gel, sol, espuma, etc.), nombre el tipo (gas, líquido o sólido) tanto de la fase dispersa como de la fase de dispersiones.
- Describir los orígenes del movimiento browniano y cómo se puede observar.
- Describir la doble capa eléctrica que rodea muchas partículas coloidales.
- Explicar los mecanismos responsables de la estabilidad de las dispersiones coloidales liófilas y liófobas.
- Definir: surfactante, detergente, emulsionante, micela.
- Dé algunos ejemplos de cómo se pueden hacer las dispersiones coloidales.
- Explique por qué la congelación o adición de un electrolito puede resultar en la coagulación de una emulsión.
- Describir algunos de los principios relacionados con los coloides involucrados en la química de los alimentos, como la estabilización de la leche y la mayonesa, la preparación de la mantequilla y las diversas formas de cocinar los huevos.
- Describir el papel de los coloides en el tratamiento de aguas residuales.
La arena, la sal y el polvo de tiza están formados por trozos de partículas sólidas, cada una de las cuales contiene un gran número de moléculas. Por lo general, se pueden ver las partículas individuales directamente, aunque las más pequeñas pueden requerir algún aumento. En el extremo opuesto de la escala de tamaño, tenemos moléculas individuales que se disuelven en líquidos para formar soluciones homogéneas. Hay, sin embargo, un mundo vasto pero en gran parte oculto en el medio: partículas tan pequeñas que no pueden ser resueltas por un microscopio óptico, o moléculas tan grandes que comienzan a constituir una fase propia cuando están suspendidas en un líquido. Este es el mundo de los coloides que vamos a examinar en esta lección. Como verás, encontramos coloides en los alimentos que comemos, los productos de consumo que compramos... y nosotros mismos estamos construidos en gran parte de materiales coloidales.
Presentamos Coloides
Los coloides ocupan un lugar intermedio entre las suspensiones y soluciones [particuladas], tanto en términos de sus propiedades observables como del tamaño de partícula. En cierto sentido, puentean lo microscópico y lo macroscópico. Como tales, poseen algunas de las propiedades de ambos, lo que hace que la materia coloidal sea altamente adaptable a usos y funciones específicos. La ciencia coloidal es fundamental para la biología, la ciencia de los alimentos y numerosos productos de consumo.
- Las soluciones son mezclas homogéneas cuyas partículas componentes son moléculas individuales cuya dimensión más pequeña es generalmente inferior a 1 nm. Dentro de este rango de tamaño, los movimientos térmicos mantienen la homogeneidad al superar los efectos de la atracción gravitacional.
- Las dispersiones coloidales parecen ser homogéneas, y las partículas coloidales que contienen son lo suficientemente pequeñas (generalmente entre 1-1000 nm) para exhibir movimiento browniano, no se pueden separar por filtración y no se asientan fácilmente. Pero estas dispersiones son inherentemente inestables y bajo ciertas circunstancias, la mayoría de las dispersiones coloidales pueden “romperse” y “flocularán” o se asentarán.
- Las suspensiones son mezclas heterogéneas en las que las partículas suspendidas son suficientemente grandes (> 1000 nm en su dimensión más pequeña) para asentarse bajo la influencia de la gravedad o la fuerza centrífuga. Las partículas que forman suspensiones a veces se clasifican en varios rangos de tamaño.

Las partículas coloidales no necesitan caer dentro del rango de tamaño indicado en las tres dimensiones; por lo tanto, los coloides fibrosos como muchos biopolímeros pueden tener tamaños muy extendidos a lo largo de una dirección.
La naturaleza de las partículas coloidales
Para comenzar, es necesario recordar dos definiciones importantes:
- una fase se define como una región de la materia en la que la composición y las propiedades físicas son uniformes. Así, el hielo y el agua líquida, aunque dos formas de la sustancia individual H 2 O, constituyen dos fases separadas dentro de una mezcla heterogénea.
- Una solución es una mezcla homogénea de dos o más sustancias que consiste en una sola fase. (Piense en azúcar disuelto en agua).
Pero imagina que eres capaz de reducir tu visión de una solución de azúcar en el agua hasta el nivel submicroscópico en el que se pueden resolver las moléculas individuales: verías algunas regiones del espacio ocupadas por moléculas de H 2 O, otras por moléculas de azúcar, y probablemente otras en las que el azúcar y H Las moléculas de 2 O están momentáneamente unidas entre sí por enlaces de hidrógeno, sin mencionar los espacios vacíos que aparecen y desaparecen continuamente entre las moléculas a medida que se mezclan por movimientos térmicos. Al igual que con tantas definiciones simples, el concepto de homogeneidad (y por lo tanto de una solución) se descompone a medida que avanzamos de la macroescala a la escala molecular. Y es la región entre estos dos extremos la que constituye el reino del coloide.
Más pequeño es más grande
Lo que hace que las partículas coloidales sean tan especiales no es tanto sus tamaños como es la manera en que sus áreas superficiales aumentan a medida que disminuyen sus tamaños. Si tomamos una muestra de materia y la cortamos en trozos cada vez más pequeños, la superficie total aumentará muy rápidamente. Aunque la masa se conserva, el área superficial no lo es; como un sólido se corta en trozos más pequeños, se crean más superficies. Estas nuevas superficies son más pequeñas, pero hay muchas más; la relación entre el área superficial y la masa puede llegar a ser extremadamente grande.
- Considera un cubo de material que tenga una longitud de exactamente 1 cm. ¿Cuál será la superficie de este cubo?
- Ahora cortemos este cubo en cubos más pequeños haciendo 10 rebanadas en cada dirección. ¿Cuántos cubos más pequeños hará esto y cuál será la superficie total?
Solución
- Un cubo posee seis superficies cuadradas, por lo que la superficie total es de 6 × (1 cm 2) = 6 cm 2.
- Cada nuevo cubo tiene una longitud de cara de 0.10 cm, y por lo tanto una superficie de 6 × (0.1 cm 2) = 0.6 cm 2. Pero hay 10 3 de estos cubos más pequeños, por lo que la superficie total es ahora de 60 cm 2, ¡bastante más grande de lo que era originalmente!
El área de superficie total aumenta a medida que el cubo inverso de la longitud de la cara, por lo que a medida que hacemos que nuestras rebanadas sean aún más pequeñas, la superficie total crece rápidamente. En situaciones prácticas con coloides reales, ¡las áreas superficiales pueden alcanzar hectáreas (o acres) por mol!
| número de rebanadas por cara de cubo | longitud de cada cara (cm) | superficie por cara | número de cubos | superficie total |
|---|---|---|---|---|
| 0 | 1 | 1 cm 2 | 1 | 6 cm 2 |
| 10 | 0.1 | 0.01 cm 2 | 1000 | 60 cm 2 |
| 100 | 0.01 | 10 —4 cm 2 | 10 6 | 600 cm 2 |
| 1000 | 10 —3 | 10 —6 cm 2 | 10 9 | 0.6 m 2 |
| n | 1/ n | n —2 cm 2 | n 3 | 6 n cm 2 |
¿Por qué enfocamos tanta atención en la superficie? La respuesta general es que las superficies (o más generalmente, las interfaces entre fases) poseen propiedades físicas y químicas propias. En particular,
- Las superficies pueden ejercer fuerzas atractivas de van der Waals sobre otras moléculas cercanas a ellas, y así unir libremente otras partículas por adsorción
- Las interfaces entre diferentes fases suelen dar lugar a desequilibrios en la carga eléctrica que pueden hacer que interactúen con iones cercanos.
- Las superficies de muchos sólidos presentan “enlaces rotos” que son químicamente activos.
En la materia “a granel” normal, estas propiedades se nos ocultan principalmente debido a la pequeña cantidad de superficie en relación con la cantidad de materia. Pero a medida que disminuye el tamaño de partícula, los fenómenos superficiales comienzan a dominar sus propiedades. Los pequeños tamaños de los sólidos coloidales permiten que las propiedades de sus superficies dominen su comportamiento.
Dispersiones coloidales
La materia coloidal comúnmente existe en forma de fases coloidales de sólidos, líquidos o gases que se dispersan uniformemente en un medio separado (a veces llamado fase de dispersiones) que puede ser un sólido, líquido o gas. A menudo, los coloides se clasifican y se les dan nombres especiales de acuerdo con los tipos particulares de fases involucradas.
| fase dispersa | mediano | tipo de dispersión | ejemplos |
|---|---|---|---|
| gas | líquido | espuma | crema batida |
|
gas |
sólido | espuma sólida | piedra pómez 1, aerogeles 2 |
| líquido | gas | aerosol líquido | niebla, nubes |
| líquido | líquido | emulsión | leche 3, mayonesa, aderezo para ensaladas |
| líquido | sólido | gel | Jell-O, grasas lubricantes, opal 4 |
| sólido | gas | aerosol sólido | humo |
| sólido | líquido | sol | pinturas, algunas tintas, sangre |
| sólido | sólido | sol sólido | hueso, vidrio coloreado, muchas aleaciones |
Notas sobre esta tabla:
- La piedra pómez es una roca volcánica formada por la rápida despresurización y enfriamiento de la lava fundida. La repentina liberación de presión a medida que la lava es expulsada del volcán permite que los gases disueltos se expandan, produciendo pequeñas burbujas que se congelan en la matriz. La piedra pómez se distingue de otras rocas por su muy baja densidad.
- Los aerogeles son sólidos rígidos fabricados al eliminar el líquido de los geles, dejando una matriz sólida y porosa que puede tener propiedades físicas notables y útiles. Hay disponibles aerogeles a base de sílice, carbono, alúmina y otras sustancias.
- La leche es básicamente una emulsión de gotitas de grasa de mantequilla dispersadas en una solución acuosa de carbohidratos.
- El ópalo consiste en gotitas de agua líquida dispersadas en una matriz de sílice (SiO 2).
Las moléculas grandes pueden comportarse como coloides
Moléculas poliméricas muy grandes como proteínas, almidones y otros polímeros biológicos, así como muchos polímeros naturales, exhiben un comportamiento coloidal. No hay un punto claro en el que una molécula se vuelva lo suficientemente grande como para comportarse como una partícula coloidal.
¿Macroscópica o microscópica?
Las dispersiones coloidales se comportan de manera muy parecida a las soluciones, ya que parecen ser homogéneas a escala macroscópica. A menudo se dice que son microheterogéneos. La característica más importante que los distingue de otras partículas es que:
Los coloides dispersos en líquidos o gases son lo suficientemente pequeños como para no asentarse bajo la influencia de la gravedad. Esto, junto con sus pequeños tamaños que les permite pasar a través de la mayoría de los filtros, dificulta la separación de la materia coloidal de la fase en la que se dispersa.
Propiedades ópticas de las dispersiones coloidales
Las dispersiones coloidales se distinguen de las soluciones verdaderas por sus propiedades de dispersión de la luz. La naturaleza de esta dispersión depende de la relación entre el tamaño de partícula en el medio y la longitud de onda de la luz. Un haz de luz colimado que pasa a través de una solución compuesta por moléculas ordinarias (r) tiende a conservar su forma. Cuando dicho haz se dirige a través de una dispersión coloidal, se extiende (recipiente izquierdo) . →
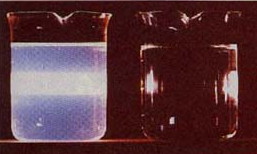

John Tyndall descubrió este efecto en 1869. La dispersión de Tyndall (como se le conoce comúnmente) dispersa todas las longitudes de onda por igual. Esto contrasta con la dispersión de Rayleigh, que dispersa más longitudes de onda más cortas, trayéndonos cielos azules y puestas de sol rojas. La dispersión de Tyndall se puede ver incluso en dispersiones que son transparentes. A medida que aumenta la densidad de las partículas (o el tamaño de partícula), la dispersión de la luz puede llegar a ser lo suficientemente grande como para producir un efecto “turbio”, como en esta imagen de una habitación llena de humo. Esta es la razón por la que la leche, la niebla y las nubes mismas parecen blancas. Las gotas de agua individuales en las nubes (o las gotas de grasa de mantequilla en la leche) son realmente transparentes, pero la luz intensa que dispersa la luz en todas direcciones, impidiendo que veamos a través de ellas.
Las partículas coloidales son, como moléculas, demasiado pequeñas para ser visibles a través de un microscopio óptico ordinario. Sin embargo, si uno mira en una dirección perpendicular al haz de luz, una partícula coloidal “aparecerá” sobre un fondo oscuro como una pequeña mota debido a la dispersión de Tyndall. Un microscopio especialmente diseñado para esta aplicación se conoce como ultramicroscopio. Hay que tener en cuenta que el ultramicroscopio (inventado en Austria en 1902) realmente no nos permite “ver” la partícula; la luz dispersa simplemente indica dónde se encuentra en un instante dado.
Movimiento browniano
Si observas una sola partícula coloidal a través del ultramicroscopio, notarás que está continuamente saltando de manera irregular. Estos movimientos se conocen como movimiento browniano. El botánico escocés Robert Brown descubrió este efecto en 1827 al observar partículas de polen flotando en el agua a través de un microscopio. (Las partículas de polen son más grandes que los coloides, pero aún son lo suficientemente pequeñas como para exhibir algo de movimiento browniano).
Cabe señalar que el análisis de Albert Einstein del movimiento browniano en 1901 constituyó la primera prueba de la teoría molecular de la materia. El movimiento browniano surge de colisiones de las moléculas líquidas con la partícula sólida. Para las partículas grandes, los millones de colisiones de diferentes direcciones se cancelan, por lo que permanecen estacionarias. Cuanto menor sea la partícula, menor será el número de moléculas circundantes capaces de chocar con ella, y más probable que ocurran fluctuaciones aleatorias en el número de colisiones desde diferentes lados. Estadísticas simples predicen que de vez en cuando, el desequilibrio en colisiones desde diferentes direcciones se volverá lo suficientemente grande como para darle una patada real a la partícula!
Propiedades Eléctricas de Coloides
En general, existen diferencias en el potencial eléctrico entre todos los límites de fase. Si has estudiado electroquímica, sabrás que dos metales diferentes en contacto exhiben un “potencial de contacto”, y que existen diferencias de potencial similares entre un metal y una solución en la que está inmerso. Pero este principio se extiende mucho más allá de la electroquímica ordinaria; hay pequeñas diferencias de potencial incluso en la interfaz del vidrio de agua en un vaso para beber, y la interfaz agua-aire por encima de él.
Los coloides no son una excepción a esta regla; siempre hay una diferencia en el potencial eléctrico entre la “fase” coloidal y la del líquido circundante. Incluso si el líquido consiste en agua pura, es probable que las moléculas polares H 2 O en la superficie del coloide estén predominantemente orientadas con sus extremos de oxígeno (negativo) o hidrógeno (positivo) orientados hacia la interfaz, dependiendo de las propiedades eléctricas de la propia partícula coloidal.

Las diferencias de potencial eléctrico interfacial pueden tener una variedad de orígenes:
- Las partículas compuestas por sustancias iónicas o ionizables suelen tener cargas superficiales debido a la adsorción de un ion (generalmente un anión) de la solución, o a la pérdida selectiva de un tipo de ion de la superficie del cristal. Por ejemplo, los iones Ag+ en la superficie de un cristal de yoduro de plata entran en solución más fácilmente que los iones Br-, dejando una superficie cargada negativamente.
- Las cargas de grupos anfipróticos como las de las superficies de óxidos e hidróxidos metálicos variarán con el pH del medio acuoso. Así, una partícula de un óxido metálico M—O se volverá positiva en solución ácida debido a la formación de M—OH +, mientras que la de un hidróxido escasamente soluble M—OH se volverá negativa a pH bajo a medida que cambie a M—O —. La molécula proteica de tamaño coloidal puede comportarse de manera similar debido al comportamiento de los grupos carboxilato, amino y sulfhidrilo anfipróticos.
- Las partículas o gotitas no iónicas como los aceites o el látex tenderán a adsorber selectivamente los iones positivos o negativos presentes en solución, por lo que se “recubren” con carga eléctrica.
- En arcillas y otras estructuras complejas, el reemplazo isomorfo de un ion por otro que tenga una carga diferente dejará una carga eléctrica neta sobre la partícula. Así, las partículas de arcilla caolinita se cargan negativamente debido a la sustitución de algunos de los iones Si 4 + por Al 3 +.
Las partículas coloidales cargadas atraerán un exceso de contraiones con carga opuesta a su vecindad de la solución a granel, formando una “nube” localizada de carga compensadora alrededor de cada partícula. Todo el conjunto se llama una doble capa eléctrica. Las capas dobles eléctricas de un tipo u otro existen en todos los límites de fase, pero las asociadas con los coloides son especialmente importantes.
Estabilidad de dispersiones coloidales
¿Qué mantiene suspendidas las partículas coloidales en el medio de dispersión? ¿Cómo podemos obligar a las partículas a asentarse? Estas son cuestiones prácticas muy importantes:
- Los productos coloidales como pinturas y muchos alimentos (por ejemplo, leche) deben permanecer dispersos si quieren ser útiles;
- Otras dispersiones, a menudo las formadas como subproductos de operaciones como la minería, el tratamiento de agua, la fabricación de papel o la combustión, son molestias ambientales. La única manera práctica de desecharlos es separar el material coloidal del volumen mucho mayor del medio de dispersión (más comúnmente agua). La evaporación simple del agua no suele ser una opción práctica; generalmente es demasiado lenta, o demasiado cara si se ve forzada por el calentamiento.
Recordarás que fuerzas atractivas débiles actúan entre materia de todo tipo. Estos son conocidos generalmente como van der Waals y fuerzas de dispersión, y solo se “afianzan” a distancias muy cercanas. Contrarrestándolos está la fuerza repulsiva universal que actúa a distancias aún más cortas, pero es mucho más fuerte; es la razón básica por la que dos átomos no pueden ocupar el mismo espacio. Para partículas muy pequeñas de tamaño atómico y molecular, otra cosa que las mantiene separadas es el movimiento térmico. Así, cuando dos moléculas en un gas chocan, lo hacen con energía cinética más que suficiente para superar las débiles fuerzas atractivas entre ellas. A medida que se reduce la temperatura del gas, también lo es la energía colisional; por debajo de su punto de ebullición, dominan las fuerzas atractivas y el gas se condensa en un líquido.
Las fuerzas eléctricas ayudan a mantener los coloides dispersos
Cuando las partículas de dimensión coloidal suspendidas en un líquido chocan entre sí, lo hacen con energías cinéticas mucho más pequeñas que en el caso de los gases, por lo que ante la ausencia de fuerzas de repulsión compensadoras, podríamos esperar que ganen a van der Waals o atracciones de dispersión. Esto daría como resultado rápidamente el crecimiento de agregados suficientemente grandes como para superar el tamaño coloidal y caer al fondo del recipiente. Este proceso se llama coagulación.

Entonces, ¿cómo logran sobrevivir las dispersiones estables como los soles? En la sección anterior, vimos que cada partícula con su doble capa es más o menos eléctricamente neutra. Sin embargo, cuando dos partículas se acercan entre sí, cada una “ve” principalmente la parte exterior [mostrada aquí en azul] de la doble capa de la otra. Estos siempre tendrán el mismo signo de carga (que depende del tipo de coloide y de la naturaleza del medio), por lo que habrá una fuerza repulsiva electrostática que se opone a las atracciones de la fuerza de dispersión.
Las fuerzas electrostáticas (coulómbicas) tienen una fuerte ventaja en este sentido porque actúan sobre distancias mucho mayores que hacen las fuerzas de van der Waals. Pero como veremos más adelante, la repulsión electrostática puede perder su efectividad si la concentración iónica del medio es demasiado grande, o si el medio se congela. Bajo estas condiciones, existen otros mecanismos que pueden estabilizar las dispersiones coloidales.
Interacciones con el disolvente
Los coloides se pueden dividir en dos clases generales de acuerdo a cómo interactúan las partículas con el medio de dispersiones (a menudo denominado el “disolvente”).
Coloides liófilos
En una clase de coloides, llamados coloides liófilos (“amantes de los solventes”), las partículas contienen grupos químicos que interactúan fuertemente con el solvente, creando una envoltura de moléculas solventes que impiden físicamente que las partículas se unan. La gelatina ordinaria es un ejemplo común de un coloide liófila. De hecho es hidrofílico, ya que forma fuertes enlaces de hidrógeno con el agua. Cuando mezclas gelatina o polvo de tapioca para hacer un postre de gelatina, el material toma agua y forma un gel coloidal estable. Los coloides liófilos (hidrófilos) son muy comunes en los sistemas biológicos y en los alimentos.
Coloides liófobos
La mayoría de los coloides en los productos manufacturados muestran muy poca atracción por el agua: piense en emulsiones de aceite o polvo de roca producido glacialmente en el agua del río. Se dice que estos coloides son liófobos. Los coloides liófobos son inherentemente inestables; eventualmente se coagularán. Sin embargo, “eventualmente” puede ser un tiempo muy largo (¡el tiempo de sedimentación de algunos coloides arcillosos en el océano es de 200-600 años!).
Para los sistemas en los que la coagulación avanza demasiado rápido, el proceso se puede ralentizar añadiendo un estabilizador. Los estabilizadores pueden actuar recubriendo las partículas con una capa protectora tal como un polímero como se describe inmediatamente a continuación, o proporcionando un ion que es selectivamente adsorbido por la partícula, rodeándola así con una vaina cargada que repelerá partículas similares con las que choca. Las dispersiones de estos coloides se estabilizan por repulsión electrostática entre las capas dobles eléctricas que rodean las partículas que discutimos en la sección anterior.
Estabilización por ocultamiento
La “estabilización por sigilo” se ha empleado inconscientemente desde la antigüedad a través del uso de gomas naturales para estabilizar partículas de pigmento en tintas, pinturas y esmaltes de cerámica. Estas gomas también son ampliamente utilizadas para estabilizar alimentos y productos de cuidado personal. Un coloide liófobo puede hacerse pasar por liófilo recubriéndolo con algo que a su vez posee propiedades liófilas adecuadas.
Estabilización estérica
Alternativamente, unir un material liófobo a un coloide de cualquier tipo puede rodear las partículas con un escudo protector que impide físicamente que las partículas se acerquen lo suficientemente cerca como para unirse entre sí. Este método usualmente emplea polímeros sintéticos y a menudo se conoce como estabilización estérica.
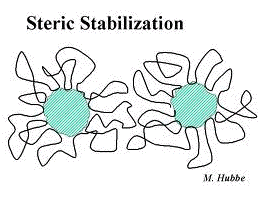
Los polímeros sintéticos, que se pueden hacer a medida para aplicaciones específicas, ahora se emplean ampliamente para ambos fines. El polímero se puede unir a la partícula central ya sea por simple adsorción o por formación de enlaces químicos.
Tensioactivos y formación de micelas
Tensioactivos y detergentes son básicamente lo mismo. Los tensioactivos que sirven como agentes de limpieza se denominan comúnmente detergentes (de L. detergere “para limpiar, limpiar”). Los tensioactivos son moléculas que consisten en una “cabeza” hidrófila conectada a una cadena hidrófoba. Debido a que tales moléculas pueden interactuar con las fases “oleosa” y acuosa, a menudo se dice que son anfifílicas. Típico de estos es el conocido detergente de limpieza dodecil sulfonato de sodio (“sulfato de laurel de sodio”) CH 3 (CH 2) 11 OSO 3 — Na +.



Las emulsiones son inherentemente inestables; dejadas solas, tienden a separarse en fases de “aceite” y “agua”. Piense en un sencillo aderezo para ensaladas hecho agitando aceite vegetal y vinagre. Cuando se emplea una molécula de tipo detergente para estabilizar una emulsión, a menudo se le denomina emulsionante. La estructura resultante (izquierda) se conoce como micela.

Los emulsionantes son componentes esenciales de muchos alimentos. Son ampliamente empleados en productos farmacéuticos, bienes de consumo como lociones y otros productos de cuidado personal, pinturas y tintas de impresión, y numerosos procesos industriales.
Cómo los detergentes eliminan la “suciedad”
La “suciedad” que estamos tratando de eliminar consiste en materiales aceitosos o grasosos cuya naturaleza hidrofóbica los hace resistentes a la acción del agua pura. Si el agua contiene moléculas anfifílicas como jabones o detergentes de limpieza que pueden incrustar sus extremos hidrófobos en las partículas, estas últimas presentarán una interfaz hidrófila con el agua y así se “solubilizarán”.

Los jabones y detergentes también pueden alterar las membranas celulares de muchos tipos de bacterias, para lo cual sirven como desinfectantes. Sin embargo, generalmente son ineficaces contra los virus, que no poseen membranas celulares.
Bilis: el detergente propio de tu cuerpo
Los aceites y grasas son componentes importantes de nuestras dietas, pero al ser insolubles en agua, son incapaces de mezclarse íntimamente con el líquido acuoso del tracto digestivo en el que se disuelven las enzimas digestivas. Con el fin de permitir que las enzimas lipasa (producidas por el páncreas) descompongan estos lípidos en sus ácidos grasos componentes, nuestros hígados producen una mezcla de surfactantes conocida como bilis. La gran superficie de las micelas en la emulsión resultante permite un contacto eficiente entre las enzimas lipasa y los materiales lipídicos.
El hígado del adulto promedio produce alrededor de 500 mL de bilis al día. La mayor parte de esto se almacena en la vesícula biliar, donde se concentra cinco veces por eliminación de agua. A medida que el material parcialmente digerido sale del estómago, la vesícula biliar aprieta la bilis hacia la parte superior del intestino delgado (el duodeno).
Además de su acción como detergente (que también ayuda en la destrucción de bacterias que pueden haber sobrevivido a la alta acidez del líquido gástrico), la naturaleza alcalina de las sales biliares neutraliza la acidez del exudado estomacal. La bilis misma consiste en sales de una variedad de ácidos biliares, todos los cuales se derivan del colesterol. La parte de la estructura similar al colesterol es hidrofóbica, mientras que el extremo cargado de la sal es hidrófilo.
Microemulsiones
Las emulsiones ordinarias son inherentemente inestables; no se forman espontáneamente, y una vez formadas, los tamaños de gota son suficientemente grandes para dispersar la luz, produciendo una apariencia lechosa. A medida que pasa el tiempo, el tamaño promedio de la gota tiende a aumentar, resultando finalmente en la separación gravitacional de las fases.
Las microemulsiones, por el contrario, son termodinámicamente estables y pueden formarse espontáneamente. Los radios de caída se encuentran en el extremo muy bajo de la escala coloidal, a menudo 100 nm o menos. Esto es demasiado pequeño para dispersar apreciablemente la luz visible, por lo que las microemulsiones parecen visualmente ser sistemas homogéneos.
Las microemulsiones requieren la presencia de uno o más surfactantes que incrementan la flexibilidad y estabilidad de las regiones limítrofes. Esto les permite variar de micelas más pequeñas de lo que normalmente permitirían las fuerzas de tensión superficial; en algunos casos pueden formar mezclas bicontinuas tipo esponja en las que las fases “aceite” y “agua” se extienden por toda la mezcla, proporcionando más área de contacto entre las fases.
Los usos de las microemulsiones son bastante amplios, siendo especialmente prominentes la administración de fármacos, la síntesis de polímeros, la síntesis asistida por enzimas, los recubrimientos y la recuperación mejorada de petróleo.
4 Hacer y romper dispersiones coloidales
Las partículas de tamaño coloidal se pueden hacer de dos maneras generales:
- Comience con partículas más grandes y descompárelas en otras más pequeñas (Dispersión).
- Construir partículas de tamaño molecular (átomos, iones o moléculas pequeñas) en agregados dentro del rango de tamaño coloidal. (Condensación)
Todos los procesos de dispersión requieren un aporte de energía a medida que se crean nuevas superficies. Para las partículas sólidas, esto generalmente se logra mediante algún tipo de proceso de molienda, como en un molino de bolas o rodillos. Los sólidos y líquidos también se pueden romper en dimensiones coloidales inyectándolos en el estrecho espacio entre un eje que gira rápidamente y su recinto, sometiéndolos así a una fuerte fuerza de cizallamiento que tiende a tirar de los dos lados de una partícula en direcciones opuestas.
La aplicación de ultrasonido (a aproximadamente 20 kHz) a una mezcla de dos líquidos inmiscibles puede crear dispersiones líquido-en-líquido; el proceso es comparable a lo que hacemos cuando agitamos un aderezo de ensalada de vinagre y aceite para crear una distribución más uniforme de los dos líquidos.
Condensación
Existen numerosos métodos para construir partículas coloidales a partir de entidades subcoloidales.
\[S_2O_3^{2–} + H_2O \rightarrow S + SO_4^{2–} + 2 H^+ + 2 e^– \]
\[2 Fe^{3+} + 3 H_2O \rightarrow Fe_2O_3 + 6 H^+\]
\[Fe^{3+} + 2 H_2O \rightarrow FeO(OH) + 3 H^+\]
- Disolución seguida de precipitación
- Este método es útil para dispersar sustancias orgánicas hidrófobas en agua. Por ejemplo, una muestra de cera de parafina se disuelve en etanol, y la solución resultante se agrega cuidadosamente a un recipiente de agua hirviendo.
- Formación de precipitados bajo condiciones controladas
- El truco aquí es evitar que las partículas coloidales iniciales del compuesto recién formado se coalescen en un precipitado ordinario, como ocurrirá normalmente cuando las soluciones de dos sales disueltas se combinen directamente. Una alternativa que a veces es útil es formar el sol mediante un proceso químico que avanza más lentamente que la precipitación directa:
-
- Los soles de azufre se forman fácilmente por oxidación de iones tiosulfato en solución ácida:
- Los soles de óxidos u óxidos hidratados de metales de transición a menudo se pueden formar hirviendo una sal soluble en agua en condiciones ligeramente ácidas para evitar la formación de hidróxidos insolubles:
- La adición de un dispersante (generalmente un surfactante) a veces puede evitar que las partículas coloidales precipiten. Así, los soles de sulfato de bario se pueden preparar a partir de tiocianato de bario y (NH 4) 2 SO 4 en presencia de citrato de potasio.
- Los sólidos iónicos a menudo pueden adsorber selectivamente cationes o aniones de soluciones que contienen los mismos tipos de iones que están presentes en la red cristalina, recubriendo así las partículas con cargas eléctricas protectoras. Esto es probablemente lo que sucede en el ejemplo de hidrólisis de iones Fe 3 + dado anteriormente.
- De manera similar, si se agrega una solución de AgnO 3 a una solución diluida de yoduro de potasio, el AgI se formará como un sol cargado negativamente (AgI) ·I —. Pero si el AgI se precipita añadiendo KI a una solución de AgnO 3, el exceso de Ag + se adsorberá a las nuevas partículas, dando un sol cargado positivamente de (AgI) ·Ag +.
Cómo se rompen las dispersiones
Ese aderezo de ensalada de aceite en vinagre que serviste en la cena el otro día ahora se ha separado principalmente en dos capas, con globos antiestéticos de una fase flotando en la otra. ¡Esto es química superficial en acción! Las emulsiones son fundamentalmente inestables porque las moléculas cercanas a las superficies (es decir, las interfaces entre fases) ya no están rodeadas por su propia clase en todos los lados. Las repulsiones resultantes entre similares y diferentes exactamente un costo energético que eventualmente debe ser reembolsado a través de procesos que reducen el área interfacial.
La consecuente ruptura de la emulsión puede proceder a través de varias etapas:

- Coalescencia: las gotas más pequeñas se unen para formar otras más grandes;
- Floculación: las pequeñas gotas se pegan juntas sin fusionarse completamente;
- Creamin g - La mayoría de los aceites tienen densidades más bajas que el agua, por lo que las gotas flotan hacia la superficie, pero pueden no fusionarse completamente;
- Rompiendo - el destino termodinámico definitivo y el resultado final de los pasos anteriores.
El tiempo requerido para que estos procesos se lleven a cabo es muy variable, y se puede extender por la presencia de sustancias estabilizantes. Así, la leche, una emulsión de grasa de mantequilla en agua, es estabilizada por algunos de sus componentes naturales.
Coagulación y floculación
Los procesos descritos anteriormente que permiten que los coloides permanezcan suspendidos a veces fallan cuando las condiciones cambian, o igualmente problemáticos, funcionan completamente demasiado bien y hacen imposible separar las partículas coloidales del medio; esto es un problema especialmente grave en las cuencas de sedimentación de aguas residuales asociados con el tratamiento de aguas residuales y operaciones como la minería y las industrias de pulpa y papel.
Coagulación es el término general que se refiere a la “ruptura” de las dispersiones para que las partículas coloidales puedan ser recolectadas, generalmente por sedimentación. El término Floculación se utiliza a menudo como sinónimo de coagulación, pero se reserva más adecuadamente para un método especial de efectuar la coagulación que se describe más adelante. La mayoría de los procesos de coagulación actúan alterando la parte externa (difusa) de la doble capa eléctrica que da lugar a la repulsión electrostática entre ellos.
“No congelar”
¿Alguna vez te has encontrado con leche que previamente había sido congelada? ¡No es probable que sea algo que quieras beber! Verá etiquetas de “No congele” en muchos alimentos y en productos coloidales de consumo como la pintura de látex para la casa. La congelación interrumpe la doble capa al hacer que los iones dentro de ella se combinen en especies neutras para que las partículas ahora puedan acercarse lo suficientemente cerca como para que las fuerzas atractivas se apoderen, y una vez que lo hacen, nunca se sueltan: ¡la coagulación es definitivamente un proceso irreversible!
Adición de un electrolito
La coagulación de las dispersiones suspendidas en agua se puede lograr elevando la concentración iónica del medio. Los iones agregados migrarán a las regiones de carga opuesta de la doble capa, neutralizando así sus cargas; esto efectivamente reduce el grosor de la doble capa, permitiendo finalmente que prevalezcan las fuerzas atractivas.
 Los ríos transportan millones de toneladas de arcilla coloidal a los océanos. Si vuelas sobre la desembocadura de un río como el Mississippi (se muestra aquí en una imagen de satélite), a veces puedes ver la diferencia de color ya que los coloides arcillosos se coagulan debido a la acción del agua salada.
Los ríos transportan millones de toneladas de arcilla coloidal a los océanos. Si vuelas sobre la desembocadura de un río como el Mississippi (se muestra aquí en una imagen de satélite), a veces puedes ver la diferencia de color ya que los coloides arcillosos se coagulan debido a la acción del agua salada.
La arcilla coagulada se acumula como sedimentos que eventualmente forman una característica geográfica llamada delta del río.
5 Geles
Una fase líquida dispersa en un medio sólido se conoce como gel, pero esta definición formal no siempre transmite el sentido pleno de la naturaleza del “sólido”. Este último puede comenzar como un material pulverulento o granulado como la gelatina natural o un polímero hidrófilo, pero una vez que se ha formado el gel, la parte “sólida” es menos una “fase” que una red reticulada que se extiende por todo el volumen del líquido, cuya cantidad define en gran medida el volumen de todo el gel.
Los hidrogeles pueden contener hasta 90% de agua en peso
La mayoría de los geles que comúnmente encontramos tienen agua como fase líquida, y así se llaman hidrogeles; los desiertos de gelatina ordinarios son ejemplos bien conocidos.
Los componentes “sólidos” de los hidrogeles suelen ser materiales poliméricos que tienen una abundancia de grupos hidrófilos como el hidroxilo (-OH) que se unen fácilmente al agua y también entre sí, creando una red irregular, flexible y muy extensible. Estos polímeros a veces se sintetizan para este propósito, pero se forman más comúnmente procesando materiales naturales, incluyendo polímeros naturales como la celulosa.
- La gelatina es un material similar a la proteína hecho al descomponer los tejidos conectivos de las pieles, órganos y huesos de animales. Los muchos grupos polares en los fragmentos de proteína resultantes los unen, junto con moléculas de agua, para formar un gel.
- Una serie de los llamados polímeros superabsorbentes derivados de celulosa, alcohol polivinílico y otros materiales pueden absorber grandes cantidades de agua, y han encontrado usos para productos tales como pañales desechables, control de derrames ambientales, medios de retención de agua para plantas, almohadillas quirúrgicas y apósitos para heridas, y recubrimientos internos protectores y bloqueadores de agua en fibra óptica y cables eléctricos.
Los geles son componentes esenciales de una gran variedad de productos de consumo que van desde agentes espesantes en alimentos y productos de cuidado personal hasta agentes amortiguadores en zapatillas para correr.
¡Los geles pueden ser frágiles!
Es posible que hayas notado que un recipiente recién abierto de yogur o crema agria parece ser suave y firme, pero una vez que se ha sacado parte del material, aparecen pequeños charcos de líquido en las depresiones ahuecadas.
A medida que la cuchara se sumerge en el material, tira de las capas cercanas del gel junto con ella, creando una acción de cizallamiento que la rompe, liberando el líquido. Cualquiera que haya atacado una yema de huevo con un batidor de cocinero, escrito con un bolígrafo, o extendido pintura de látex en una pared ha hecho uso de este fenómeno que se conoce como adelgazamiento por cizalladura.
Nuestros cuerpos son en su mayoría geles
El interior (el citoplasma) de cada célula en los tejidos blandos de nuestro cuerpo consiste en una variedad de inclusiones (orgánulos) suspendidas en una fase líquida gelatinosa llamada citosol. En el citosol se encuentran disueltos una variedad de iones y moléculas que varían de los pequeños a los grandes; entre estos últimos, las proteínas y los carbohidratos conforman la porción “sólida” de la estructura del gel.
Dentro del citosol está incrustado el citoesqueleto filamentoso que controla la forma general de la célula y mantiene los orgánulos en su lugar.
(En las células de vida libre como la ameba, los cambios en el citoesqueleto permiten que el organismo altere su forma y se mueva para engullir las partículas de los alimentos).
Agradece los geles que hay en tu cuerpo; sin ellos, serías poco más que una bolsa de líquido lleno de pistola, ¡probablemente acabará como un charco en el suelo!
Las células individuales están unidas a los tejidos por la matriz extracelular (ECM) que, a una escala mucho mayor, nos mantiene unidos y confiere una estructura y forma generales al cuerpo. El ECM está hecho de una variedad de fibras estructurales (colágenos, elastinas) incrustadas en una matriz similar a un gel.
6 Aplicaciones de coloides
Agentes espesantes
La utilidad de muchos productos industriales y de consumo depende fuertemente de su viscosidad y propiedades de flujo. Las pastas dentales, lociones, lubricantes, recubrimientos son ejemplos comunes. La mayoría de los aditivos que confieren propiedades de flujo deseables a estos productos son de naturaleza coloidal; en muchos casos, también proporcionan estabilización y evitan la separación de fases. Desde la antigüedad, diversas gomas naturales se han empleado para tales fines, y muchas permanecen en uso hoy en día.
Más recientemente, los materiales manufacturados cuyas propiedades se pueden adaptar para aplicaciones específicas se han vuelto ampliamente disponibles. Los ejemplos son celulosa microcristalina coloidal, carboximetilcelulosa y sílice piródica.
La sílice ahumada es una forma fina (5-50 nm), en polvo de SiO 2 de densidad aparente excepcionalmente baja (tan solo 0.002 g cm —3); la superficie total de un Kg puede ser tan grande como 60 hectáreas (148 acres). Se hace rociando SiCl 4 (un líquido) en una llama. Se utiliza como relleno, para control de viscosidad y flujo, agente gelificante y como aditivo para fortalecer el concreto.
Coloides alimentarios
La mayoría de los alimentos que comemos son en gran parte de naturaleza coloidal. La función de los coloides alimentarios generalmente tiene menos que ver con el valor nutricional que la apariencia, la textura y la “sensación en la boca”. Estos dos últimos términos se refieren a las propiedades de flujo del material, como la capacidad de esparcimiento y la capacidad de “fundir” (transformar de gel a emulsión líquida) al contacto con el calor de la boca.
Productos Lácteos
La leche es básicamente una emulsión de aceites lipídicos (“grasa de mantequilla”) dispersos en agua y estabilizados por fosfolípidos y proteínas. La mayor parte del contenido proteico de la leche consiste en un grupo conocido como caseínas que se agregan en una estructura micelar compleja que está unida por unidades de fosfato de calcio.
Homogeneizador
Los estabilizadores presentes en la leche fresca mantendrán su uniformidad durante 12-24 horas, pero después de este tiempo los glóbulos de grasa de mantequilla comienzan a fusionarse y flotar hasta la parte superior (“creaming”). Para retardar este proceso, la mayor parte de la leche que se vende después de principios de la década de 1940 se somete a homogeneización en la que las partículas de aceite son forzadas a través de un espacio estrecho bajo alta presión. Esto descompone las gotas de aceite en otras mucho más pequeñas que permanecen suspendidas durante la vida útil de anaquel de la leche.
Antes de que la homogeneización se vuelva común, las botellas de leche comúnmente tenían tapas agrandadas ↑
para que fuera más fácil desnatar la crema que se separaría.
Las estructuras de crema, yogur y helado están dominadas por los agregados de caseína mencionados anteriormente.
El helado es una mezcla compleja de varios tipos de coloides:
- una emulsión (de glóbulos de grasa de mantequilla en una fase acuática altamente viscosa);
- una espuma semisólida que consiste en pequeñas burbujas de aire (100 μ) que se baten en la mezcla a medida que se congela. Sin estas burbujas, la mezcla congelada sería demasiado difícil de comer convenientemente;
- un gel en el que se dispersa una red de diminutos (50 μ) cristales de hielo en una fase acuosa semi-vítrea que contiene azúcares y macromoléculas disueltas.

Mientras que la leche es una dispersión de aceite (grasa de mantequilla) en agua, la mantequilla y la margarina tienen un arreglo “invertido” (agua en aceite). Esta transformación se logra sometiendo las gotas de grasa de mantequilla en crema a agitación violenta (batido) que obliga a las gotitas a unirse en una masa semisólida dentro de la cual se incrustan restos de la fase acuosa. La mayor parte de esta fase termina como el subproducto suero de leche.
Huevos: coloides para desayuno, almuerzo y postre
Un estudio detallado de los huevos y sus múltiples roles en la cocina puede equivaler a un mini-curso de química coloidal en sí mismo. Hay algo casi mágico en la forma en que la clara y viscosa “blanca” del huevo puede transformarse en un semisólido blanco opaco por breve calentamiento, o renderizarse en formas más intrincadas por la caza furtiva, fritura, revolver u hornear en natillas, soufflés y merengues, por no hablar de sabrosas tortillas, quiches, y delicias más exóticas como los platillos eggah (árabe) y kuku (persa) de Oriente Medio.
La clara de huevo cruda es básicamente un sol coloidal de moléculas de proteína de cadena larga, todas curvadas en formas plegadas compactas debido a los enlaces de hidrógeno entre diferentes partes de la misma molécula. Al calentarse, estos enlaces se rompen, permitiendo que las proteínas se desplieguen. Las cadenas denudadas ahora pueden enredarse y unirse entre sí, transformando el sol en un hidrogel reticulado, ahora tan denso que la luz dispersa cambia su apariencia a blanco opaco.
Lo que suceda después depende mucho de la habilidad del cocinero. La idea es expulsar suficiente del agua atrapada dentro de la red de gel para lograr la densidad deseada conservando al mismo tiempo la suficiente estructura de gel para evitar que forme una masa gomosa, como suele suceder con los huevos duros. Esto es especialmente importante cuando la estructura del huevo se va a incorporar en otros componentes de los alimentos como en los platos horneados.
La clave de todo esto es el control de la temperatura; las proteínas de clara de huevo comienzan a coagularse a 65°C y si las proteínas de la yema están presentes, la mezcla se fija muy bien a alrededor de 73°; a 80° la proteína principal (albúmina) se ha endurecido, y muy por encima de esto la red de gel colapsará en una masa sobrecocida. El límite de temperatura requerido para evitar este desastre puede elevarse agregando leche o azúcar; la parte de agua de la leche diluye las proteínas, mientras que las moléculas de azúcar se unen por hidrógeno a ellas, formando un escudo protector que mantiene separada la hebra de protones. Esto es esencial a la hora de hornear natillas, pero incorporar un poco de crema en los huevos revueltos puede ayudarles de manera similar a conservar su suavidad.
Nata batida y merengues
Las otras personalidades coloidales que los huevos pueden mostrar son espumas líquidas y sólidas. En lugar de aplicar calor para desplegar las proteínas, las “golpeamos”; la fuerza de cizallamiento de un batidor o batidor de huevos ayuda a separarlas, y las burbujas de aire que quedan atrapadas en la mezcla atraen las partes hidrófobas de las proteínas desplegadas y ayudan a mantenerlas en su lugar. El azúcar estabilizará la espuma elevando su viscosidad, pero interferirá con el plegamiento de las proteínas si se agrega antes de que la espuma esté completamente formada. El azúcar también une el agua residual durante la cocción, retardando su evaporación hasta que después de que las proteínas que no se rompen por batido puedan coagularse térmicamente.
Pinturas y tintas
Las pinturas se han utilizado desde la antigüedad tanto con fines protectores como decorativos. Consisten básicamente en partículas de pigmento dispersas en vehículo, un líquido capaz de formar una película sólida estable a medida que la pintura se “seca”.
Los primeros recubrimientos protectores se realizaron disolviendo polímeros naturales derivados de plantas (resinas) en un aceite como el de linaza. Los dobles enlaces en estos aceites tienden a oxidarse cuando se exponen al aire, lo que hace que se polimerice en una película impermeable. Los pigmentos coloidales se estabilizaron con surfactantes de origen natural como gomas de polisacárido.
Las pinturas actuales son productos de alta ingeniería especializados para recubrimientos industriales o arquitectónicos particulares y para uso marino o doméstico. Por razones ambientales, ahora se prefieren los vehículos a base de agua (“látex”).
Tintas
Las propiedades más críticas de las tintas se relacionan con sus propiedades de secado y superficie; deben ser capaces de fluir adecuadamente y adherirse a la superficie sin penetrarla, esta última es especialmente crítica cuando se imprime sobre un material poroso como el papel.
Muchas tintas consisten en tintes orgánicos disueltos en un disolvente a base de agua, y no son coloidales en absoluto. La tinta utilizada en la impresión de periódicos emplea negro de carbón coloidal dispersado en un vehículo petrolífero. La presión aplicada por la imprenta obliga al vehículo a entrar en los poros del papel, dejando la mayor parte de las partículas de pigmento en la superficie.
Las tintas empleadas en bolígrafos son geles, formulados de tal manera que la tinta solo fluirá sobre la bola y sobre el papel cuando la acción de cizallamiento de la bola (que gira a medida que se mueve a través del papel) “rompe” el gel en un líquido; el líquido resultante recubre la bola y es transferido al papel. Al igual que en la impresión convencional, las partículas de pigmento permanecen en la superficie del papel, mientras que el líquido se presiona hacia los poros y se evapora gradualmente.
Tratamiento de agua y aguas residuales
Turbideces de 5, 50 y 500 unidades. [WikiMedia]
El agua, ya sea destinada específicamente a beber, o las aguas residuales como las aguas residuales o de operaciones industriales como la fabricación de pulpa y papel (la mayoría de las cuales probablemente terminen siendo reutilizadas en otros lugares) generalmente contiene materia coloidal que no puede ser eliminada por filtros de arena ordinarios, como lo demuestra su turbidez. Incluso las aguas superficiales “prístinas” a menudo contienen sedimentos de suelo suspendidos que pueden albergar organismos infecciosos y pueden proporcionarles protección parcial de los tratamientos de desinfección estándar.
Los sulfatos de aluminio (alumbre) y de hierro (III) han sido ampliamente empleados para este propósito desde hace mucho tiempo. Los polímeros sintéticos diseñados específicamente para estas aplicaciones han entrado en uso más recientemente.
El método habitual para eliminar la turbidez es agregar un agente floculante (floculante). Estas suelen ser sales metálicas que pueden formar precipitados de hidróxido en forma de gel, a menudo con la ayuda de hidróxido de calcio agregado (cal viva) si el pH del agua debe elevarse.
Las sales floculantes neutralizan las cargas superficiales de los coloides, lo que les permite coagular; éstas son engullidas y atrapadas por fragmentos de precipitado gelatinoso, los cuales son arrastrados juntos en agregados más grandes por agitación suave hasta que se vuelven suficientemente grandes para formar flóculos que pueden separarse por sedimentación o filtración.
Coloides del suelo
Los cuatro componentes principales de los suelos son sedimentos minerales, materia orgánica, agua y aire. El agua se adsorbe principalmente a los materiales minerales y orgánicos, pero también puede compartir espacios porosos con el aire; los espacios porosos constituyen aproximadamente la mitad del volumen volumétrico del sólido típico.
Los principales componentes coloidales de los suelos son los sedimentos minerales en forma de arcillas y los materiales húmicos en la materia orgánica. Además de influir en la consistencia del suelo mediante la unión de moléculas de agua, los coloides del suelo juegan un papel esencial en el almacenamiento e intercambio de los iones minerales requeridos por las plantas.
La mayoría de los coloides del suelo están cargados negativamente, y por lo tanto atraen cationes como Ca 2 +, Mg 2 + y K + hacia las partes externas de sus capas dobles. Debido a que estos iones están ligados de manera floja, constituyen una fuente de la cual las raíces de las plantas pueden extraer estos nutrientes esenciales. Por el contrario, pueden servir como sumidero para estos mismos iones cuando se liberan después de que la planta muere.
Arcillas
Se trata de estructuras estratificadas a base de alumino-silicatos u óxidos hidratados, en su mayoría de hierro o aluminio. Cada capa está construida de dos o tres láminas de estructuras extendidas de sílice o alúmina unidas entre sí por átomos de oxígeno compartidos. Estas capas generalmente tienen una carga negativa global debido al reemplazo ocasional de un ion Si 4 + por uno de Al 3 +.
Las capas adyacentes están separadas por una región de cationes adsorbidos (para neutralizar las cargas negativas) y moléculas de agua, y así se mantienen juntas de manera relativamente floja. Son estas regiones intercaladas las que permiten que las arcillas trabajen su magia intercambiando iones tanto con el agua del suelo como con las raíces de las plantas.
Sustancias húmicas
Los principales componentes orgánicos del suelo son sustancias complejas de estructura indeterminada que presentan grupos —OH y —COOH que se disocian cada vez más a medida que aumenta el pH. Esto les permite unir e intercambiar cationes de la misma manera que se describió anteriormente.


