8.2.2A: Soluciones de Solutos Gaseosos en Solventes Gaseosos
- Page ID
- 70937
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- ¿Por qué los gases son el único estado de la materia que nunca deja de formar soluciones?
Las mezclas de gases son realmente soluciones, pero tendemos a no pensarlas de esta manera porque se mezclan libremente y sin límites a sus composiciones; decimos que los gases son miscibles en todas las proporciones.
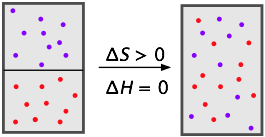
En la medida en que los gases se comportan idealmente (porque consisten principalmente en espacio vacío), su mezcla no implica cambios de energía en absoluto; la mezcla de gases es impulsada enteramente por el aumento de la entropía (S) ya que cada tipo de molécula ocupa y comparte el espacio y la energía cinética de la otra. Su nariz puede ser un instrumento notablemente sensible para detectar componentes de soluciones gaseosas, incluso a nivel de partes por millón. Las experiencias olfativas resultantes de cocinar repollo, comer espárragos y emanaciones corporales que no son mencionables en la sociedad educada son bien conocidas.
¿Pueden los sólidos o líquidos “disolverse” en un disolvente gaseoso? En un sentido muy estrecho pueden, pero sólo en muy pequeña medida. La disolución de una fase condensada de materia en un gas es formalmente equivalente a la evaporación (de un líquido) o sublimación (de un sólido), por lo que el proceso realmente equivale a la mezcla de gases.
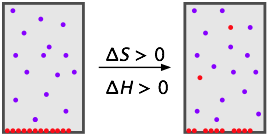
La energía requerida para eliminar moléculas de sus vecinas en un líquido o sólido y en la fase gaseosa es generalmente demasiado grande para ser compensada por la mayor entropía que disfrutan en el mayor volumen de la mezcla, por lo que los sólidos tienden a tener presiones de vapor relativamente bajas. Lo mismo ocurre con los líquidos a temperaturas muy por debajo de sus puntos de ebullición. Estos dos casos de soluciones gaseosas se pueden resumir de la siguiente manera:
| solvente gaseoso, soluto → | gas | líquido o sólido |
|---|---|---|
| energía para dispersar soluto | nulo | grande |
| energía para introducir en el gas | nulo | nulo |
| aumento de la entropía | grande | grande |
| miscibilidad | completar | muy limitado |


