8.2.2B: Soluciones de Solutos Gaseosos en Solventes Líquidos
- Page ID
- 70918
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Explicar por qué, en contraste, los gases tienden a ser solo ligeramente solubles en líquidos y sólidos. Y ¿por qué algunas combinaciones, como la disolución de amoníaco o cloruro de hidrógeno en agua, son excepciones significativas a esta regla?
- Ley de Henry estatal y explicar
- ¿Por qué los peces en ríos y arroyos a veces se asfixian (mueren de oxígeno) en climas cálidos?
Soluciones de Gases en Líquidos
Los gases se disuelven en líquidos, pero por lo general sólo en pequeña medida. Cuando un gas se disuelve en un líquido, la capacidad de las moléculas de gas para moverse libremente por todo el volumen del disolvente está muy restringida. Si este último volumen es pequeño, como suele ser el caso, el gas se está comprimiendo efectivamente. Ambos efectos equivalen a una disminución en la entropía del gas que no suele ser compensada por el incremento de entropía debido a la mezcla de los dos tipos de moléculas. Dichos procesos restringen en gran medida la solubilidad de los gases en líquidos.
| solvente líquido, soluto → | gas |
|---|---|
| energía para dispersar soluto | nulo |
| energía para introducir en solvente | mediano a grande |
| aumento de la entropía | negativo |
| miscibilidad | por lo general muy limitado |
Solubilidad de gases en agua
Una consecuencia importante de la disminución de la entropía cuando un gas se disuelve en un líquido es que la solubilidad de un gas disminuye a temperaturas más altas; esto contrasta con la mayoría de las otras situaciones, donde un aumento de la temperatura generalmente conduce a una mayor solubilidad. Llevar un líquido a su punto de ebullición eliminará completamente un soluto gaseoso. Algunas solubilidades típicas de gas, expresadas en el número de moles de gas a 1 atm de presión que se disolverán en un litro de agua a 25° C, se dan a continuación:
| soluto | fórmula | solubilidad, mol L —1 atm —1 |
|---|---|---|
| amoníaco | NH 3 | 57 |
| dióxido de carbono | CO 2 | 0.0308 |
| metano | CH 4 | 0.00129 |
| nitrógeno | N 2 | 0.000661 |
| oxígeno | O 2 | 0.00126 |
| dióxido de azufre | SO 2 | 1.25 |
Como señalamos anteriormente, los únicos gases que son fácilmente solubles en agua son aquellos cuyo carácter polar les permite interactuar fuertemente con ella.
El amoníaco es notablemente soluble en agua
La inspección de la tabla anterior revela que el amoníaco es un campeón al respecto. A 0° C, un litro de agua disolverá aproximadamente 90 g (5.3 mol) de amoníaco. La reacción del amoníaco con agua según
\[\ce{NH_3 + H_2O → NH_4^{+} + OH^{–}}\]
no hace ninguna contribución significativa a su solubilidad; el equilibrio se encuentra fuertemente en el lado izquierdo (como lo demuestra el fuerte olor de las soluciones de amoníaco). Solo alrededor de cuatro de cada 1000 moléculas NH 3 están en forma de iones de amonio en equilibrio. Esto es realmente impresionante cuando se calcula que esta cantidad de NH 3 ocuparía (5.3 mol) × (22.4 L mol —1) = 119 L en STP. Así un volumen de agua disolverá más de 100 volúmenes de este gas. Es aún más impresionante cuando te das cuenta de que para comprimir 119 L de un gas ideal en un volumen de 1 L, ¡sería necesario aplicar una presión de 119 atm! Esto, sumado a la observación de que la disolución del amoníaco va acompañada de la liberación de una cantidad considerable de calor, nos dice que la alta solubilidad del amoníaco se debe a la formación de más enlaces de hidrógeno (a H 2 O) de los que se rompen dentro de la estructura del agua para acomodar la molécula NH 3.
Si realmente comprimimos 90 g de gas NH 3 puro a 1 L, se licuará, y la presión de vapor del líquido sería de aproximadamente 9 atm. En otras palabras, la tendencia a escapar de las moléculas NH 3 de H 2 O es solo aproximadamente 1/9 de lo que es del NH 3 líquido. Una forma de interpretar esto es que las fuertes atracciones intermoleculares (dipolo-dipolo) entre NH 3 y el disolvente H 2 O dan lugar a una fuerza que tiene el efecto de una presión negativa de 9 atm.
La solubilidad de los gases disminuye con la temperatura
Recordemos que la entropía es una medida de la capacidad de la energía térmica para propagarse y ser compartida e intercambiada por moléculas en el sistema. La temperatura más alta ejerce una especie de efecto multiplicador sobre un cambio positivo de entropía al aumentar la cantidad de energía térmica disponible para compartir. ¿Alguna vez has notado las pequeñas burbujas que se forman cerca del fondo de un recipiente con agua cuando se coloca en una estufa caliente? Estas burbujas contienen aire que previamente se disolvió en el agua, pero alcanza su límite de solubilidad a medida que el agua se calienta. Puede eliminar completamente un líquido de cualquier gas disuelto (incluidos los no deseados como Cl 2 o H 2 S) hirviéndolo en un recipiente abierto.
Esto es bastante diferente del comportamiento de la mayoría (pero no todas) soluciones de solutos sólidos o líquidos en solventes líquidos. La razón de este comportamiento es el gran aumento de entropía que experimentan los gases cuando se liberan de los confines de una fase condensada.
Solubilidad de Oxígeno en Agua
El agua dulce a nivel del mar disuelve 14.6 mg de oxígeno por litro a 0°C y 8.2 mg/L a 25°C, estos niveles de saturación aseguran que los peces y otros animales acuáticos branquiales puedan extraer suficiente oxígeno para satisfacer sus necesidades respiratorias. Pero en ambientes acuáticos reales, la presencia de materia orgánica en descomposición o escorrentía nitrogenada puede reducir estos niveles muy por debajo de la saturación. La salud y supervivencia de estos organismos se ve severamente restringida cuando las concentraciones de oxígeno caen a alrededor de 5 mg/L.
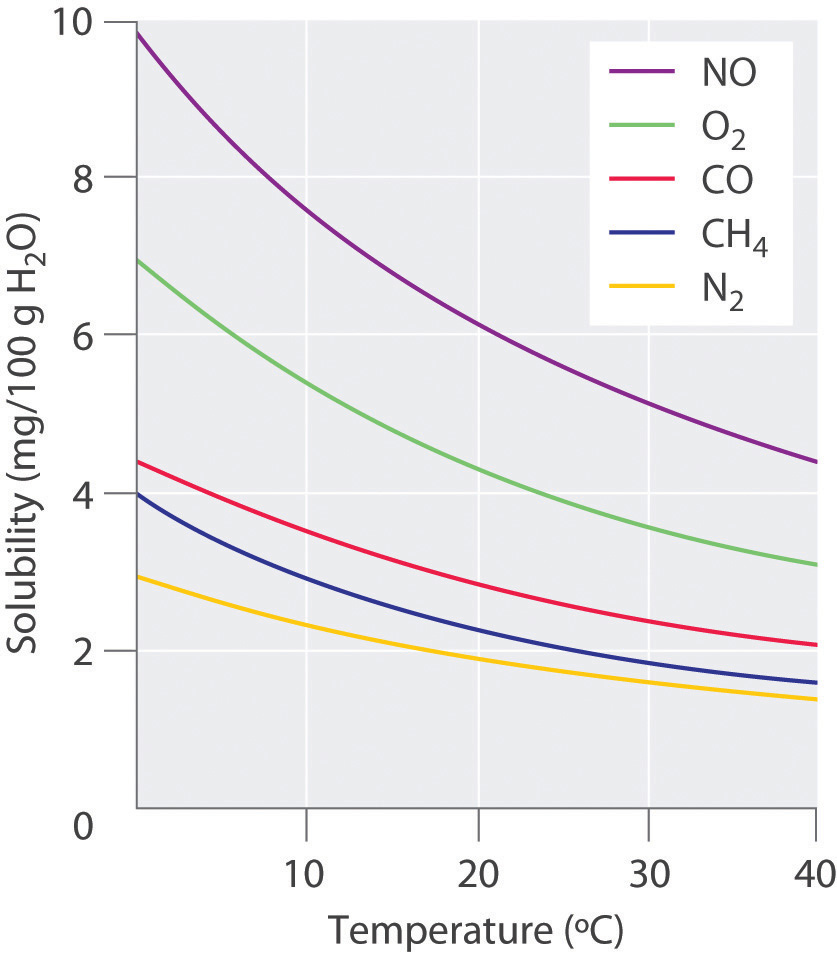
La dependencia de la temperatura de la solubilidad del oxígeno en el agua es una consideración importante para el bienestar de la vida acuática; se sabe que la contaminación térmica de las aguas naturales (debido a la afluencia de agua de refrigeración de las centrales eléctricas) reduce la concentración de oxígeno disuelto a niveles lo suficientemente bajos como para matar a los peces . El advenimiento de las temperaturas estivales en un río puede tener el mismo efecto si la concentración de oxígeno ya se ha agotado parcialmente por la reacción con contaminantes orgánicos.
La solubilidad de los gases aumenta con la presión: Ley de Henry
La presión de un gas es una medida de su “tendencia a escapar” de una fase. Por lo que es lógico que elevar la presión de un gas en contacto con un disolvente provocará que una fracción mayor del mismo “escape” a la fase disolvente. La proporcionalidad directa de la solubilidad del gas a la presión fue descubierta por William Henry (1775-1836) y se conoce como Ley de Henry. Por lo general se escribe como
\[P = k_H C \label{7b.2.1}\]
con
- \(P\)es la presión parcial del gas por encima del líquido,
- \(C\)es la concentración de gas disuelto en el líquido, y
- \(k_H\)es la constante de la ley de Henry, la cual se puede expresar en diversas unidades, y en algunos casos se define de diferentes maneras, así que tenga mucho cuidado de anotar estas unidades al usar valores publicados.
Para el Cuadro 7B.2.x, k H se da como
\[ k_H = \dfrac{\text{partial pressure of gas in atm}}{\text{concentration in liquid} \; mol \;L^{–1}}\]
| gas | Él | N 2 | O 2 | CO 2 | CH 4 | NH 3 |
|---|---|---|---|---|---|---|
| K H | 2703 | 1639 | 769 | 29.4 | 0.00129 | 57 |
Algunos vendedores de aguas embotelladas venden “agua oxigenada” presurizada que (falsamente) pretende mejorar la salud y el rendimiento deportivo al suministrar más oxígeno al cuerpo.
- ¿Cuántos moles de O 2 estarán en equilibrio con un litro de agua a 25° C cuando la presión parcial de O 2 por encima del agua sea de 2.0 atm?
- ¿Cuántos mL de aire (21% O 2 v/v) debes inhalar para introducir una cantidad equivalente de O 2 en los pulmones (donde realmente podría hacer algún bien?)
Solución:
- Resolviendo la ley de Henry para la concentración, obtenemos
\[C = \dfrac{P}{k_H} = \dfrac{2.0\; atm}{769\; L\; atm \;mol^{–1}} = 0.0026\; mol\; L^{–1}\]
- A 25° C, 0.0026 mol de O 2 ocupa (22.4 L) × (.0026 mol) × (298/273) = 0.063 L. El volumen equivalente de aire sería (0.063 L) (.21) = 0.303 L. Dado que el volumen mareante promedio del pulmón humano es de alrededor de 400 mL, esto significa que tomar un respiro extra tomaría más de O 2 que está presente en 1 L de “agua oxigenada”.
Bebidas carbonatadas: la historia de los “Fizz-ics”
El agua carbonatada artificialmente fue preparada por primera vez por Joseph Priestley (quien más tarde descubrió oxígeno) en 1767 y fue comercializada en 1783 por Joseph Schweppe, un joyero suizo-alemán. Durante mucho tiempo, las aguas de manantial carbonatadas naturalmente tienen fama de tener valores curativos, y estas se convirtieron en destinos turísticos populares en el siglo XIX. El término “agua seltzer” deriva de uno de esos manantiales en Niederselters, Alemania. Por supuesto, la carbonatación producida por la fermentación se conoce desde la antigüedad. La sensación de hormigueo que producen las bebidas carbonatadas en la boca proviene del ácido carbónico producido cuando las burbujas de dióxido de carbono entran en contacto con las membranas mucosas de la boca y la lengua:
\[CO_2 + H_2O → H_2CO_3\]


