8.3: Propiedades coligativas- Ley de Raoult
- Page ID
- 70898
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Estado la ley de Raoult en sus propias palabras, y explique por qué tiene sentido.
- ¿Qué entendemos por la tendencia a escapar de una molécula de una fase? ¿Cómo podríamos observarlo o medirlo?
- Explica por qué la elevación del punto de ebullición se deriva naturalmente de la ley de Raoult
- Explicar la depresión del punto de congelación es sin duda un poco más difícil, pero sin embargo, debería poder explicar cómo la aplicación de sal en una carretera cubierta de hielo puede hacer que el hielo se derrita.
La tendencia de las moléculas a escapar de una fase líquida a la fase gaseosa depende en parte de cuánto de un aumento en la entropía se puede lograr al hacerlo. La evaporación de las moléculas de disolvente del líquido siempre conduce a un gran aumento de la entropía debido al mayor volumen ocupado por las moléculas en estado gaseoso. Pero si el solvente líquido inicialmente se “diluye “con soluto, su entropía ya es mayor para empezar, por lo que la cantidad en la que puede aumentar al ingresar a la fase gaseosa será menor. En consecuencia, habrá menos tendencia a que las moléculas de disolvente entren en la fase gaseosa, por lo que la presión de vapor de la solución disminuye a medida que aumenta la concentración de soluto y disminuye la del disolvente.
El número 55.5 mol L —1 (= 1000 g L —1 ÷ 18 g mol —1) es útil para recordar si se trata mucho de soluciones acuosas; esto representa la concentración de agua en agua pura. (Estrictamente hablando, esta es la concentración molal de H 2 O; es solo la concentración molar a temperaturas alrededor de 4° C, donde la densidad del agua es más cercana a 1.000 g cm —1.)
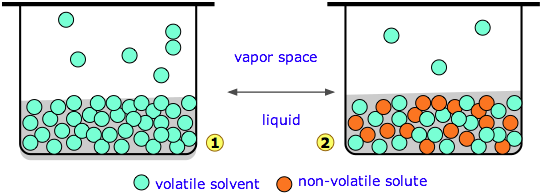
El diagrama 1 (arriba a la izquierda) representa agua pura cuya concentración en el líquido es de 55.5 M. Una pequeña fracción de las moléculas de H 2 O escapará al espacio de vapor, y si se cierra la parte superior del recipiente, la presión del vapor de agua se acumula hasta lograr el equilibrio. Una vez que esto sucede, las moléculas de agua continúan pasando entre el líquido y el vapor en ambas direcciones, pero a tasas iguales, por lo que la presión parcial de H 2 O en el vapor permanece constante en un valor conocido como la presión de vapor del agua a la temperatura particular.
En la Figura\(\PageIndex{1}\), hemos reemplazado una fracción de las moléculas de agua por una sustancia que tiene una presión de vapor cero o insignificante, un soluto no volátil como la sal o el azúcar. Esto tiene el efecto de diluir el agua, reduciendo su tendencia a escapar y por lo tanto su presión de vapor.
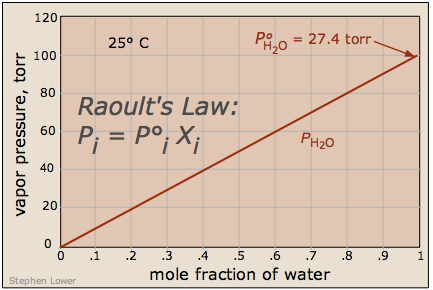
Lo que es importante recordar es que la reducción en la presión de vapor de una solución de este tipo es directamente proporcional a la fracción de las moléculas de soluto [volátiles] en el líquido, es decir, a la fracción molar del disolvente. La presión de vapor reducida viene dada por la ley de Raoult (1886):

\[\chi_{solvent} = 1–\chi_{solute}.\]
Estimar la presión de vapor de una solución al 40% (W/W) de azúcar de caña ordinaria (C 22 O 11 H 22, 342 g mol —1) en agua. La presión de vapor del agua pura a esta temperatura en particular es de 26.0 torr.
Solución
100 g de solución contienen (40 g) ÷ (342 g mol —1) = 0.12 mol de azúcar y (60 g) ÷ (18 g mol —1) = 3.3 mol de agua. La fracción molar de agua en la solución es
\[ \dfrac{3.3}{3.3 + 12} = 0.96\]
y su presión de vapor será de 0.96 × 26.0 torr = 25.1 torr.
La presión de vapor del agua a 10° C es 9.2 torr. Estimar la presión de vapor a esta temperatura de una solución preparada disolviendo 1 mol de CaCl 2 en 1 L de agua.
Solución
Cada mol de CaCl 2 se disocia en un mol de Ca 2 + y dos moles de Cl 1—, dando un total de tres moles de partículas de soluto. La fracción molar de agua en la solución será
\[ \dfrac{55.5}{3 + 55.5} = 0.95\]
La presión de vapor será de 0.95 × 9.2 torr = 8.7 torr.
Dado que la suma de todas las fracciones molares en una mezcla debe ser unidad, se deduce que cuantos más moles de soluto, menor será la fracción molar del disolvente. Además, si el soluto es una sal que se disocia en iones, entonces la proporción de moléculas de disolvente será aún menor.


