8.2.2D: Soluciones de Solutos Sólidos en Solventes Líquidos
- Page ID
- 70938
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Una clave para entender la solubilidad de los sólidos iónicos en el agua son los conceptos de energía reticular y energía de hidratación. Explique el significado de estos términos, y esboce un diagrama que muestre cómo estos se relacionan con el “calor de la solución”.
Sólidos moleculares en Solventes Líquidos
Las fuerzas intermoleculares más fuertes en los sólidos requieren más entrada de energía para dispersar las unidades moleculares en una solución líquida, pero también hay un aumento considerable en la entropía que puede compensar con creces si las fuerzas intermoleculares no son demasiado fuertes, y si el disolvente no tiene enlaces de hidrógeno fuertes que debe romperse para introducir el soluto en el líquido.
| solvente → | líquido no polar | líquido polar |
|---|---|---|
| energía para dispersar soluto | moderado | moderado |
| energía para introducir en el solvente | pequeño | moderado |
| aumento de la entropía | moderado | moderado |
| miscibilidad | moderado | pequeño |
Por ejemplo, a 25° C y 1 atm de presión, 20 g de cristales de yodo se disolverán en 100 ml de alcohol etílico, pero la misma cantidad de agua disolverá solo 0.30 g de yodo. A medida que aumenta el peso molecular del sólido, las fuerzas intermoleculares que mantienen unido al sólido también aumentan, y las solubilidades tienden a caer; así los hidrocarburos lineales sólidos CH 3 (CH 2) n CH 3 (n > 20) muestran solubilidades decrecientes en líquidos de hidrocarburos.
Sólidos iónicos en solventes líquidos
Dado que las fuerzas coulómbicas que unen iones y moléculas altamente polares en sólidos son bastante fuertes, podríamos esperar que estos sólidos sean insolubles en casi cualquier solvente. Los sólidos iónicos son insolubles en la mayoría de los solventes no acuosos, pero la alta solubilidad de algunos (incluyendo NaCl) en agua sugiere la necesidad de alguna explicación adicional.
| solvente → | no polar | polar (agua) |
|---|---|---|
| energía para dispersar soluto | grande | grande (endotérmico) |
| energía para introducir en líquido | pequeño | altamente negativo (exotérmico) |
| aumento de la entropía | moderado | moderada a ligeramente negativa |
| miscibilidad | muy pequeño | pequeño a grande |
El factor clave aquí resulta ser la interacción de los iones con el disolvente. Los iones cargados eléctricamente ejercen una fuerte atracción culombica en el extremo de la molécula de agua que tiene la carga parcial opuesta.
Como consecuencia, los iones en solución siempre están hidratados; es decir, están muy unidos a las moléculas de agua a través de la interacción ión-dipolo. El número de moléculas de agua contenidas en la capa de hidratación primaria varía con el radio y la carga del ión.
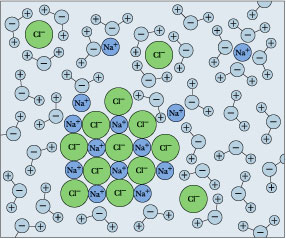
Figura\(\PageIndex{1}\): Conchas de hidratación alrededor de algunos iones en una solución de cloruro de sodio. El tiempo promedio que un ion pasa en una concha es de aproximadamente 2-4 nanosegundos. Pero esto es aproximadamente dos órdenes de magnitud más largo que la vida útil de un enlace de\(H_2O–H_2O\) hidrógeno individual.
Energías de celosía e hidratación
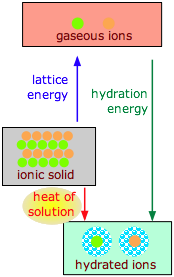
La disolución de un sólido iónico\(M\) X en agua puede considerarse como una secuencia de dos etapas (hipotéticas):
\[MX(s) \rightarrow M^+(g) + X^–(g) \]
\[M^+(g) + X^–(g) + H_2O(l) \rightarrow M^+(aq) + X–(aq)\]
La diferencia de entalpía del primer paso es la energía reticular y siempre es positiva; la diferencia de entalpía del segundo paso es la energía de hidratación y siempre es negativa)
- La primera reacción es siempre endotérmica; se necesita mucho trabajo para romper una red cristalina iónica (Tabla\(\PageIndex{1}\)).
- La etapa de hidratación es siempre exotérmica ya que las moléculas de H 2 O son atraídas hacia el campo electrostático del ion (Tabla\(\PageIndex{2}\)).
- El calor (entalpía) de la solución es la suma de las energías de celosía e hidratación, y puede tener cualquiera de las dos señales.
| H + (g) | —1075 | F — g) | —503 |
| Li + (g) | —515 | Cl — (g) | —369 |
| Na + (g) | —405 | Br — (g) | —336 |
| K + (g) | —321 | I — g) | —398 |
| Mg 2 + (g) | —1922 | OH — (g) | —460 |
| Ca 2 + (g) | —1592 | NO 3 — | —328 |
| Sr 2 + (g) | —1445 | SO 4 2— | —1145 |
Las energías de hidratación de iones únicos (Tabla\(\PageIndex{1}\)) no se pueden observar directamente, sino que se obtienen de las diferencias en las energías de hidratación de las sales que tienen el ion dado en común. Cuando te encuentras con tablas como las anteriores en las que los valores numéricos están relacionados con diferentes elementos, siempre debes detenerte y ver si puedes darle sentido a alguna tendencia obvia. En este caso, las cosas a buscar son el tamaño y la carga de los iones ya que afectarían la interacción electrostática entre dos iones o entre un ion y una molécula de agua [polar].
| F — | Cl — | Br — | I — | |
|---|---|---|---|---|
| Li + | +1031 | +848 | +803 | +759 |
| Na + | +918 | +780 | +742 | +705 |
| K + | +817 | +711 | +679 | +651 |
| Mg 2 + | +2957 | +2526 | +2440 | +2327 |
| Ca 2 + | +2630 | +2258 | +2176 | +2074 |
| Sr 2 + | +2492 | +2156 | +2075 | +1963 |
Las energías de celosía no se miden directamente, sino que son estimaciones basadas en cálculos electrostáticos que son confiables solo para sales simples. Las entalpías de solución son observables ya sea directamente o (para sales escasamente solubles) indirectamente. Las energías de hidratación no son medibles; se estiman como la suma de las otras dos cantidades. De ello se deduce que cualquier incertidumbre en las energías de celosía se refleja en las de las energías de hidratación. Por esta razón, los valores tabulados de este último variarán dependiendo de la fuente.
Cuando el cloruro de calcio, CaCl 2, se disuelve en agua, ¿subirá o bajará la temperatura inmediatamente después de la mezcla?
Solución:
Estimar el calor de solución de CaCl 2.
- energía reticular de CaCl sólido 2: +2258 kJ mol —1
- energía de hidratación de los tres iones gaseosos: (—1562 —381 — 381) = —2324 kJ mol —1
- calor de la solución:
(2258 — 2324) kJ mol —1 = —66 kJ mol —1
Dado que el proceso es exotérmico, este calor se liberará para calentar la solución.
Como suele suceder para una cantidad que es la suma de dos grandes términos que tienen signos opuestos, el proceso de disolución general puede salir como endotérmico o exotérmico, y los ejemplos de ambos tipos son comunes.
|
sustancia →
|
LiF | NaI | KBr | CSi | LiCl | NaCl | KCl | AgCl |
|---|---|---|---|---|---|---|---|---|
| energía de celosía | 1021 | 682 | 669 | 586 | 846 | 778 | 707 | 910 |
| energía de hidratación | 1017 | 686 | 649 | 552 | 884 | 774 | 690 | 844 |
| entalpía de solución | +3 | —4 | +20 | +34 | —38 | +4 | +17 | +66 |
Dos ejemplos comunes ilustran el contraste entre calores exotérmicos y endotérmicos de solución de sólidos iónicos:
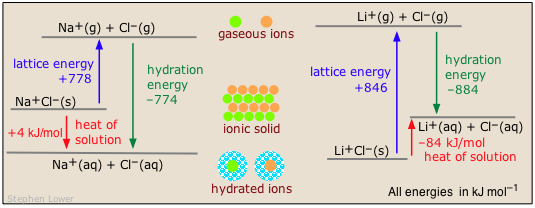
¡La entropía de hidratación puede marcar la diferencia!
Conchas de hidratación alrededor de algunos iones en una solución de cloruro de sodio. El tiempo promedio que un ion pasa en una concha es de aproximadamente 2-4 nanosegundos. Pero esto es aproximadamente dos órdenes de magnitud más largo que la vida útil de un individuo\(H_2O\) — el enlace de\(H_2O\) hidrógeno. El equilibrio entre la energía reticular y la energía de hidratación es un factor importante para determinar la solubilidad de un cristal iónico en el agua, pero también hay otro factor a considerar. Generalmente asumimos que hay un aumento bastante grande en la entropía cuando un sólido se dispersa en la fase líquida. Sin embargo, en el caso de los sólidos iónicos, cada ion termina rodeado por una capa de moléculas de agua orientadas. Estas moléculas de agua, al estar restringidas dentro de la capa de hidratación, son incapaces de participar en la propagación de la energía térmica por toda la solución, y reducen la entropía. En algunos casos este efecto predomina por lo que la disolución de la sal conduce a una disminución neta de la entropía. Recordemos que cualquier proceso en el que la entropía disminuya se vuelve menos probable a medida que aumenta la temperatura; esto explica por qué las solubilidades de algunas sales disminuyen con la temperatura.


