8.4: Propiedades coligativas - Elevación del punto de ebullición y depresión del punto de congelación
- Page ID
- 70877
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Explica por qué la elevación del punto de ebullición se deriva naturalmente de la ley de Raoult
- Explicar la depresión del punto de congelación es ciertamente un poco más difícil, pero sin embargo, debería poder explicar cómo la aplicación de sal en una carretera cubierta de hielo puede hacer que el hielo se derrita.
Las propiedades coligativas realmente dependen de la tendencia a escapar de las moléculas de disolvente de la fase líquida. Recordará que la presión de vapor es una medida directa de la tendencia a escapar, por lo que podemos usar estos términos más o menos indistintamente.
Elevación del punto de ebullición
Si la adición de un soluto no volátil disminuye la presión de vapor de la solución a través de la ley de Raoult, entonces se deduce que la temperatura debe elevarse para restaurar la presión de vapor al valor correspondiente al disolvente puro. En particular, la temperatura a la que la presión de vapor es de 1 atm será mayor que el punto de ebullición normal en una cantidad conocida como elevación del punto de ebullición. La relación exacta entre el punto de ebullición de la solución y la fracción molar del disolvente es bastante complicada, pero para las soluciones diluidas la elevación del punto de ebullición es directamente proporcional a la concentración molal del soluto:

Hay que tener en cuenta que la constante de proporcionalidad K B es propiedad del disolvente ya que este es el único componente que contribuye a la presión de vapor en el modelo que estamos considerando en esta sección.
| solvente | pb normal, °C | K b, K mol —1 kg |
|---|---|---|
| agua | 100 | 0.514 |
| etanol | 79 | 1.19 |
| ácido acético | 118 | 2.93 |
| tetracloruro de carbono | 76.5 | 5.03 |
La sacarosa (C 22 O 11 H 22, 342 g mol —1), como muchos azúcares, es altamente soluble en agua; casi 2000 g se disolverán en 1 L de agua, dando lugar a lo que equivale a jarabe para panqueques. Estimar el punto de ebullición de dicha solución de azúcar.
Solución
moles de sacarosa:
\[ \dfrac{2000\, g}{342\, g\, mol^{–1}} = 5.8\; mol\]
masa de agua: supongamos 1000 g (debemos conocer la densidad de la solución para encontrar su valor exacto)
La molalidad de la solución es (5.8 mol) ÷ (1.0 kg) = 5.8 m.
Usando el valor de K b de la tabla, el punto de ebullición se elevará en (0.514 K mol —1 kg) × (5.8 mol kg —1) = 3.0 K, por lo que el punto de ebullición será de 103° C.
Depresión del punto de congelación
El punto de congelación de una sustancia es la temperatura a la que las formas sólida y líquida pueden coexistir indefinidamente —es decir, están en equilibrio. Bajo estas condiciones, las moléculas pasan entre las dos fases a tasas iguales porque sus tendencias de escape de las dos fases son idénticas. Supongamos que un solvente líquido y su sólido (agua y hielo, por ejemplo) están en equilibrio ( abajo), y agregamos un soluto no volátil (como sal, azúcar, o líquido anticongelante automotriz) al agua. Esto tendrá el efecto de reducir la fracción molar de las moléculas de H 2 O en la fase líquida, y así reducir la tendencia de estas moléculas a escapar de ella, no sólo a la fase vapor (como vimos anteriormente), sino también a la fase sólida (hielo). Esto no tendrá ningún efecto sobre la velocidad a la que las moléculas de H 2 O escapan del hielo a la fase acuosa, por lo que el sistema ya no estará en equilibrio y el hielo comenzará a derretirse
abajo), y agregamos un soluto no volátil (como sal, azúcar, o líquido anticongelante automotriz) al agua. Esto tendrá el efecto de reducir la fracción molar de las moléculas de H 2 O en la fase líquida, y así reducir la tendencia de estas moléculas a escapar de ella, no sólo a la fase vapor (como vimos anteriormente), sino también a la fase sólida (hielo). Esto no tendrá ningún efecto sobre la velocidad a la que las moléculas de H 2 O escapan del hielo a la fase acuosa, por lo que el sistema ya no estará en equilibrio y el hielo comenzará a derretirse .
.

Si queremos evitar que el sólido se derrita, se debe reducir la tendencia a escapar de las moléculas del sólido. Esto se puede lograr reduciendo la temperatura; esto disminuye la tendencia a escapar de las moléculas de ambas fases, pero afecta más a las del sólido que a las del líquido, por lo que eventualmente alcanzamos el nuevo punto de congelación más bajo donde las dos cantidades vuelven a estar en equilibrio exacto y ambas las fases pueden coexistir .
.
Si prefieres pensar en términos de presiones de vapor, puedes usar el mismo argumento si tienes en cuenta que las presiones de vapor del sólido y del líquido deben ser las mismas en el punto de congelación. La dilución del líquido (el disolvente) por el soluto no volátil reduce la presión de vapor del disolvente de acuerdo con la ley de Raoult, reduciendo así la temperatura a la que las presiones de vapor del líquido y las formas congeladas de la solución serán iguales. Al igual que con la elevación del punto de ebullición, en las soluciones diluidas existe una relación lineal simple entre la depresión del punto de congelación y la molalidad del soluto:
\[ \Delta T_f = K_f \dfrac{\text{moles of solute}}{\text{kg of solvent}}\]
¡Tenga en cuenta que los valores de K f son todos negativos!
| Solvente | Punto de congelación normal (°C) | K f (K mol —1 kg) |
|---|---|---|
| agua | 0.0 | —1.86 |
| ácido acético | 16.7 | —3.90 |
| benceno | 5.5 | —5.10 |
| alcanfor | 180 | —40.0 |
| ciclohexano | 6.5 | —20.2 |
| fenol | 40 | —7.3 |
Caminos de Salazón
El uso de sal para descongelar carreteras es una aplicación común de este principio. La solución que se forma cuando parte de la sal se disuelve en el hielo húmedo reduce el punto de congelación del hielo. Si el punto de congelación cae por debajo de la temperatura ambiente, el hielo se derrite. En climas muy fríos, la temperatura ambiente puede estar por debajo de la de la solución salina, y la sal no tendrá ningún efecto. La efectividad de una sal descongelante depende del número de partículas que libera en la disociación y de su solubilidad en agua:
| nombre | Fórmula | T práctico más bajo, °C |
|---|---|---|
| sulfato de amonio | (NH 4) 2 SO 4 | —7 |
| cloruro de calcio | CaCl 2 | —29 |
| cloruro de potasio | KCl | —15 |
| cloruro de sodio | NaCl | —9 |
| urea | (NH 2) 2 CO | —7 |
Los anticongelantes para radiadores automotrices se basan principalmente en etilenglicol, (CH 2 OH) 2. Debido a las fuertes propiedades de enlace de hidrógeno de este doble alcohol, esta sustancia es miscible con agua en todas las proporciones, y aporta solo una presión de vapor muy pequeña por sí misma. Además de bajar el punto de congelación, el anticongelante también eleva el punto de ebullición, aumentando el rango de operación del sistema de enfriamiento. El glicol puro se congela a —12.9°C y hierve a 197°C, permitiendo que las mezclas de agua-glicol se adapten a una amplia gama de condiciones.
Estimar el punto de congelación de una mezcla anticongelante que se compone combinando un volumen de etilenglicol (MW = 62, densidad 1.11 g cm —3) con dos volúmenes de agua.
Solución
Supongamos que usamos 1 L de glicol y 2 L de agua (los volúmenes reales no importan siempre y cuando sus proporciones sean las dadas). La masa del glicol será de 1.10 kg y la del agua será de 2.0 kg, por lo que la masa total de la solución es de 3.11 kg. Entonces tenemos:
- número de moles de glicol: (1110 g) ÷ (62 g mol —1) = 17.9 mol
- molalidad del glicol: (17.9 mol) ÷ (2.00 kg) = 8.95 mol kg —1
- Depresión del punto de congelación: Δ T F = (—1.86 K kg —1 mol) × (8.95 mol kg —1) = —16.6 K por lo que la solución se congelará a aproximadamente —17°C.
Cualquier especie iónica formada por disociación también contribuirá a la depresión del punto de congelación. Esto puede servir como medio útil para determinar la fracción de un soluto que se disocia.
Una solución acuosa de ácido nitroso (HNO 2, MW = 47) se congela a —0.198 .C. Si la solución se preparó añadiendo 0.100 moles del ácido a 1000 g de agua, ¿qué porcentaje del HNO 2 se disocia en la solución?
Solución
La molalidad nominal de la solución es (.001 mol) ÷ (1.00 kg) = 0.001 mol kg —1.
Pero la molalidad efectiva según el valor observado Δ T F viene dada por
Δ T F ÷ K F = (—.198 K) ÷ (—1.86 K kg mol —1) = 0.106 mol kg —1; este es el número total de moles de especies presentes después de que se haya producido la reacción de disociación HNO 2 → H + + NO. Si dejamos x = [H +] = [NO 2 —], entonces por estequiometría, [HNO 2] = 0.100 - x y .106 - x = 2x y x = .0355. La fracción de HNO 2 que se disocia es .0355 ÷ 0.100 = .355, correspondiente a 35.5% de disociación del ácido.
Otra perspectiva de la depresión del punto de congelación y elevación del punto de ebullición
Un diagrama de fases simple puede proporcionar más información sobre estos fenómenos. Es posible que ya estés familiarizado con el mapa de fases para el agua de abajo.
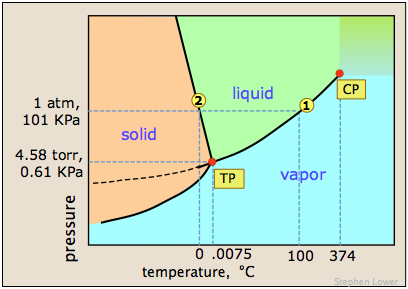
El que se muestra a continuación se expande sobre esto trazando líneas tanto para agua pura como para su estado “diluido” producido por la introducción de un soluto no volátil.
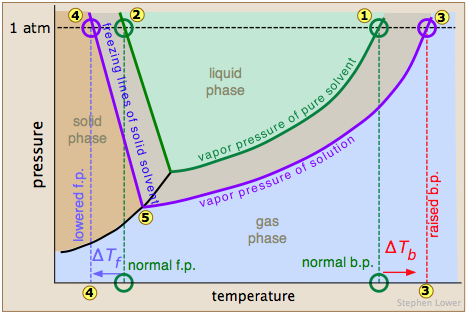
El punto de ebullición normal del disolvente puro se indica por el punto donde la curva de presión de vapor se cruza con la línea de 1 atm, es decir, donde la tendencia a escapar de las moléculas de disolvente del líquido es equivalente a una presión de 1 atmósfera. La adición de un soluto no volátil reduce las presiones de vapor a los valores dados por la línea azul. Esto desplaza el punto de ebullición hacia la derecha
donde la curva de presión de vapor se cruza con la línea de 1 atm, es decir, donde la tendencia a escapar de las moléculas de disolvente del líquido es equivalente a una presión de 1 atmósfera. La adición de un soluto no volátil reduce las presiones de vapor a los valores dados por la línea azul. Esto desplaza el punto de ebullición hacia la derecha , correspondiente al incremento de temperatura Δ T b requerido para elevar la tendencia de escape de las moléculas H 2 O de nuevo hasta 1 atm.
, correspondiente al incremento de temperatura Δ T b requerido para elevar la tendencia de escape de las moléculas H 2 O de nuevo hasta 1 atm.
Para comprender la depresión del punto de congelación, observe que la línea de presión de vapor se cruza con la línea de presión de vapor negra curva del sólido (hielo), lo que corresponde a un nuevo punto triple en el que las tres fases (hielo, vapor de agua y agua líquida) están en equilibrio y, por lo tanto, exhiben igual escape tendencias. Este punto es por definición el origen de la línea de congelación (sólido-líquido), que cruza la línea de 1 atm en un punto de congelación reducido Δ T f, indicado por
en el que las tres fases (hielo, vapor de agua y agua líquida) están en equilibrio y, por lo tanto, exhiben igual escape tendencias. Este punto es por definición el origen de la línea de congelación (sólido-líquido), que cruza la línea de 1 atm en un punto de congelación reducido Δ T f, indicado por .
.
Obsérvese que el análisis anterior supone que el soluto es soluble solo en el disolvente líquido, pero no en su forma sólida. Esto es generalmente más o menos cierto. Por ejemplo, cuando se forma hielo ártico a partir del agua de mar, las sales se “exprimen” en su mayoría. Esto tiene el interesante efecto de hacer que el agua que permanece sea más salina, y por lo tanto más densa, haciendo que se hunda hasta la parte inferior del océano donde es absorbida por la corriente profunda que fluye hacia el sur.
Una perspectiva termodinámica sobre congelación y ebullición
Aquellos lectores que tengan algún conocimiento de la termodinámica reconocerán que a lo que nos hemos venido refiriendo como tendencia de “escapar” es realmente una manifestación de la Energía Gibbs. Esta gráfica esquemática muestra cómo las G para las fases sólida, líquida y gaseosa de una sustancia típica varían con la temperatura.
La regla es que la fase con la energía libre más negativa gobierna.
La fase que es más estable (y que por lo tanto es la única que existe) es siempre la que tiene la energía libre más negativa (indicada aquí por las porciones más gruesas de las líneas trazadas). Los puntos de fusión y ebullición corresponden a las temperaturas respectivas donde el sólido y el líquido y el líquido y el vapor
y el líquido y el vapor tienen energías libres idénticas.
tienen energías libres idénticas.
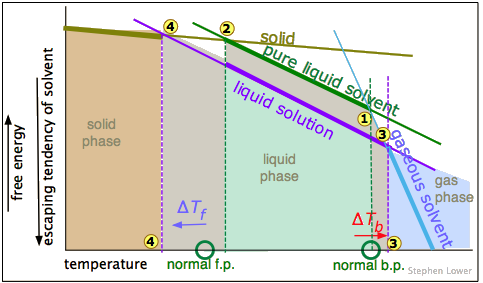
Como vimos anteriormente, agregar un soluto al líquido lo diluye, haciendo que su energía libre sea más negativa, con el resultado de que los puntos de congelación y ebullición se desplazan hacia la izquierda y la derecha, respectivamente.
Las relaciones que se muestran en estas gráficas dependen de las diferentes pendientes de las líneas que representan las energías libres de las fases a medida que cambia la temperatura. Estas pendientes son proporcionales a la entropía de cada fase. Debido a que los gases tienen las entropías más altas, la pendiente de la línea de “solvente gaseoso” es mucho mayor que la de las demás. Tenga en cuenta que esta parcela no es a escala.


