8.5: Propiedades coligativas - Presión Osmótica
- Page ID
- 70834
- Definir una membrana semipermeable en el contexto del flujo osmótico.
- Explique, en términos simples, qué proceso fundamental “impulsa” el flujo osmótico.
- ¿Qué es la presión osmótica y cómo se mide?
- La presión osmótica puede ser un medio útil para estimar el peso molecular de una sustancia, particularmente si su peso molecular es bastante grande. Explica con tus propias palabras cómo funciona esto.
- ¿Qué es la ósmosis inversa y cuál es su principal aplicación?
- Explicar el papel de la presión osmótica en la conservación de alimentos, y dar un ejemplo.
- Describir el papel que juega la ósmosis en el aumento del agua en las plantas (¿dónde está la membrana semipermeable?) , y por qué no puede ser la única causa en árboles muy altos.
La ósmosis es el proceso en el que un líquido pasa a través de una membrana cuyos poros permiten el paso de moléculas de disolvente pero son demasiado pequeños para que pasen las moléculas de soluto más grandes.
Membranas semipermeables y flujo osmótico
La figura\(\PageIndex{1}\) muestra una célula osmótica simple. Ambos compartimentos contienen agua, pero el de la derecha también contiene un soluto cuyas moléculas (representadas por círculos verdes) son demasiado grandes para pasar a través de la membrana. Muchas sustancias artificiales y naturales son capaces de actuar como membranas semipermeables. Las paredes de la mayoría de las células vegetales y animales entran dentro de esta categoría.
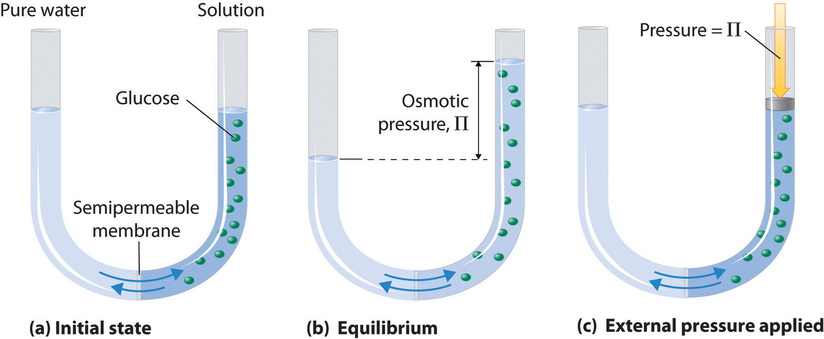
Si la celda se configura para que el nivel de líquido sea inicialmente el mismo en ambos compartimentos, pronto notará que el líquido se eleva en el compartimento izquierdo y cae en el lado derecho, lo que indica que las moléculas de agua del compartimento derecho están migrando a través de la membrana semipermeable y hacia la izquierda compartimento. Esta migración del disolvente se conoce como flujo osmótico, o simplemente ósmosis.
La tendencia a escapar de una sustancia de una fase aumenta con su concentración en la fase. ¿Cuál es la fuerza que impulsa las moléculas a través de la membrana? Esta es una pregunta engañosa, porque no hay una verdadera “fuerza” en el sentido físico que no sean las energías térmicas que poseen todas las moléculas. La ósmosis es consecuencia de estadísticas simples: los movimientos dirigidos aleatoriamente de una colección de moléculas provocarán que más salgan de una región de alta concentración que regresen a ella; la tendencia a escapar de una sustancia de una fase aumenta con su concentración en la fase.
Difusión y flujo osmótico
Supongamos que dejas caer un trozo de azúcar en una taza de té, sin remover. Inicialmente habrá una concentración muy alta de azúcar disuelto en el fondo de la taza, y una concentración muy baja cerca de la parte superior. Dado que las moléculas están en movimiento aleatorio, habrá más moléculas de azúcar moviéndose de la región de alta concentración a la región de baja concentración que en la dirección opuesta. El movimiento de una sustancia de una región de alta concentración a una de baja concentración se conoce como difusión. La difusión es consecuencia de un gradiente de concentración (que es una medida de la diferencia en la tendencia de escape de la sustancia en diferentes regiones de la solución).
Realmente no hay una fuerza especial sobre las moléculas individuales; la difusión es puramente una consecuencia de la estadística. El flujo osmótico es simplemente la difusión de un disolvente a través de una membrana impermeable a las moléculas de soluto. Ahora tomar dos soluciones de diferente concentración de disolvente, y separarlas por una membrana semipermeable (Figura\(\PageIndex{2}\)). Al ser semipermeable, la membrana es esencialmente invisible para las moléculas de disolvente, por lo que se difunden de la región de alta concentración a la región de baja concentración igual que antes. Este flujo de disolvente constituye flujo osmótico, u ósmosis.
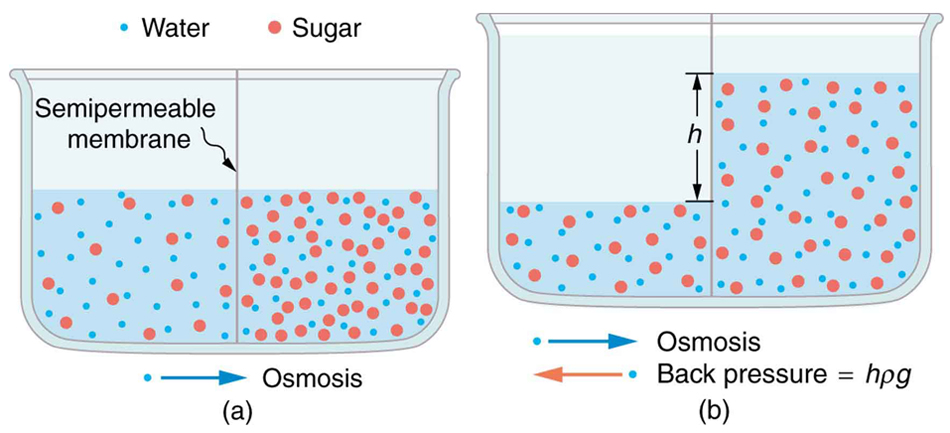
Figura\(\PageIndex{2}\): Flujo osmótico de ósmosis (a) Dos soluciones azúcar-agua de diferentes concentraciones, separadas por una membrana semipermeable que pasa agua pero no azúcar. La ósmosis estará a la derecha, ya que ahí está menos concentrada el agua. (b) El nivel del fluido se eleva hasta que la contrapresión ρgh es igual a la presión osmótica relativa; entonces, la transferencia neta de agua es cero. (CC-BY; OpenStax).
La figura\(\PageIndex{2}\) muestra moléculas de agua (azules) que pasan libremente en ambas direcciones a través de la membrana semipermeable, mientras que las moléculas de soluto más grandes permanecen atrapadas en el compartimento izquierdo, diluyendo el agua y reduciendo su tendencia a escapar de esta célula, en comparación con el agua del lado derecho. Esto da como resultado un flujo osmótico neto de agua desde el lado derecho que continúa hasta que el aumento de la presión hidrostática en el lado izquierdo eleva la tendencia de escape del agua diluida a la del agua pura a 1 atm, momento en el que se logra el equilibrio osmótico.
El flujo osmótico es simplemente la difusión de un disolvente a través de una membrana impermeable a las moléculas de soluto.
En ausencia de la membrana semipermeable, la difusión continuaría hasta que las concentraciones de todas las sustancias sean uniformes a lo largo de la fase líquida. Con la membrana semipermeable en su lugar, y si un compartimento contiene el disolvente puro, esto nunca puede suceder; no importa cuánto líquido fluya a través de la membrana, el disolvente en el lado derecho siempre estará más concentrado que el del lado izquierdo. La ósmosis continuará indefinidamente hasta que nos quedemos sin solvente, o algo más lo detenga.
Equilibrio osmótico y presión osmótica
Una forma de detener la ósmosis es elevar la presión hidrostática en el lado de la solución de la membrana. Esta presión aprieta las moléculas de disolvente más juntas, elevando su tendencia a escapar de la fase. Si aplicamos suficiente presión (o dejamos que la presión se acumule por el flujo osmótico de líquido en una región cerrada), la tendencia a escapar de las moléculas de disolvente de la solución eventualmente se elevará a la de las moléculas en el disolvente puro, y el flujo osmótico ocurrirá. La presión requerida para lograr el equilibrio osmótico se conoce como presión osmótica. Tenga en cuenta que la presión osmótica es la presión requerida para detener la ósmosis, no para sostenerla.
La presión osmótica es la presión requerida para detener el flujo osmótico Es de uso común decir que una solución “tiene” una presión osmótica de “x atmósferas”. Es importante entender que esto no significa más que que se debe aplicar una presión de este valor a la solución para evitar el flujo de disolvente puro a esta solución a través de una membrana semipermeable que separa los dos líquidos.
Presión osmótica y concentración de solutos
El científico holandés Jacobus Van 't Hoff (1852-1911) fue uno de los gigantes de la química física. Descubrió esta ecuación después de un encuentro casual con un amigo botánico durante un paseo por un parque de Ámsterdam; el botánico había aprendido que la presión osmótica aumenta alrededor de 1/273 por cada grado de aumento de temperatura. van 't Hoff inmediatamente captó la analogía con la ley del gas ideal. La presión osmótica\(\Pi\) de una solución que contiene\(n\) moles de partículas de soluto en una solución de volumen\(V\) viene dada por la ecuación de van't Hoff:
\[\Pi = \dfrac{nRT}{V} \label{8.4.3}\]
en el que
- \(R\)es la constante de gas (0.0821 L atm mol —1 K —1) y
- \(T\)es la temperatura absoluta.
En contraste con la necesidad de emplear molalidad de soluto para calcular los efectos de un soluto no volátil sobre los cambios en los puntos de congelación y ebullición de una solución, podemos usar molaridad de soluto para calcular presiones osmóticas.
Nótese que la fracción\(n/V\) corresponde a la molaridad (\(M\)) de una solución de un soluto no disociante, o al doble de la molaridad de un soluto totalmente disociado tal como\(NaCl\). En este contexto, la molaridad se refiere al total sumado de las concentraciones de todas las especies de solutos. Por lo tanto, la Ecuación\ ref {8.4.3} puede expresarse como
\[\Pi =MRT \label{8.4.3B}\]
Recordar el\(\Pi\) is the Greek equivalent of P, the re-arranged form \(\Pi V = nRT\) de la ecuación anterior debería resultar familiar. Se gastó mucho esfuerzo hacia finales del siglo XIX para explicar la similitud entre esta relación y la ley del gas ideal, pero de hecho, la ecuación de Van 't Hoff resulta ser solo una aproximación muy aproximada de la ley de presión osmótica real, que es considerablemente más complicada y fue derivado después de la formulación de van 't Hoff. Como tal, esta ecuación da resultados válidos solo para soluciones extremadamente diluidas (“ideales”).
Según la ecuación de Van 't Hoff, una solución ideal que contenga 1 mol de partículas disueltas por litro de disolvente a 0° C tendrá una presión osmótica de 22.4 atm.
El agua de mar contiene sales disueltas a una concentración iónica total de aproximadamente 1.13 mol L —1. ¿Qué presión se debe aplicar para evitar el flujo osmótico de agua pura hacia el agua de mar a través de una membrana permeable solo a las moléculas de agua?
Solución
Esta es una sencilla aplicación de la Ecuación\ ref {8.4.3B}.
\[ \begin{align*} \Pi &= MRT \\[4pt] &= (1.13\; mol /L)(0.0821\; L \,atm \,mol^{–1}\; K^{–1})(298\; K) \\[4pt] &= 27.6\; atm \end{align*}\]
Determinación del peso molecular por presión osmótica
Dado que todas las propiedades coligativas de las soluciones dependen de la concentración del disolvente, su medición puede servir como una herramienta experimental conveniente para determinar la concentración, y por lo tanto el peso molecular, de un soluto. La presión osmótica es especialmente útil en este sentido, ya que una pequeña cantidad de soluto producirá un cambio mucho mayor en esta cantidad que en el punto de ebullición, punto de congelación o presión de vapor. incluso una solución de 10 —6 molar tendría una presión osmótica medible. Las determinaciones de peso molecular se realizan con mucha frecuencia en proteínas u otros polímeros de alto peso molecular. Estas sustancias, debido a su gran tamaño molecular, tienden a ser escasamente solubles en la mayoría de los disolventes, por lo que la medición de la presión osmótica suele ser la única forma práctica de determinar sus pesos moleculares.
Se encontró que la presión osmótica de una solución de benceno que contenía 5.0 g de poliestireno por litro fue de 7.6 torr a 25°C, estimando el peso molecular promedio del poliestireno en esta muestra.
Solución:
presión osmótica:
\[ \begin{align*} \Pi &= \dfrac{7.6\, torr}{760\, torr\, atm^{–1}} \\[4pt] &= 0.0100 \,atm \end{align*} \]
Usando la forma de la ecuación de van't Hoff (Ecuación\ ref {8.4.3}), PV = nRT, el número de moles de poliestireno es
n = (0.0100 atm) (1 L) ÷ (0.0821 L atm mol —1 K —1) (298 K) = 4.09 x 10 —4 mol
Masa molar del poliestireno:
(5.0 g) ÷ (4.09 x 10 —4 mol) = 12200 g mol —1.
El experimento para demostrarlo es bastante sencillo: el disolvente puro se introduce en un lado de una celda que se separa en dos partes por una membrana semipermeable. La solución de polímero se coloca en el otro lado, el cual está encerrado y conectado a un manómetro o algún otro tipo de manómetro. A medida que las moléculas de disolvente se difunden en la celda de solución, la presión se acumula; eventualmente esta presión coincide con la presión osmótica de la solución y el sistema está en equilibrio osmótico. La presión osmótica se lee desde el dispositivo de medición y se sustituye en la ecuación de van't Hoff para encontrar el número de moles de soluto.


