8.8: Soluciones ideales frente a soluciones reales
- Page ID
- 70854
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Describir las razones físicas por las que una solución líquida binaria podría exhibir un comportamiento no ideal
El popular vodka licor consiste principalmente en etanol (alcohol etílico) y agua en porciones aproximadamente iguales. El etanol y el agua tienen presiones de vapor sustanciales, por lo que ambos componentes contribuyen a la presión total de la fase gaseosa por encima del líquido en un recipiente cerrado de los dos líquidos. Se podría esperar que la presión de vapor de una solución de etanol y agua sea directamente proporcional a las sumas de los valores predichos por la ley de Raoult para los dos líquidos individualmente, pero en general, esto no sucede. La razón de esto se puede entender si recuerdas que la ley de Raoult refleja un solo efecto: la menor proporción de moléculas vaporizables (y por lo tanto su reducida tendencia a escapar) cuando el líquido es diluido por sustancia de otro modo “inerte” (no volátil).
Soluciones ideales
Hay algunas soluciones cuyos componentes siguen bastante de cerca la ley de Raoult. Un ejemplo de tal solución es una compuesta por hexano C 6 H 14 y heptano C 7 H 16. La presión de vapor total de esta solución varía en línea recta con la composición de la fracción molar de la mezcla.
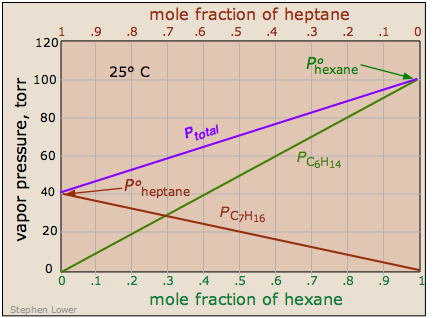
Obsérvese que las escamas de fracción molar en la parte superior e inferior discurren en direcciones opuestas, ya que por definición,
\[\chi_{hexane} = 1 – \chi_{heptane}\]
Si esta solución se comporta idealmente, entonces es la suma de las parcelas de la ley de Raoult para los dos compuestos puros:
\[P_{total} = P_{ heptane } + P_{ hexane }\]
Una solución ideal es aquella cuya presión de vapor sigue la ley de Raoult en toda su gama de composiciones. La experiencia ha demostrado soluciones que aproximan el comportamiento ideal están compuestas por moléculas que tienen estructuras muy similares. Así, el hexano y el heptano son hidrocarburos lineales que difieren solo por un solo grupo —CH 2. Esto proporciona una pista directa de la causa subyacente del comportamiento no ideal en soluciones de líquidos volátiles. En una solución ideal, las interacciones están ahí, pero todas son energéticamente idénticas. Así, en una solución ideal de moléculas A y B, las atracciones A—A y B—B son las mismas que las atracciones A—B. Este es el caso sólo cuando los dos componentes son química y estructuralmente muy similares.
Soluciones ideales vs. gases ideales
La solución ideal difiere de manera fundamental de la definición de un gas ideal, definido como una sustancia hipotética que sigue la ley del gas ideal. La teoría molecular cinética que explica el comportamiento ideal del gas asume que las moléculas no ocupan espacio y que las atracciones intermoleculares están totalmente ausentes.
La definición de un gas ideal es claramente inaplicable a los líquidos, cuyos volúmenes reflejan directamente los volúmenes de sus moléculas componentes. Y por supuesto, la capacidad misma de las moléculas para formar una fase condensada se debe a las fuerzas atractivas entre las moléculas. Entonces, lo más que podemos decir de una solución ideal es que las atracciones entre todas sus moléculas son idénticas, es decir, las moléculas de tipo A son tan fuertemente atraídas por otras moléculas A como a las moléculas de tipo B. Las soluciones ideales son perfectamente democráticas: no hay favoritas.
Soluciones Reales
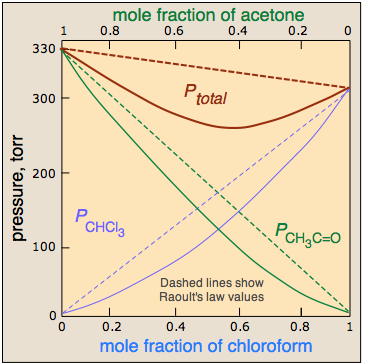
Las soluciones reales se parecen más a sociedades reales, en las que algunos miembros son “más iguales que otros”. Supongamos, por ejemplo, que a diferencia de las moléculas se sienten más fuertemente atraídas entre sí que son como moléculas. Esto hará que los pares A—B que se encuentran adyacentes entre sí sean energéticamente más estables que los pares A—A y B—B. En composiciones en las que están presentes números significativos de ambos tipos de moléculas, sus tendencias a escapar de la solución —y así la presión de vapor de la solución, caerán por debajo de lo que sería si las interacciones entre todas las moléculas fueran idénticas. Esto da lugar a una desviación negativa de la ley de Raoult. El sistema cloroformo-acetona, ilustrado anteriormente, es un buen ejemplo.
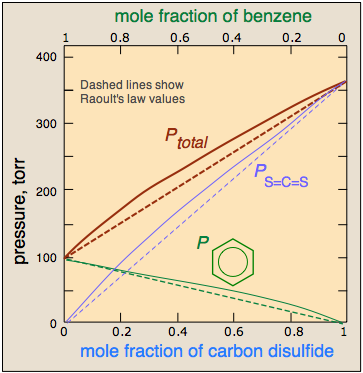
Por el contrario, si moléculas similares de cada tipo se sienten más atraídas entre sí que a otras distintas, entonces se estabilizarán las moléculas que pasan a estar cerca de su propia especie. En composiciones que se aproximan al 50 por ciento en moles, las moléculas A y B próximas entre sí escaparán más fácilmente de la solución, que por lo tanto exhibirá una presión de vapor más alta que la que de otra manera sería el caso. No debería ser sorprendente moléculas tan diferentes como el benceno y\(CS_2\) deberían interactuar más fuertemente con su propia especie, de ahí la desviación positiva ilustrada aquí.
Recordará que todos los gases se acercan al comportamiento ideal ya que sus presiones se acercan a cero. De la misma manera, a medida que la fracción molar de cualquiera de los componentes se acerca a la unidad, el comportamiento de la solución se acerca a la idealidad. Esto es una consecuencia simple del hecho de que en estos límites, cada molécula está rodeada principalmente por su propia especie, y las pocas interacciones A-B tendrán poco efecto. La ley de Raoult es, por lo tanto, una ley limitante:
\[P_i = \lim_{x_i \rightarrow 0} P^o \chi_i\]
da la presión parcial de una sustancia en equilibrio con la solución cada vez más estrechamente a medida que la fracción molar de esa sustancia se acerca a la unidad.


