8.10.9A: Electrolitos y Soluciones Electrolíticas
- Page ID
- 70884
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Describir las propiedades del agua que la convierten en un solvente electrolítico ideal.
- Describir la estructura general de las conchas de hidratación iónica.
- Explique por qué todos los cationes actúan como ácidos en el agua.
- Describir algunas de las principales formas en que la conducción de electricidad a través de una solución difiere de la conducción metálica.
- Definir resistencia, resistividad, conductancia y conductividad.
- Definir la conductividad molar y explicar su significación.
- Explicar los principales factores que hacen que la conductividad molar disminuya a medida que aumentan las concentraciones de electrolitos.
- Describir el comportamiento contrastante de electrolitos fuertes, intermedios y débiles.
- Explicar la distinción entre difusión iónica y migración iónica.
- Definir la conductividad iónica limitante y comentar algunos de sus usos.
- Explique por qué los iones hidrógeno e hidróxido exhiben movilidades iónicas excepcionalmente grandes.
Las soluciones electrolíticas son aquellas que son capaces de conducir una corriente eléctrica. Una sustancia que, cuando se agrega al agua, la vuelve conductora, se conoce como electrolito. Un ejemplo común de un electrolito es la sal ordinaria, el cloruro de sodio. El NaCl sólido y el agua pura no son conductores, pero una solución de sal en el agua es fácilmente conductora. Una solución de azúcar en agua, por el contrario, es incapaz de conducir una corriente; por lo tanto, el azúcar es un no electrolito.
Estos hechos se conocen desde 1800 cuando se descubrió que una corriente eléctrica puede descomponer el agua en una solución electrolítica en sus elementos (un proceso conocido como electrólisis). A mediados de siglo, Michael Faraday había realizado el primer estudio sistemático de soluciones electrolíticas. Faraday reconoció que para que una muestra de materia conduzca la electricidad, se deben cumplir dos requisitos:
- La materia debe estar compuesta por, o contener, partículas cargadas eléctricamente.
- Estas partículas deben ser móviles; es decir, deben ser libres de moverse bajo la influencia de un campo eléctrico aplicado externo.
En los sólidos metálicos, los portadores de carga son electrones más que iones; su movilidad es consecuencia del principio de incertidumbre quantomecánica que promueve el escape de los electrones de los confines de su entorno atómico local. En el caso de las soluciones electrolíticas, Faraday llamó a los iones portadores de carga (después de la palabra griega para “vagabundo”). Su hallazgo más importante fue que cada tipo de ion (que él consideraba como un átomo cargado eléctricamente) lleva una cantidad definida de carga, más comúnmente en el rango de ±1-3 unidades.
El hecho de que las cargas más pequeñas observadas tuvieran magnitudes de ±1 unidad sugería una naturaleza “atómica” para la propia electricidad, y condujo en 1891 al concepto del “electrón” como la unidad de carga eléctrica —aunque no se hizo la identificación de esta carga unitaria con la partícula que ahora conocemos como el electrón hasta 1897.
Un sólido iónico como el NaCl está compuesto por partículas cargadas, pero éstas se mantienen tan apretadas en la red cristalina que son incapaces de moverse, por lo que no se cumple el segundo requisito mencionado anteriormente y la sal sólida no es un conductor. Si la sal se funde o disuelve en agua, los iones pueden moverse libremente y el líquido fundido o la solución se convierte en un conductor.
Dado que los iones cargados positivamente son atraídos por un electrodo negativo que tradicionalmente se conoce como cátodo, estos a menudo se denominan cationes. Del mismo modo, los iones cargados negativamente, que son atraídos hacia el electrodo positivo, o ánodo, se denominan aniones. (Todos estos términos fueron acuñados por Faraday.)
El papel del solvente: qué tiene de especial el agua
Aunque tendemos a pensar en el disolvente (generalmente agua) como un medio puramente pasivo dentro del cual los iones se desplazan alrededor, es importante entender que las soluciones electrolíticas no existirían sin la participación activa del disolvente en la reducción de las fuertes fuerzas de atracción que sostienen las sales sólidas y moléculas como HCl juntas. Una vez que se liberan los iones, se estabilizan mediante interacciones con las moléculas de disolvente. El agua no es el único líquido capaz de formar soluciones electrolíticas, sino que es, con mucho, el más importante. Por lo tanto, es esencial comprender aquellas propiedades del agua que influyen en la estabilidad de los iones en solución acuosa.
Según la ley de Coulomb, la fuerza entre dos partículas cargadas es directamente proporcional al producto de las dos cargas, e inversamente proporcional al cuadrado de la distancia entre ellas:
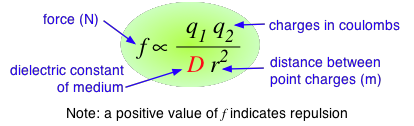
La constante de proporcionalidad D es la constante dieléctrica adimensional. Su valor en el espacio vacío es la unidad, pero en otros medios será mayor. Dado que D aparece en el denominador, esto significa que la fuerza entre dos partículas cargadas dentro de un gas o líquido será menor que si las partículas estuvieran en vacío. El agua tiene una de las constantes dieléctricas más altas de cualquier líquido conocido; el valor exacto varía con la temperatura, pero 80 es un buen número redondo para recordar. Cuando dos iones de carga opuesta se sumergen en agua, la fuerza que actúa entre ellos es solo 1/80 tan grande como lo sería entre los dos iones gaseosos a la misma distancia. Se puede demostrar que para separar un mol de iones Na + y Cl — a su distancia normal de 23.6 pm en cloruro de sodio sólido, el trabajo requerido será 586 J en vacío, pero solo 7.3 J en agua
Constante dieléctrica
La constante dieléctrica es una propiedad masiva de la materia, más que ser una propiedad de la propia molécula, como lo es el momento dipolar. Es un efecto cooperativo de todas las moléculas en el líquido, y es una medida de la medida en que un campo eléctrico aplicado hará que las moléculas se alineen con los extremos negativos de sus dipolos apuntando hacia la dirección positiva del campo eléctrico. La alta constante dieléctrica del agua es consecuencia del pequeño tamaño de la molécula H 2 O en relación con su gran momento dipolar.
Cuando una molécula se reorienta por la acción de un campo eléctrico externo, los enlaces de hidrógeno locales tienden a atraer a las moléculas vecinas a la misma alineación, produciendo así un efecto aditivo que estaría ausente si todas las moléculas actuaran independientemente.
El momento dipolo del agua estabiliza los iones disueltos a través de enlaces de hidrógeno
Cuando se introduce un ion en un disolvente, las interacciones atractivas entre las moléculas de disolvente deben interrumpirse para crear espacio para el ion. Esto cuesta energía y por sí mismo tendería a inhibir la disolución. Sin embargo, si el disolvente tiene un alto momento dipolar permanente, el costo de energía es más que recuperado por las atracciones ión-dipolo entre el ion y las moléculas de disolvente circundantes.
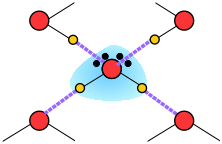
El agua, como saben, tiene un momento dipolar considerable que es la fuente del enlace de hidrógeno que mantiene unido el líquido. La mayor fuerza de las atracciones ión-dipolo en comparación con las atracciones de enlace de hidrógeno (dipolo-dipolo) estabiliza el ion disuelto.
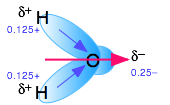
El agua no es el único solvente electrolítico, sino que es de lejos el mejor. Para algunos propósitos, los químicos ocasionalmente necesitan emplear solventes no acuosos cuando estudian electrolitos. Aquí hay algunos ejemplos:
| solvente | Punto de fusión (°C) | Punto de ebullición °C | D | momento dipolo | conductividad específica, S/cm |
|---|---|---|---|---|---|
| agua | 0 | 100 | 80.1 | 1.87 | 5.5 × 10 —8 |
| metanol | —98 | 64.7 | 32.7 | 1.7 | 1.5× 10 —7 |
| etanol | —114 | 78.3 | 24.5 | 1.66 | 1.35 × 10 —9 |
| acetonitrilo | —43.8 | 81.6 | 37.5 | 3.45 | 7 × 10 —6 |
| sulfóxido de dimetilo | 18.5 | 189 | 46.7 | 3.96 | 3 × 10 —8 |
| carbonato de etileno | 36.4 | 238 | 89.6 | 4.87 | < 1 × 10 —9 |


