8.10.9B: La naturaleza de los iones en solución acuosa
- Page ID
- 70855
Los tipos de iones que consideraremos en esta lección son en su mayoría los que se encuentran en soluciones de ácidos o sales comunes. Como es evidente a partir de la imagen de abajo, la mayoría de los elementos metálicos forman cationes monatómicos, pero el número de aniones monatómicos es mucho menor. Esto refleja el hecho de que muchos aniones de un solo átomo como el hidruro H —el óxido O 2—, el sulfuro S2 — y los de los Grupos 15 y 16, son inestables en (es decir, reaccionan con) el agua, y sus formas principales son aquellas en las que se combinan con otros elementos, particularmente oxígeno. Algunos de los oxianiones más familiares son hidróxido OH —, carbonato CO 3 2—, nitrato NO 3 —, sulfato SO 4 2—, clorato ClO 4 2—, y arsenato ASo 4 2— .
Conductividad de agua” con κ = 0.043 × 10 —6 S cm —1 a 18°C. El agua destilada ordinaria en equilibrio con CO 2 atmosférico tiene una conductividad que es 16 veces mayor.

Ahora se sabe que la destilación ordinaria no puede eliminar por completo todas las impurezas del agua. Las impurezas iónicas son arrastradas en la niebla creada al romper burbujas y son transportadas al destilado por flujo capilar a lo largo de las paredes del aparato. Los materiales orgánicos tienden a ser volátiles al vapor (“destilados al vapor”).
La mejor práctica actual es emplear un alambique especial hecho de sílice fundida en el que el agua se volatiliza desde su superficie sin hervir. La eliminación completa de los materiales orgánicos se logra haciendo pasar el vapor de agua a través de una columna empaquetada con gasa de platino calentada a alrededor de 800°C a través de la cual se pasa gas oxígeno puro para asegurar la oxidación completa de los compuestos de carbono.

Las mediciones de conductancia son ampliamente utilizadas para medir la calidad del agua, especialmente en entornos industriales en los que se deben monitorear las concentraciones de sólidos disueltos para programar el mantenimiento de calderas y torres de enfriamiento.
La conductancia de una solución depende de 1) la concentración de los iones que contiene, 2) del número de cargas transportadas por cada ion, y 3) de las movilidades de estos iones. Este último término se refiere a la capacidad del ion para abrirse paso a través de la solución, ya sea por difusión térmica ordinaria o en respuesta a un gradiente de potencial eléctrico.
El primer paso para comparar las conductancias de diferentes solutos es reducirlas a una concentración común. Para ello, definimos la conductancia por unidad de concentración que se conoce como la conductividad molar, denotada por la lambda griega mayúscula:
\[Λ = \dfrac{κ}{c}\]
Cuando κ se expresa en S cm —1, C debe estar en mol cm —3, por lo que λ tendrá las unidades S cm 2. Esto se visualiza mejor como la conductancia de una celda que tiene electrodos de 1 cm 2 espaciados a 1 cm, es decir, de un cubo de solución de 1 cm. Pero debido a que los químicos generalmente prefieren expresar concentraciones en mol L —1 o mol dm —3 (mol/1000 cm 3), es común escribir la expresión para conductividad molar como
\[Λ = \dfrac{1000κ}{c}\]
electrodos, separados de nuevo por 1 cm.Pero si c es la concentración en moles por litro, esto todavía no comparará de manera justa dos sales que tienen diferentes estequiometrías, como AgnO 3 y FeCl 3, por ejemplo. Si asumimos que ambas sales se disocian completamente en solución, cada mol de AgnO 3 produce dos moles de cargas, mientras que el FeCl 3 libera seis (es decir, un ion Fe 3 +, y tres iones Cl —). Entonces, si se descuida las diferencias [bastante pequeñas] en las movilidades iónicas, la conductividad molar del FeCl 3 sería tres veces mayor que la del AgnO 3.
La forma más obvia de sortear esto es señalar que un mol de una sal 1:1 como AgnO 3 es “equivalente” (en este sentido) a 1/3 de un mol de FeCl 3, y de ½ un mol de MgBr 2. Para encontrar el número de equivalentes que corresponden a una cantidad dada de una sal, simplemente divida el número de moles por el número total de cargas positivas en la unidad de fórmula. (Si lo desea, puede dividir por el número de cargas negativas en su lugar; debido a que estas sustancias son eléctricamente neutras, los números serán idénticos).
Podemos referirnos a concentraciones equivalentes de iones individuales así como de sales neutras. Además, dado que los ácidos pueden considerarse como sales de H +, podemos aplicarles el concepto; así una solución 1M L —1 de ácido sulfúrico H 2 SO 4 tiene una concentración de 2 eq L —1.
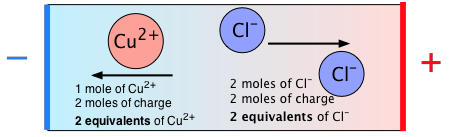
El siguiente diagrama resume la relación entre moles y equivalentes para CuCl 2:
¿Cuál es la concentración, en equivalentes por litro, de una solución elaborada al disolver 4.2 g de sulfato de cromo (III) pentahidrato Cr 2 (SO 4) 3·5H 2 O en agua suficiente para dar un volumen total de 500 mL? (La masa molar del hidrato es 482 g)
Solución
Supongamos que la sal se disocia en 6 cargas positivas y 6 cargas negativas.
- Número de moles de la sal: (4.2 g)/(482 g mol —1) = 0.00871 mol
- Número de equivalentes: (.00871 mol)/(6 eq mol —1) = 0.00146 eq
- Concentración equivalente: (0.00146 eq)/(0.5 L) = 0.00290 eq L —1
El concepto de concentración equivalente permite comparar las conductancias de diferentes sales de manera significativa. La conductividad equivalente se define de manera similar a la conductividad molar
\[Λ = \dfrac{κ}{c}\]
salvo que el término de concentración ahora se expresa en equivalentes por litro en lugar de moles por litro. (En otras palabras, la conductividad equivalente de un electrolito es la conductancia por equivalente por litro).


