8.10.9E: Algunas aplicaciones de conducción electrolítica
- Page ID
- 70858
Desde el punto de vista químico, los ejemplos más importantes de conducción están en conexión con celdas electroquímicas, electrólisis y baterías.
Determinación de constantes de equilibrio
Debido a su alta sensibilidad, las mediciones de conductividad están bien adaptadas a la medición de constantes de equilibrio para procesos que involucran concentraciones de iones muy pequeñas. Estos incluyen
- Valores de K s para sólidos poco solubles
- Constantes de autoprotólisis para disolventes (como K w)
- Constantes de disociación ácida para ácidos débiles
Siempre que las concentraciones de iones sean tan bajas, sus valores pueden tomarse como actividades, y se pueden usar directamente conductividades equivalentes limitantes λ 0.
Producto iónico del agua
La conductividad muy pequeña del agua pura hace que sea bastante difícil obtener un valor preciso para K w; se obtienen mejores valores midiendo el potencial de una celda galvánica apropiada. Pero el principio aquí ilustrado podría ser aplicable a otros solventes autoprotolíticos como H 2 SO 4.
Utilizar las conductividades iónicas molares limitantes apropiadas para estimar la constante de autoprotólisis K w de agua a 25 °C.
2 H 2 O → H 3 O + OH —.
Solución: Los datos que necesitamos son λ H + = 349.6 y λ OH— = 199.1 S cm 2 mol —1.
La conductividad del agua es κ = [H +] λ H + [OH —] λ OH— cuyas unidades funcionan a (mol cm —3) (S cm 2 mol —1). Para expresar las concentraciones iónicas en molaridades, multiplicamos el término cm —3 por (1 L/1000 cm —3), produciendo
1000 κ = [H +] λ H + [OH —] λ OH— con unidades S cm —1 L —1.
Recordando que en agua pura, [H +] = [OH —] = K w ½, obtenemos
1000 κ = (K w ½) (λ H + + λ OH—) = (K w ½) (548.7 S cm 2 mol —1).
Resolviendo para K w:
K w = (1000 κ/548,7 S cm 2 mol —1) 2
Sustituir el valor de conductividad del agua de Kohlrausch de 0.043 × 10 —6 S cm —1) por κ da
K w =( 1000 × 0.043 × 10 —6 S cm —1/548.7 S cm 2 mol —1) 2 = 0.614 × 10 —14 mol 2 cm —6 (es decir, mol 2 L —2).
El valor aceptado para la constante de autoprotólisis del agua a 25° C es K w = 1.008 × 10 —14 mol 2 L —2.
Una solución saturada de cloruro de plata AgCl tiene una conductancia 2.28 x 10 —6 S cm —1 a 25°C; la conductancia del agua utilizada para componer esta solución es 0.116 x 10 —6 S cm —1. Las conductividades iónicas limitantes de los dos iones son λ Ag + = 61.9 y λ Cl— = 76.3 S cm 2 mol —1. Utilice esta información para estimar la solubilidad molar de AgCl.
La conductividad molar limitante de la solución es
λ o = λ Ag + + λ Cl— = 138.2 S cm —1.
La conductancia debida a la sal disociada sola es la diferencia
(2.785 — 0.043) = 2.16 x 10 —6 S cm —1.
Sustituyendo en la expresión λ = 1000κ/ c rendimientos
= 1.56 x 10 —5 mol/1000 cm 3 o 1.56 x 10 —5 mol L —1.Titulación conductométrica
Una reacción química en la que hay un cambio significativo en el número o movilidades de especies iónicas puede ser seguida por el monitoreo del cambio en la conductancia. Muchas reacciones ácido-base caen dentro de esta categoría. En la valoración conductométrica, la conductometría se emplea para detectar el punto final de una valoración.

Consideremos, por ejemplo, la valoración del ácido fuerte HCl por el NaOH de base fuerte. En términos iónicos, el proceso puede representarse como
H + + Cl — + Na + + OH — → H 2 O + Na + + Cl —
En el punto final, solo quedan dos especies iónicas, en comparación con las cuatro durante las etapas iniciales de la titulación, por lo que la conductividad será mínima. Más allá del punto final, la adición continua de base hace que la conductividad vuelva a subir. Las movilidades muy grandes de los iones H + y OH — hacen que la conductividad aumente muy bruscamente a ambos lados del punto final, lo que facilita su localización.
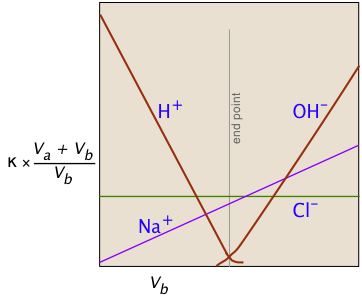
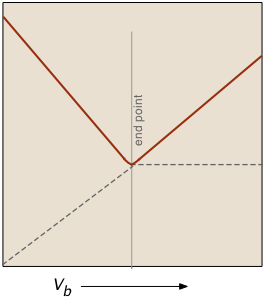
La gráfica de la izquierda representa las conductividades debidas a las especies iónicas individuales. Pero claro que la conductividad que medimos es solo la suma de todos estos (ley de migración independiente de Kohlrausch), por lo que la trama de la derecha corresponde a lo que realmente se ve cuando se realiza la titulación. El factor (V a + V b)/V b compensa la dilución de la solución a medida que se agrega más base.
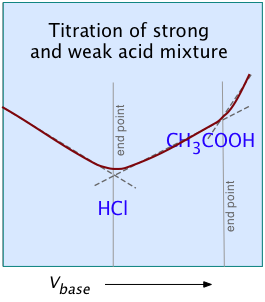

Para la mayoría de las titulaciones ácido-base ordinarias, la conductometría rara vez ofrece alguna ventaja especial sobre el análisis volumétrico regular o la potenciometría. Pero en algunos casos especiales como los aquí ilustrados, es el único método capaz de dar resultados útiles.
Conducción terrestre y terrestre
La mayoría de la gente piensa en la conducción electrolítica como algo que tiene lugar principalmente en baterías, plantas electroquímicas y en laboratorios, pero con mucho el sistema electrolítico más grande e importante es la tierra misma, o al menos la fina capa de sedimentos del suelo que recubren gran parte de su superficie.
Los suelos están compuestos por arena y sólidos húmicos dentro de los cuales se encuentran incrustados espacios porosos que contienen gases (aire y productos de respiración microbiana) y agua. Esta agua, tanto la que llena los poros como la que se adsorbe a los sólidos del suelo, contiene numerosos iones disueltos de los que depende principalmente la conductividad del suelo. Estos iones incluyen cationes intercambiables presentes en las superficies de los componentes arcillosos de los suelos. Aunque estos canales electrolíticos son pequeños y están conectados tortuosamente, están presentes en grandes cantidades y ofrecen una abundancia de vías de conducción paralelas, por lo que la tierra misma actúa como un conductor sorprendentemente eficiente.
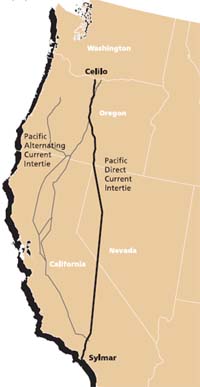
No hay mejor ilustración de esto que el uso de una trayectoria terrestre para transmitir una corriente de hasta 1800 amperios a lo largo del camino de 1360 km del Pacific DC Intertie que se extiende desde la Estación Convertidora Celilo (ver abajo) en el norte de Oregón hasta Los Ángeles. Este sistema normalmente emplea una línea de alimentación de dos conductores que opera a ± 500,000 voltios de CC, pero cuando uno de estos conductores está fuera de servicio, la ruta de tierra actúa como un conductor sustituto. ¡Se dice que este camino alternativo tiene una resistencia menor que el conductor metálico normal!
Desde un punto de vista electroquímico, el aspecto más interesante de este sistema es la manera en que la corriente fluye dentro o fuera del suelo. El sistema de puesta a tierra en Celilo está compuesto por más de 1000 electrodos de hierro fundido enterrados en una zanja circular de 3.3-km de coque de petróleo que actúa como electrodo de trabajo. Al final de Los Ángeles, la puesta a tierra se logra mediante 24 electrodos de aleación de silicio-hierro sumergidos en el cercano Océano Pacífico.
En una escala mucho menor, los sistemas de retorno a tierra de un solo cable se emplean a menudo para suministrar energía de CA monofásica regular a regiones remotas, o como ruta de retorno para cables submarinos de CC de alto voltaje. Para los sistemas submarinos de corriente continua, un cable de cobre colocado en la parte inferior es adecuado para el cátodo. Los ánodos son normalmente barras de grafito rodeadas de coque.
Es posible que haya notado que los transformadores reductores montados en poste utilizados para distribuir energía de CA monofásica en vecindarios residenciales están conectados a la línea primaria de alto voltaje (aproximadamente 10 Kv) por un solo cable. El circuito de retorno a la subestación local se completa con una conexión a tierra que baja por el polo hasta un electrodo enterrado.

La estación convertidora Celilo se encuentra en The Dalles, Oregón
Otras aplicaciones de la conductividad de tierra
- Propagación de radio de onda
- Durante el día, la transmisión de radio a frecuencias por debajo de aproximadamente 5 Mhz (como en la antigua banda de transmisión AM estándar) depende enteramente de las llamadas ondas terrestres que siguen la curvatura de la tierra. Esto ocurre porque esa porción de los frentes de onda polarizados verticalmente en contacto con la tierra induce una corriente electrolítica en el suelo, haciendo que sus porciones inferiores viajen más lentamente, doblando sus vías hacia la tierra.
- Evaluación de suelos agrícolas y ambientales
- La conductividad se ha utilizado durante mucho tiempo como una herramienta para evaluar la salinidad de los suelos agrícolas, un grave problema en las regiones de riego, donde la evaporación del agua de riego a lo largo de los años puede elevar la salinidad a niveles que pueden reducir los rendimientos de los cultivos. Debido a que otras características del suelo (contenido de humedad, densidad y mineralogía, fertilización) también juegan un papel importante, se requieren algunos cuidados para interpretar correctamente las mediciones. Los dispositivos de medición que se pueden dibujar detrás de un tractor y están equipados con receptores GPS permiten la producción de mapas de conductividad para campos enteros.
- Exploración arqueológica
- Artefactos enterrados como muros y cimientos de piedra y grandes objetos metálicos se pueden ubicar mediante una serie de mediciones de conductividad en sitios arqueológicos.