8.10.9D: Migración iónica
- Page ID
- 70870
El movimiento de los iones en solución es principalmente aleatorio
La conductancia de una solución electrolítica resulta del movimiento de los iones que contiene a medida que migran hacia los electrodos apropiados. Pero la imagen que tendemos a tener en nuestra mente de estos iones moviéndose en una marcha ordenada y directa hacia un electrodo es tremendamente errónea. Los movimientos aleatorios inducidos térmicamente de las moléculas se conocen como difusión. El término migración se refiere específicamente al movimiento de iones debido a un campo electrostático aplicado externamente.
La energía térmica promedio a temperaturas dentro del rango líquido del agua (dada por RT) es suficientemente grande como para dominar el movimiento de los iones incluso en presencia de un campo eléctrico aplicado. Esto significa que los iones, junto con las moléculas de agua que los rodean, se dedican a una danza salvaje ya que son sacudidos por movimientos térmicos (que incluyen el movimiento browniano).
Si ahora aplicamos un campo eléctrico externo a la solución, el movimiento caótico de cada ion se complementa con un salto ocasional en la dirección dictada por la interacción entre la carga iónica y el campo. Pero este es realmente un efecto sorprendentemente pequeño:
Se puede demostrar que en un campo eléctrico típico de 1 voltio/cm, un ion dado experimentará solo aproximadamente un salto dirigido al campo (no aleatorio) por cada 10 5 saltos aleatorios. Esto se traduce en una velocidad de migración promedio de aproximadamente 10 —7 m seg —1 (10 —4 mm seg —1). Dado que el radio de la molécula H 2 O es cercano a 10 —10 m, se deduce que se requieren alrededor de 1000 saltos de este tipo para avanzar más allá de una sola molécula solvente!
Los iones migran de forma independiente
Todas las soluciones iónicas contienen al menos dos tipos de iones (un catión y un anión), pero también pueden contener otros. A finales de la década de 1870, el físico Friedrich Kohlrausch notó que las conductividades equivalentes limitantes de las sales que comparten un ión común exhiben diferencias constantes.
| electrolito | λ 0 (25°C) | diferencia | electrolito | λ 0 (25°C) | diferencia |
|---|---|---|---|---|---|
KCl LiCl |
149.9 115.0 |
34.9 |
HCl HNO 3 |
426.2 421.1 |
4.9 |
| KNO 3 LiN 3 |
145.0 140.1 |
34.9 | LiCl Lino 3 |
115.0 110.1 |
4.9 |
Estas diferencias representan las diferencias en las conductividades de los iones que no se comparten entre las dos sales. El hecho de que estas diferencias sean idénticas para dos pares de sales como KCl/LiCl y KNO 3 /Lino 3 nos dice que las movilidades de los iones no comunes K + y LI + no se ven afectadas por los aniones acompañantes.
La ley de Kohlrausch simplifica enormemente las estimaciones de λ 0
Este principio se conoce como ley de migración independiente de Kohlrausch, que establece que en el límite de la dilución infinita,
Cada especie iónica contribuye a la conductividad de la solución que depende únicamente de la naturaleza de ese ion en particular, y es independiente de los otros iones presentes.
La ley de Kohlrausch puede expresarse como
λ 0 = σ λ 0 + + σ λ 0 —
Esto significa que podemos asignar una conductividad equivalente limitante λ 0 a cada tipo de ion:
| catión | H 3 O + | NH 4 + | K + | Ba 2 + | Ag + | Ca 2 + | Sr 2 + | Mg 2 + | Na + | Li + |
|---|---|---|---|---|---|---|---|---|---|---|
| λ 0 | 349.98 | 73.57 | 73.49 | 63.61 | 61.87 | 59.47 | 59.43 | 53.93 | 50.89 | 38.66 |
| anión | OH — | SO 4 2— | Br — | I — | Cl — | NO 3 — | ClO 3 — | CH 3 COO — | C 2 H 5 COO — | C 3 H 7 COO — |
| λ 0 | 197.60 | 80.71 | 78.41 | 76.86 | 76.30 | 71.80 | 67.29 | 40.83 | 35.79 | 32.57 |
Así como una tabla compacta de datos termodinámicos nos permite predecir las propiedades químicas de un número muy grande de compuestos, esta compilación de conductividades equivalentes de veinte especies diferentes produce estimaciones confiables de los valores de λ 0 para cinco veces ese número de sales.
Ahora podemos estimar conductividades limitantes de electrolitos débiles
Una aplicación útil de la ley de Kohlrausch es estimar las conductividades equivalentes limitantes de electrolitos débiles que, como observamos anteriormente, no se pueden encontrar por extrapolación. Así, para el ácido acético CH 3 COOH (“HaC”), combinamos los valores λ 0 para H 3 O + y CH 3 COO — dados en la tabla anterior:
λ 0 hAc = λ 0 H+ + λ 0 Ac—
¿Qué tan rápido migran los iones en solución?
El movimiento de un ion migratorio a través de la solución es provocado por una fuerza ejercida por el campo eléctrico aplicado. Esta fuerza es proporcional a la intensidad de campo y a la carga iónica. Los cálculos de la resistencia friccional se basan en la premisa de que los iones son esféricos (no siempre verdaderos) y el medio es continuo (nunca verdadero) en lugar de estar compuesto por moléculas discretas. Sin embargo, los resultados generalmente parecen ser lo suficientemente realistas como para ser útiles.
Según la ley de Newton, una fuerza constante ejercida sobre una partícula la acelerará, haciendo que se mueva cada vez más rápido a menos que sea restringida por una fuerza opuesta. En el caso de la conductancia electrolítica, la fuerza opuesta es el arrastre por fricción a medida que el ion se abre paso a través del medio. La magnitud de esta fuerza depende del radio del ion y su capa de hidratación primaria, y de la viscosidad de la solución.
Eventualmente estas dos fuerzas entran en equilibrio y el ion asume una velocidad promedio constante que se refleja en los valores de λ 0 tabulados en la tabla anterior.
La relación entre λ 0 y la velocidad (conocida como la movilidad iónica μ 0) se deriva fácilmente, pero omitiremos los detalles aquí, y simplemente presentaremos los resultados:
A los aniones se les asignan convencionalmente valores negativos μ 0 porque se mueven en direcciones opuestas a los cationes; los valores que se muestran aquí son valores absolutos |μ 0 |. Obsérvese también que las unidades son cm/s por voltio/cm, de ahí el término cm 2.
| catión | H 3 O + | NH 4 + | K + | Ba 2+ | Ag + | Ca 2+ | Sr 2+ | Mg 2+ | Na + | Li + |
|---|---|---|---|---|---|---|---|---|---|---|
| μ 0 | 0.362 | 0.0762 | 0.0762 | 0.0659 | 0.0642 | 0.0616 | 0.0616 | 0.0550 | 0.0520 | 0.0388 |
| anión | OH — | SO 4 2— | Br — | I — | Cl — | NO 3 — | ClO 3 — | CH 3 COO — | C 2 H 5 COO — | C 3 H 7 COO — |
| μ 0 | .2050 | 0.0827 | 0.0812 | 0.0796 | 0.0791 | 0.0740 | 0.0705 | 0.0461 | 0.0424 | 0.0411 |
Al igual que con las conductividades limitantes, las tendencias en las movilidades pueden correlacionarse aproximadamente con la carga y el tamaño del ion. (Recordemos que los iones negativos tienden a ser más grandes que los iones positivos).
Los cationes y aniones llevan diferentes fracciones de la corriente
En la conducción electrolítica, los iones que tienen diferentes signos de carga se mueven en direcciones opuestas. Las mediciones de conductividad dan solo la suma de las conductividades iónicas positivas y negativas de acuerdo con la ley de Kohlrausch, pero no revelan cuánta carga es transportada por cada tipo de ion. A menos que sus movilidades sean las mismas, los cationes y aniones no contribuyen por igual a la corriente eléctrica total que fluye a través de la célula.
Recordemos que una corriente eléctrica se define como un flujo de cargas eléctricas; la corriente en amperios es el número de culombios de carga que se mueven a través de la celda por segundo. Debido a que las soluciones iónicas contienen cantidades iguales de cargas positivas y negativas, se deduce que la corriente que pasa a través de la celda consiste en cargas positivas que se mueven hacia el cátodo y cargas negativas que se mueven hacia el ánodo. Pero debido a las diferencias de movilidad, los cationes e iones no suelen llevar fracciones idénticas de la carga.
Los números de transferencia a menudo se denominan números de transporte; cualquiera de los dos términos es aceptable en el contexto de la electroquímica. La fracción de carga transportada por un tipo dado de ion se conoce como el número de transferencia\(t_{\pm}\). Para una solución de una sal binaria simple,
\[ t_+ = \dfrac{\lambda_+}}{\lambda_+ + \lambda_-}\]
y
\[ t_- = \dfrac{\lambda_-}}{\lambda_+ + \lambda_-}\]
Por definición,
\[t_+ + t_– = 1.\]
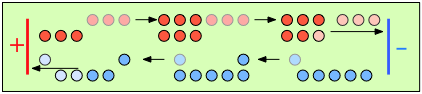
Para ayudarle a visualizar los efectos de números de transferencia no idénticos, considere una solución de M + X — en la que t + = 0.75 y t — = 0.25. Dejemos que la celda se divida en tres secciones [imaginarias] a medida que examinamos la distribución de cationes y aniones en tres etapas diferentes del flujo de corriente.
 |
Inicialmente, las concentraciones de M + y X — son las mismas en todas las partes de la célula. |
|
|
Después de que 4 faradays de carga hayan pasado a través de la celda, 3 eq de cationes y 1 eq de aniones han cruzado cualquier plano dado paralelo a los electrodos. Tenga en cuenta que se descargan 3 aniones en el ánodo, equilibrando exactamente el número de cationes descargados en el cátodo. |
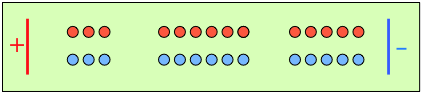 |
En ausencia de difusión, la relación de las concentraciones iónicas cerca de los electrodos es igual a la relación de sus números de transporte. |
Los números de transferencia se pueden determinar experimentalmente observando el movimiento del límite entre las soluciones electrolíticas que tienen un ion en común, como LiCl y KCl:
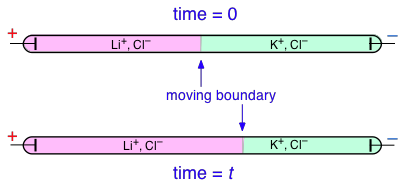
En este ejemplo, K + tiene un número de transferencia mayor que Li +, pero no trates de entender por qué el límite de KCl se mueve hacia la izquierda; los detalles de cómo funciona esto son bastante complicados y no importantes para los fines de este curso.
H + y OH — ¡los iones “migran” sin moverse, y rápidamente!
Es posible que haya notado en las tablas anteriores que los iones hidrógeno e hidróxido tienen conductividades y movilidades equivalentes extraordinariamente altas. Esto es consecuencia de que a diferencia de otros iones que necesitan chocar y empujarse a través de la red de moléculas de agua unidas por hidrógeno, estos iones son participantes de esta red. Simplemente cambiando los socios H 2 O con los que se unen hidrógeno, pueden migrar “virtualmente”. En efecto, lo que migra son los enlaces de hidrógeno, más que las masas físicas de los propios iones.
Este proceso se conoce como el Mecanismo Grothuss. El desplazamiento de los enlaces de hidrógeno ocurre cuando los movimientos térmicos rápidos de moléculas adyacentes llevan a un par particular a una configuración más favorable para los enlaces de hidrógeno dentro de la red molecular local. Hay que tener en cuenta que a lo que nos referimos como “iones hidrógeno” H + (aq) son realmente iones hidronio H 3 O +. Se ha propuesto que los agregados mayores H 5 O 2 + y H 9 O 4 + son intermedios importantes en este proceso.
Es notable que este proceso de migración virtual fue propuesto por Theodor Grotthuss en 1805 —apenas cinco años después del descubrimiento de la electrólisis, y ni siquiera conocía la fórmula correcta para el agua; pensó que su estructura era H—O—O—H.
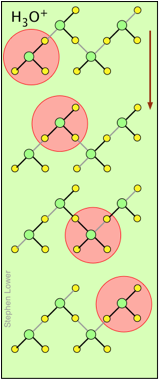
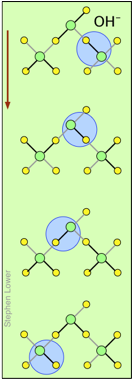
Estos dos diagramas te ayudarán a visualizar el proceso. Las sucesivas filas descendentes muestran los primeros “lúpulos” realizados por los iones H + y OH — virtuales a medida que se mueven en direcciones opuestas hacia los electrodos apropiados. (Por supuesto, el mismo mecanismo es operativo en ausencia de un campo eléctrico externo, en cuyo caso todos los lúpulos estarán en direcciones aleatorias).
Los enlaces covalentes están representados por líneas negras y los enlaces de hidrógeno por líneas grises.