9.6: El modelo orbital híbrido
- Page ID
- 70672
- Explicar por qué el intercambio de orbitales atómicos (como se implica en el modelo de Lewis) no puede dar cuenta adecuadamente de los patrones de unión observados en moléculas simples.
- Esboce un diagrama que ilustra cómo las gráficas de las funciones de ondas orbitales atómicas s - y p - dan lugar a un par de orbitales híbridos.
- Dibuje diagramas de “caja orbital” que muestren cómo las combinaciones de un orbital atómico s y varios números de orbitales p crean orbitales híbridos sp, sp 2 y sp 3.
- Mostrar cómo los orbitales híbridos están involucrados en las moléculas metano, agua y amoníaco.
Tan útil y atractivo como es el concepto del enlace de par de electrones compartidos, plantea una pregunta un tanto preocupante que tarde o temprano debemos enfrentar: ¿cuál es la naturaleza de los orbitales en los que están contenidos los electrones compartidos? Hasta ahora, hemos estado asumiendo tácitamente que cada electrón de valencia ocupa el mismo tipo de orbital atómico que lo hizo en el átomo aislado. Como veremos a continuación, su suposición muy rápidamente nos lleva a dificultades.
Los orbitales atómicos por sí solos no funcionan para Moléculas
Consideremos cómo podríamos explicar la unión en un compuesto de berilio divalente, como el hidruro de berilio, BeH 2. El átomo de berilio, con sólo cuatro electrones, tiene una configuración de 1 s 2 2 s 2. Tenga en cuenta que los dos electrones en el orbital de 2 s tienen espines opuestos y constituyen un par estable que no tiene tendencia a interactuar con electrones desapareados en otros átomos.
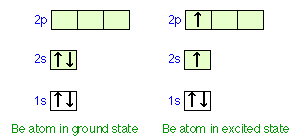
La única forma en que podemos obtener dos electrones desapareados para la unión en berilio es promover uno de los electrones de 2 s al nivel de 2 p. Sin embargo, la energía requerida para producir este átomo de estado excitado sería lo suficientemente grande como para desalentar la formación de enlaces. Se observa que Be sí forma enlaces razonablemente estables con otros átomos. Además, los dos enlaces en BeH 2 y moléculas similares son completamente equivalentes; este no sería el caso si los electrones en los dos enlaces compartieran orbitales Be de diferentes tipos, como en el diagrama de “estado excitado” anterior.
Estos hechos sugieren que es incorrecto suponer que la distribución de electrones de valencia que se comparten con otros átomos puede ser descrita por orbitales de tipo atómico s, p y d en absoluto.
Recuerde que estos diferentes orbitales surgen en primer lugar de la interacción del electrón con el único campo de fuerza electrostática central asociado con el núcleo positivo. Un electrón de capa externa en un átomo unido estará bajo la influencia de un campo de fuerza que emana de dos núcleos positivos, por lo que esperaríamos que los orbitales en los átomos unidos tengan un carácter algo diferente de los de los átomos libres. De hecho, en lo que respecta a los electrones de valencia, podemos desechar por completo el concepto de orbital atómico y reasignar los electrones a un nuevo conjunto de orbitales moleculares que son característicos de cada configuración molecular. Este enfoque es efectivamente válido, pero vamos a diferir una discusión del mismo hasta una dependencia posterior.
Por ahora, veremos un modelo menos radical que comienza con los conocidos orbitales atómicos de valencia-concha, y les permite combinarse para formar orbitales híbridos cuyas formas se ajustan bastante bien a la geometría de unión que observamos en una amplia variedad de moléculas.
¿Qué son los orbitales híbridos?
Primero, recordemos que el electrón, al ser una partícula cuántica, no puede tener una ubicación distinta; lo máximo que podemos hacer es definir la región del espacio alrededor del núcleo en la que la probabilidad de encontrar el electrón excede algún valor arbitrario, como 90% o 99%. Esta región del espacio es la orbital. Debido al carácter ondular de la materia, el orbital corresponde a un patrón de onda estacionaria en el espacio tridimensional que a menudo podemos representar con mayor claridad en la sección transversal bidimensional. La cantidad que está variando (“ondeando”) es un número denotado por ψ (psi) cuyo valor varía de punto a punto según la función de onda para ese orbital en particular.
Orbitales de todo tipo son simplemente funciones matemáticas que describen patrones particulares de onda estacionaria que se pueden trazar en una gráfica pero que no tienen realidad física propia. Debido a su naturaleza ondulada, dos o más orbitales (es decir, dos o más funciones ψ) pueden combinarse tanto en fase como fuera de fase para producir un par de orbitales resultantes que, para ser útiles, deben tener cuadrados que describan distribuciones reales de electrones en el átomo o molécula.
Los orbitales s, p, d y f con los que está familiarizado son los más convenientes para describir la distribución de electrones en átomos aislados porque la asignación de electrones a ellos de acuerdo con las reglas habituales siempre produce una función general ψ 2 que predice una distribución de electrones esféricamente simétrica, consistente con toda evidencia física de que los átomos son de hecho esféricos. Para los átomos que tienen más de un electrón, sin embargo, el conjunto de bases s, p, d, f es solo una de las muchas formas posibles de llegar a la misma distribución de electrones observada. La usamos no porque sea única, sino porque es la más sencilla.
En el caso de una molécula como BeH 2, sabemos por evidencia experimental que la molécula es lineal y por lo tanto la densidad electrónica que rodea al átomo central ya no es esférica, sino que debe concentrarse a lo largo de dos direcciones separadas 180°, y necesitamos construir una función ψ 2 teniendo estas propiedades geométricas. Hay varias formas de hacer esto, pero es conveniente es usar un conjunto particular de funciones ψ (que llamamos orbitales híbridos) que se construyen combinando las funciones atómicas s, p, d y f que ya están familiar para nosotros.
Debes entender que la hibridación no es un fenómeno físico; es simplemente una operación matemática que combina los orbitales atómicos que conocemos de tal manera que los nuevos orbitales (híbridos) poseen las propiedades geométricas y otras que son razonablemente consistentes con lo que observamos en una amplia gama (pero ciertamente no en todas) moléculas. En otras palabras, los orbitales híbridos son abstracciones que describen bastante bien la realidad en ciertas clases de moléculas (y afortunadamente, en gran parte de la clase muy grande de sustancias orgánicas) y, por tanto, son un medio útil para organizar un gran cuerpo de conocimiento químico... pero están lejos de ser infalibles.
La hibridación no es un fenómeno físico; es simplemente una operación matemática que combina los orbitales atómicos que conocemos de tal manera que los nuevos orbitales (híbridos) poseen las propiedades geométricas y otras que son razonablemente consistentes con lo que observamos en un amplio rango (pero ciertamente no en todas) moléculas.
Este enfoque, que supone que los orbitales permanecen más o menos localizados en un átomo central, es la base de la teoría que se desarrolló a principios de la década de 1930, principalmente por Linus Pauling.
Linus Pauling
Linus Pauling (1901-1994) fue el químico estadounidense más famoso del siglo XX y autor del libro clásico La naturaleza del enlace químico. Sus primeros trabajos fueron pioneros en la aplicación de la difracción de rayos X para determinar la estructura de moléculas complejas; luego pasó a aplicar la teoría cuántica para explicar estas observaciones y predecir los patrones de unión y las energías de nuevas moléculas. Pauling, quien pasó la mayor parte de su carrera en Cal Tech, ganó el Premio Nobel de Química en 1954 y el Premio de la Paz en 1962.
“En diciembre de 1930 Pauling tuvo su famoso 'avance' donde, en una avalancha de inspiración, 'se quedó despierta toda la noche, haciendo, escribiendo, resolviendo las ecuaciones, que eran tan simples que las pude resolver en pocos minutos'. Esta avalancha de cálculos eventualmente se convertiría en el primero de la serie germinal de Pauling de documentos sobre la naturaleza del enlace químico. 'Simplemente seguí poniéndome cada vez más euforia a medida que pasaba el tiempo', recordaría Pauling. “
Aunque el enfoque orbital híbrido ha demostrado ser muy potente (especialmente en química orgánica), sí tiene sus limitaciones. Por ejemplo, predice que tanto H 2 O como H 2 S serán moléculas dobladas coordinadas tetraédricamente con ángulos de enlace ligeramente menores que el ángulo tetraédrico de 109.5° debido a una mayor repulsión del par no enlazante. Esta descripción se ajusta bastante bien al agua (104.5°), pero el ángulo de enlace en el sulfuro de hidrógeno es de solo 92°, lo que sugiere que los orbitales p atómicos (que están separados 90°) proporcionan una mejor descripción de la distribución de electrones alrededor del átomo de azufre que los orbitales híbridos sp 3.
El modelo orbital híbrido es bastante sencillo de aplicar y entender, pero es mejor considerarlo como una forma especial de ver una molécula que a menudo puede ser engañosa. Otro punto de vista, llamado la teoría orbital molecular, nos ofrece una perspectiva complementaria que es importante tener si queremos desarrollar una comprensión realmente profunda de la unión química en una gama más amplia de moléculas.
Construyendo orbitales híbridos
Abajo: Las combinaciones “constructivas” y “destructivas” de las funciones de onda de 2 p y 2 s (gráficas de líneas) dan lugar a la función híbrida sp que se muestra a la derecha. Las figuras sólidas representan las funciones de probabilidad correspondientes ψ 2.
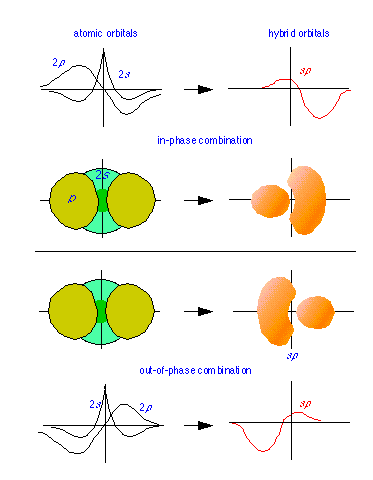
Los orbitales híbridos se construyen combinando las funciones ψ para orbitales atómicos. Debido a que los patrones de onda pueden combinarse tanto constructiva como destructivamente, un par de funciones de onda atómica como los orbitales s - y p - mostrados a la izquierda pueden combinarse de dos maneras, produciendo los híbridos sp mostrados.
Desde el punto de vista energético, podemos representar la transición de los orbitales s - y p -orbitales atómicos a un orbital híbrido sp de esta manera:
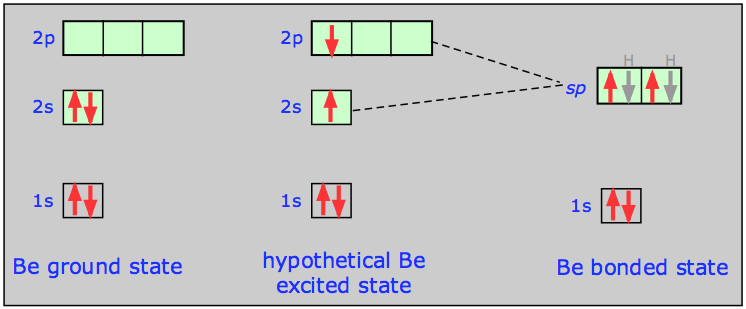
Observe aquí que 1) se conserva el número total de orbitales ocupados, y 2) los dos orbitales híbridos sp son intermedios en energía entre sus orbitales atómicos progenitores. En términos de gráficas de las funciones orbitales reales ψ podemos representar el proceso de la siguiente manera:
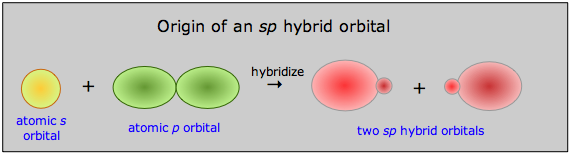
La probabilidad de encontrar el electrón en cualquier ubicación no viene dada por ψ, sino por ψ 2, cuya forma es transportada aproximadamente por las figuras sólidas de esta ilustración.
Híbridos derivados de orbitales atómicos s - y p
Unión digonal: orbitales sp-híbridos
Volviendo al ejemplo de BeH 2, podemos comparar los orbitales de valencia en los átomos libres con los de la molécula de hidruro de berilio como se muestra aquí. Es, por supuesto, el solapamiento entre los orbitales de hidrógeno-1 s y los dos lóbulos de los orbitales híbridos de berilio sp lo que constituye los dos “enlaces” Be-H en esta molécula. Observe que mientras que un solo orbital p tiene lóbulos a ambos lados del átomo, un solo híbrido sp tiene la mayor parte de su densidad electrónica en un lado, con un lóbulo menor y más esférico en el otro lado. Este lóbulo menor está centrado en el átomo central (algunas ilustraciones de libros de texto no lo hacen bien).
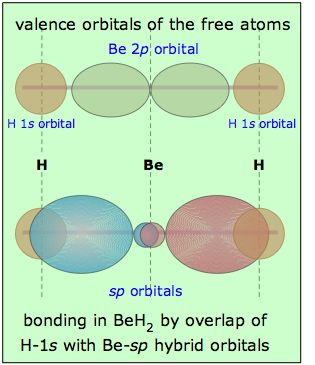
En lo que respecta a la forma de la molécula, el resultado es exactamente el mismo que el predicho por el modelo VSEPR (aunque la teoría orbital híbrida predice el mismo resultado de una manera más fundamental). Podemos esperar que cualquier átomo central que utilice hibridación sp en enlace exhiba geometría lineal cuando se incorpora a una molécula.
Hibridación trigonal (sp 2)
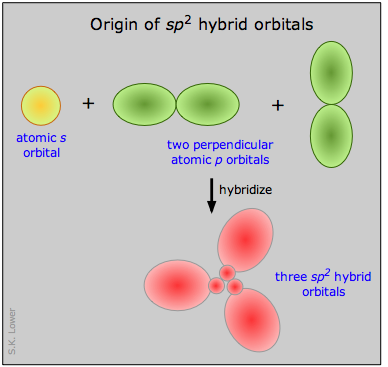
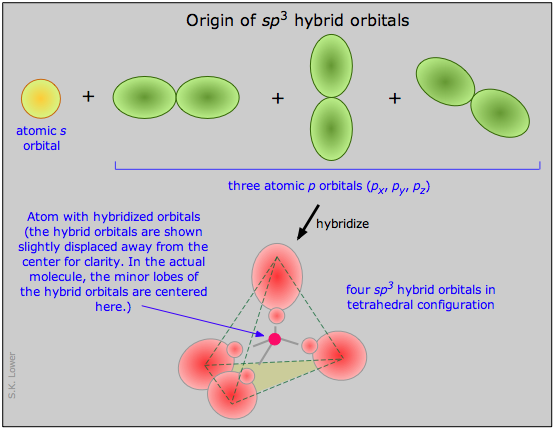
Ahora podemos pasar a aplicar las mismas ideas a algunas otras moléculas simples. En trifluoruro de boro, por ejemplo, partimos del átomo de boro, que tiene tres electrones de capa externa en su estado normal o fundamental, y tres átomos de flúor, cada uno con siete electrones externos. Como se muestra en este diagrama de configuración, uno de los tres electrones de boro está desapareado en el estado fundamental. Para explicar el enlace trivalente del boro, postulamos que los orbitales s - y p - atómicos en la capa externa del boro se mezclan para formar tres orbitales híbridos equivalentes. Estos orbitales particulares se denominan híbridos sp 2, lo que significa que este conjunto de orbitales se deriva de un orbitales s- y dos orbitales p del átomo libre.

Esta ilustración muestra cómo un s-orbital se mezcla con dos orbitales p para formar un conjunto de tres orbitales híbridos sp 2. Observe nuevamente cómo los tres orbitales atómicos producen el mismo número de orbitales híbridos.
El trifluoruro de boro BF 3 es un ejemplo común de hibridación sp 2. La molécula tiene geometría trigonal plana.
Hibridación tetraédrica (sp 3)
Veamos ahora varias moléculas tetravalentes, y veamos qué tipo de hibridación podría estar involucrada cuando cuatro átomos externos están unidos a un átomo central. Quizás el ejemplo más común e importante de este tipo de enlace es el metano, CH 4.
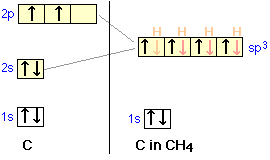
orbitales de carbono se mezclan en cuatro orbitales híbridos sp 3 que son química y geométricamente idénticos; esta última condición implica que los cuatro orbitales híbridos se extienden hacia las esquinas de un tetraedro centrado en el átomo de carbono.
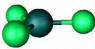
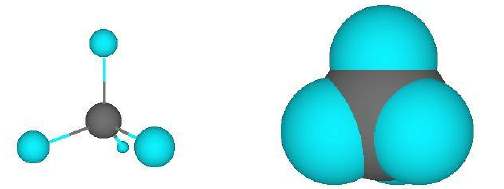
El metano es el hidrocarburo más simple; la molécula es aproximadamente esférica, como se muestra en el modelo de relleno espacial:
Al reemplazar uno o más de los átomos de hidrógeno en CH 4 con otros fragmentos de carbono hibridados sp 3, se pueden construir cadenas de hidrocarburos de cualquier grado de complejidad. El más simple de estos es el etano:
Esto muestra cómo un orbital sp 3 en cada uno de dos átomos de carbono se une (se superpone) para formar un enlace carbono-carbono, y luego el orbital de carbono sp 3 restante se solapa con seis orbitales de hidrógeno 1s para formar la molécula de etano.
Electrones de par solitario en orbitales híbridos
Si los electrones de par solitario están presentes en el átomo central, estos pueden ocupar uno o más de los orbitales sp 3. Esto hace que la geometría molecular sea diferente de la geometría de coordinación, que permanece tetraédrica. En la molécula de amoníaco, por ejemplo, el átomo de nitrógeno normalmente tiene tres electrones p desapareados, pero al mezclar los orbitales 2 s y 2 p, podemos crear cuatro orbitales híbridos sp 3 al igual que en el carbono. Tres de estos pueden formar enlaces de electrones compartido con hidrógeno, resultando en amoníaco, NH 3. El cuarto de los orbitales híbridos sp 3 contiene los dos electrones restantes de la capa externa de nitrógeno que forman un par solitario sin unión. En soluciones ácidas estas pueden coordinarse con un ión hidrógeno, formando el ion amonio NH 4 +.
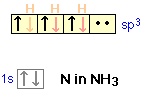
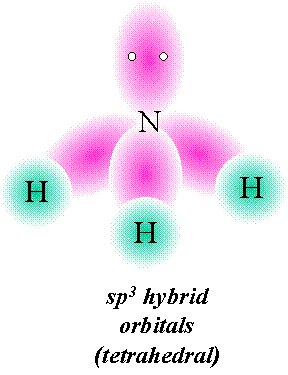
Aunque no se forman enlaces por el par solitario en NH 3, estos electrones sí dan lugar a una nube de carga que ocupa espacio como cualquier otro orbital.
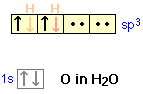
En la molécula de agua, el átomo de oxígeno puede formar cuatro orbitales sp 3. Dos de estos están ocupados por los dos pares solitarios en el átomo de oxígeno, mientras que los otros dos se utilizan para la unión. El ángulo de enlace H-O-H observado en agua (104.5°) es menor que el ángulo tetraédrico (109.5°); una explicación para esto es que los electrones no enlazantes tienden a permanecer más cerca del átomo central y así ejercer mayor repulsión en los otros orbitales, empujando así los dos orbitales de unión más cerca entre sí.
Iones moleculares
La hibridación también puede ayudar a explicar la existencia y estructura de muchos iones moleculares inorgánicos. Considere, por ejemplo, las configuraciones electrónicas del zinc en los compuestos en las ilustraciones a continuación. El ion tetraclorocinc (fila superior) es otra estructura derivada del zinc y el cloro. Como cabría esperar, este ion es tetraédrico; hay cuatro iones cloruro que rodean el ion zinc central. El ion zinc tiene una carga de +2, y cada ion cloruro es —1, por lo que la carga neta del ion complejo es —2.
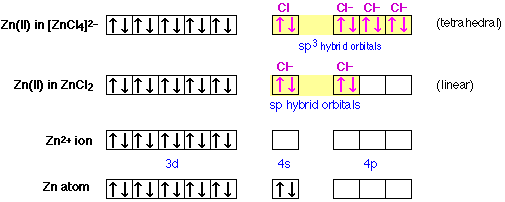
En la parte inferior se muestra la configuración electrónica del zinc atómico, y justo por encima de él, del ion zinc divalente. Observe que este ion no tiene electrones en absoluto en su 4-shell. En el cloruro de zinc, que se muestra en la siguiente fila hacia arriba, hay dos átomos de cloro equivalentes unidos al zinc. Los orbitales de unión son de carácter sp; es decir, son híbridos del 4s y un orbital 4p del átomo de zinc. Dado que estos orbitales están vacíos en el ion zinc aislado, los electrones de unión en sí mismos son aportados por los átomos de cloro, o mejor dicho, los iones cloruro, porque son estos los que aquí son las especies unidas. Cada ion cloruro posee un octeto completo de electrones, y dos de estos electrones ocupan cada enlace sp orbital en el ion complejo cloruro de zinc. Este es un ejemplo de un enlace covalente coordinado, en el que el átomo unido aporta ambos electrones que conforman el par compartido.


