9.7: El Modelo Orbital Híbrido II
- Page ID
- 70678
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Esbozar diagramas que muestran la hibridación y unión en compuestos que contienen enlaces carbono-carbono simples, dobles y triples.
- Definir enlaces sigma y pi.
- Describir la hibridación y unión en la molécula de benceno.
Esta es una continuación de la página anterior que introdujo el modelo orbital híbrido e ilustró su uso para explicar cómo los electrones de valencia de los orbitales atómicos de los tipos s y p pueden combinarse en pares equivalentes de electrones compartidos conocidos como sp, sp 2, y sp 3 orbitales híbridos. En esta lección, extendemos esta idea a compuestos que contienen enlaces dobles y triples, y a aquellos en los que están involucrados electrones d atómicos (y que no siguen la regla del octeto).
Tipos híbridos y enlaces múltiples
Ya hemos visto cómo la hibridación sp en carbono conduce a su potencia de combinación de cuatro en la molécula de metano. Dos de estos carbonos coordinados tetraédricamente pueden unirse para formar la molécula etano C 2 H 6. En esta molécula, cada carbono está unido de la misma manera que el otro; cada uno está unido a otros cuatro átomos, tres hidrógenos y un carbono. La capacidad de los enlaces carbono-carbono para extenderse indefinidamente y a través de todas las posiciones de coordinación explica los millones de moléculas orgánicas que se conocen.
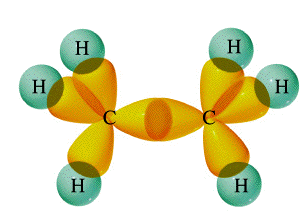
Hibridación trigonal en carbono: el doble enlace
El carbono y el hidrógeno también pueden formar un compuesto etileno (eteno) en el que cada átomo de carbono está unido a solo otros tres átomos. Aquí, podemos considerar al carbono como trivalente. Podemos explicar esta trivalencia suponiendo que la hibridación orbital en carbono no es en este caso sp 3, sino sp 2; en otras palabras, solo dos de los tres orbitales p de carbono se mezclan con el orbital de 2 s para formar híbridos; el p-orbital restante, que llamaremos orbital i, permanece sin hibridar. Cada carbono está unido a otros tres átomos en el mismo tipo de configuración trigonal plana que vimos en el caso del trifluoruro de boro, donde ocurre el mismo tipo de hibridación. Observe que los ángulos de unión alrededor de cada carbono son todos 120°.
Este esquema de hibridación alternativo explica cómo el carbono puede combinarse con cuatro átomos en algunos de sus compuestos y con otros tres átomos en otros compuestos. Puede ser consciente de la forma convencional de representar al carbono como tetravalente en todos sus compuestos; a menudo se afirma que el carbono siempre forma cuatro enlaces, pero que a veces, como en el caso del etileno, uno de estos puede ser un doble enlace. Este concepto del enlace múltiple preserva la idea del carbono tetravalente al tiempo que admite la existencia de moléculas en las que el carbono se combina claramente con menos de otros cuatro átomos.
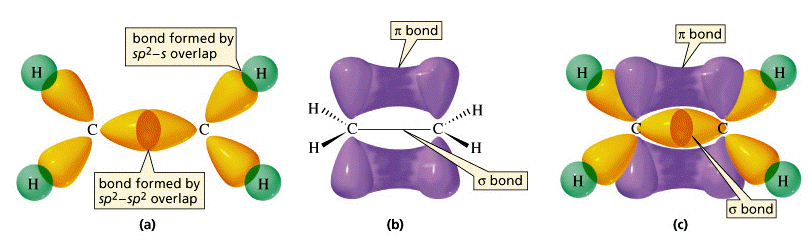
Estas tres visiones de la molécula de etileno enfatizan diferentes aspectos de la disposición de pares de electrones compartidos en los diversos orbitales de enlace del eteno (etileno). (a) La estructura “principal” que consiste en enlaces σ (sigma) formados a partir de los tres orbitales hibridados sp 2 en cada carbono. (b) El sistema de unión π (pi) formado por solapamiento del orbital pz no hibridado en cada carbono. El orbital π tiene dos regiones de densidad electrónica que se extienden por encima y por debajo del plano de la molécula. (c) Una vista en sección del sistema combinado σ y π.
orbital que es perpendicular al plano molecular. Estos dos orbitales p z paralelos interactuarán entre sí; los dos orbitales se fusionan, formando una nube de carga similar a salchicha (el enlace π) que se extiende tanto por encima como por debajo del plano de la molécula. Es el par de electrones que ocupan este nuevo orbital extendido el que constituye el “cuarto” enlace a cada carbono, y así la “otra mitad” del doble enlace en la molécula.Más sobre los bonos sigma y pi
El enlace σ (sigma) tiene su densidad electrónica máxima a lo largo de la línea de centros que une los dos átomos (abajo a la izquierda). Visto desde el extremo, el enlace σ es cilíndricamente simétrico alrededor de la línea de centros. Es esta simetría, más que su parentesco, la que define el enlace σ, que puede formarse a partir del solapamiento de dos s-orbitales, a partir de dos p -orbitales dispuestos de extremo a extremo, o a partir de una s - y una p -orbital. También se pueden formar cuando los orbitales híbridos sp en dos átomos se superponen de extremo a extremo.
Los orbitales Pi, por otro lado, requieren la presencia de dos orbitales p atómicos en átomos adyacentes. Lo más importante es que la densidad de carga en el orbital π se concentra por encima y por debajo del plano molecular; es casi cero a lo largo de la línea de centros entre los dos átomos. Es esta orientación perpendicular con respecto al plano molecular (y la consiguiente falta de simetría cilíndrica) la que define el orbital π. La combinación de un enlace σ y un enlace π que se extiende entre el mismo par de átomos constituye el doble enlace en moléculas como el etileno.
Triple enlaces carbono-carbono: hibridación sp en acetileno
Sin embargo, aún no hemos completado nuestra visión general de la vinculación múltiple. El carbono y el hidrógeno pueden formar otro compuesto más, el acetileno (etino), en el que cada carbono está conectado a solo otros dos átomos: un carbono y un hidrógeno. Esto puede considerarse como un ejemplo de carbono divalente, pero generalmente se racionaliza escribiendo un triple enlace entre los dos átomos de carbono.
Asumimos aquí que dado que dos enlaces geométricamente equivalentes están formados por cada carbono, este átomo debe hibridarse sp en acetileno. En cada carbono, un híbrido sp se une a un hidrógeno y el otro se une al otro átomo de carbono, formando el esqueleto de enlace σ de la molécula. Además de los híbridos sp, cada átomo de carbono tiene dos orbitales p semiocupados orientados en ángulo recto entre sí y con el eje interatómico. Estos dos conjuntos de orbitales p paralelos y adyacentes pueden así fusionarse en dos conjuntos de orbitales π.
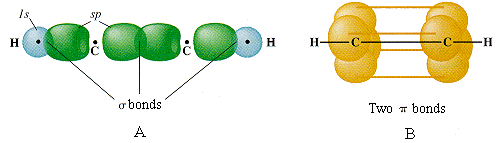
Se ve que el triple enlace en acetileno consiste en un enlace σ que une la línea de centros entre los dos átomos de carbono, y dos enlaces π cuyos lóbulos de densidad electrónica están en planos mutuamente perpendiculares. La molécula de acetileno es por supuesto lineal, ya que el ángulo entre los dos orbitales híbridos sp que producen el esqueleto s de la molécula es de 180°.
Múltiples enlaces entre átomos diferentes
También pueden ocurrir múltiples enlaces entre átomos diferentes. Por ejemplo, en dióxido de carbono cada átomo de carbono tiene dos orbitales p atómicos no hibridados, y cada átomo de oxígeno todavía tiene un orbital p disponible. Cuando los dos átomos O se llevan a lados opuestos del átomo de carbono, uno de los orbitales p en cada oxígeno forma un enlace π con uno de los orbitales p de carbono. En este caso, se observa que la hibridación sp conduce a dos dobles enlaces. Observe que los dos enlaces C—O π son mutuamente perpendiculares.
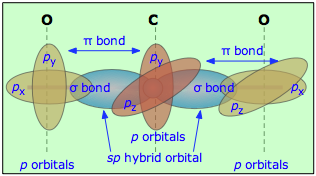
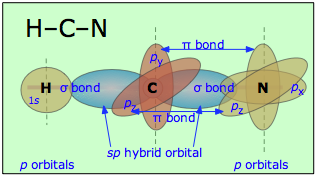
De igual manera, en el cianuro de hidrógeno, HCN, asumimos que el carbono está hibridado sp, ya que está unido a solo otros dos átomos, y por lo tanto se encuentra en un estado divalente. Uno de los orbitales híbridos sp se solapa con el orbital de hidrógeno 1 s, mientras que el otro se solapa de extremo a extremo con uno de los tres orbitales p no hibridados del átomo de nitrógeno. Esto nos deja con dos p-orbitales de nitrógeno que forman dos enlaces π mutuamente perpendiculares a los dos orbitales p atómicos en el carbono. Por lo tanto, el cianuro de hidrógeno contiene un enlace sencillo y uno triple. Este último consiste en un enlace σ del solapamiento de un orbital híbrido de carbono sp con un orbital p de nitrógeno, más dos enlaces π mutuamente perpendiculares derivados de orbitales p atómicos paralelos en los átomos de carbono y nitrógeno.
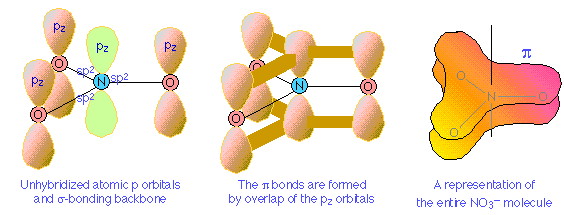
El ion nitrato
La deslocalización del enlace Pi proporciona un medio para expresar las estructuras de otras moléculas que requieren más de un electrón-punto o fórmula estructural para su representación precisa. Un buen ejemplo es el ion nitrato, que contiene 24 electrones:
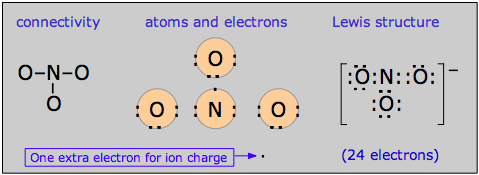
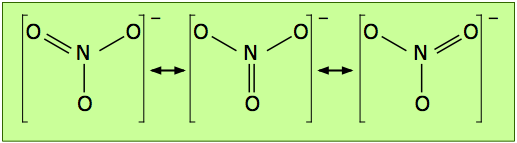
La fórmula electrón-punto mostrada anteriormente es solo una de las tres estructuras de resonancia equivalentes que se necesitan para describir la simetría trigonal de este ion.
El nitrógeno tiene tres orbitales p medio ocupados disponibles para la unión, todos perpendiculares entre sí. Dado que se sabe que el ion nitrato es plano, nos vemos obligados a asumir que los electrones externos de nitrógeno están hibridados sp 2. La adición de un electrón extra llena completamente los tres orbitales híbridos. Cada uno de estos orbitales sp 2 llenos forma un enlace σ por solapamiento con un orbital vacío de oxígeno 2 p z; esto, recordarás, es un ejemplo de enlace covalente coordinado, en el que uno de los átomos aporta ambos electrones de unión. El orbital vacío de oxígeno 2 p se pone a disposición cuando los electrones de oxígeno se hibridan sp; obtenemos tres orbitales híbridos sp llenos y un orbital atómico vacío de 2 p, al igual que en el caso del nitrógeno.
El sistema de enlace π surge de la interacción de uno de los orbitales sp de oxígeno ocupado con el orbital desocupado 2 p x del nitrógeno. Observe que esto, nuevamente, es un reparto covalente coordinado, salvo que en esta instancia es el átomo de oxígeno el que dona ambos electrones.
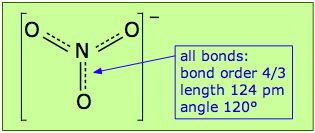
Los enlaces Pi se pueden formar de esta manera entre el átomo de nitrógeno y cualquiera de los tres oxígenos; por lo tanto, hay tres enlaces π equivalentes posibles, pero dado que el nitrógeno solo puede formar un enlace π completo a la vez, el enlace π se divide en tres formas, de manera que cada enlace N-O tiene un orden de enlace de 4/3.
Dobles enlaces conjugados
Hemos visto que el orbital de unión π es claramente diferente en forma y simetría del enlace σ. Hay otra característica importante del enlace π que tiene consecuencias de gran alcance, particularmente en la química orgánica y de coordinación. Consideremos, por ejemplo, una molécula de hidrocarburo extendida en la que pares alternos de átomos de carbono están conectados por enlaces dobles y sencillos. Cada átomo de carbono no terminal forma dos enlaces σ a otros dos carbonos y a un hidrógeno (no mostrado). Esta molécula puede verse como una serie de unidades de etileno unidas de extremo a extremo. Cada carbono, al ser sp hibridado, todavía tiene un orbital p atómico medio lleno. Dado que estos orbitales p en carbonos adyacentes son todos paralelos, podemos esperar que interactúen entre sí para formar enlaces π entre pares alternos de átomos de carbono como se muestra a continuación.
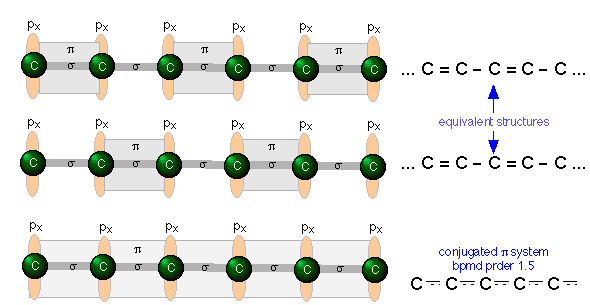
Pero dado que cada átomo de carbono posee un orbital p medio lleno, no hay nada único en la disposición de los enlaces π; una disposición igualmente probable podría ser aquella en la que los orbitales de enlace π se desplazan a pares vecinos de carbonos (ilustración central arriba). Recordarás que cuando hay dos opciones equivalentes para los arreglos de enlaces simples y dobles en una molécula, generalmente consideramos que la estructura es un híbrido de resonancia. De acuerdo con esta idea, esperaríamos que la densidad de electrones en un sistema π de este tipo se extendiera o compartiera uniformemente a lo largo de todo el marco molecular, como se muestra en la figura inferior.
Un sistema de enlaces simples y dobles alternantes, como tenemos aquí, se llama sistema conjugado. Los químicos dicen que los enlaces π en un sistema conjugado están deslocalizados; en efecto, están “manchados” en toda la longitud de la parte conjugada de la molécula. Cada par de átomos de carbono adyacentes está unido por un enlace σ y “la mitad” de un enlace π, lo que resulta en un orden de enlace C-C de 1.5. Un grado aún mayor de conjugación existe en compuestos que contienen cadenas extendidas (C=C) n. Estos compuestos, conocidos como cumulenos, exhiben interesantes propiedades eléctricas, y cuyos derivados pueden actuar como “alambres orgánicos”.

Benceno
El ejemplo clásico de deslocalización del enlace π se encuentra en la molécula cíclica benceno (C 6 H 6) que consiste en seis átomos de carbono unidos entre sí en un anillo hexagonal. Cada carbono tiene un solo átomo de hidrógeno unido a él. Las líneas en esta figura representan los enlaces σ en benceno. La estructura básica del anillo está compuesta por enlaces σ formados a partir del solapamiento de orbitales híbridos sp 2 en átomos de carbono adyacentes. Los orbitales de carbono p z no hibridados se proyectan por encima y por debajo del plano del anillo. Aquí se muestran como podrían aparecer si no interactuaran entre sí.
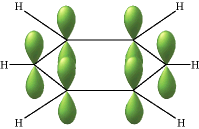
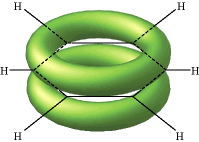
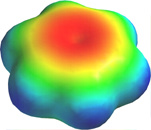
Pero lo que sucede, por supuesto, es que los lóbulos de estos orbitales atómicos se funden para formar anillos circulares de densidad electrónica por encima y por debajo del plano de la molécula. Los dos juntos constituyen la “segunda mitad” de los dobles enlaces carbono-carbono en el benceno. Esta gráfica generada por computadora de la densidad electrónica en la molécula de benceno se deriva de una teoría más rigurosa que no involucra orbitales híbridos; la densidad electrónica más alta (azul) aparece alrededor de la periferia del anillo, mientras que la más baja (roja) está en el “agujero donut” en el centro.
Híbridos que involucran d orbitales
En los átomos que están por debajo de los de la primera fila completa de la tabla periódica, la regla del octeto simple comienza a descomponerse. Por ejemplo, hemos visto que PCl 3 sí se ajusta a la regla del octeto pero PCl 5 no. Podemos describir la unión en pCl 3 mucho como lo hacemos en NH 3: cuatro orbitales hibridados sp 3, tres de los cuales se comparten con electrones de otros átomos y el cuarto contiene un par no enlazante.
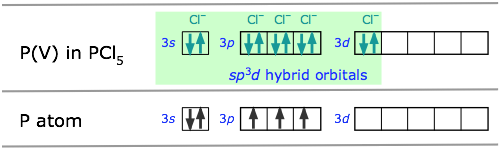
Moléculas bipiramidales pentagonales: hibridación sp 3 d
orbitales híbridos dirigidos hacia las esquinas de una bipirámide trigonal, como lo predice la teoría VSEPR.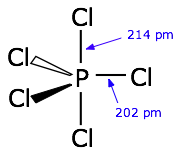
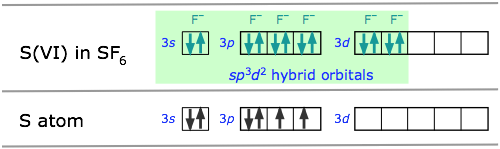
Coordinación octaédrica: hibridación sp 3 d 2
La molécula de hexafluoruro de azufre SF 6 ejemplifica uno de los tipos más comunes de hibridación d -orbital. Los seis enlaces en esta molécula octaédricamente coordinada se derivan de mezclar seis orbitales atómicos en un conjunto híbrido. La manera más fácil de entender cómo se producen estos es imaginar que la molécula se hace combinando un ion imaginario S 6 + (al que nos referimos como el estado de valencia S (VI)) con seis iones F — para formar la molécula neutra. Estos orbitales ahora vacíos de 3 s y 3 p luego se mezclan con dos orbitales de 3 d para formar los híbridos sp 3 d 2.
Algunos de los compuestos más importantes y comúnmente encontrados que involucran a los orbitales d en la unión son los complejos de metales de transición. El término “complejo” en este contexto significa que la molécula está compuesta por dos o más tipos de especies, cada una de las cuales puede tener una existencia independiente.
Moléculas cuadrado-planares: hibridación dsp 2
Por ejemplo, los iones Pt 2 + y Cl — pueden formar el ion [PtcL 4] 2—. Para entender el esquema de hibridación, ayuda a comenzar con el átomo neutro de Pt, luego imaginarlo perdiendo dos electrones para convertirse en un ion, seguido de la agrupación de los dos electrones de 5 d desapareados en un solo orbital d, dejando uno vacante.Este orbital vacante, junto con los 6 s y dos de los orbitales de 6 p, pueden entonces aceptar un par de electrones de cuatro cloros.
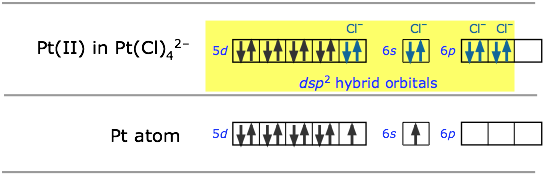
Todas las cuatro moléculas coordinadas que hemos discutido hasta ahora tienen geometría tetraédrica alrededor del átomo central. El metano, CH 4, es el ejemplo más conocido. Puede ser algo sorprendente, entonces, descubrir que el ion tetraclorplatino (II) [PtcL 4] 2— tiene una configuración esencialmente bidimensional cuadrado-planar. Este tipo de patrón de unión es bastante común cuando el ion central padre (Pt 2 + en este caso) contiene solo ocho electrones en su subcapa d más externa.
Coordinación octaédrica: sp 3 d 2 y d 2 sp 3
Muchos de los iones de metales de transición más comúnmente encontrados aceptan pares de electrones de donantes como CN y NH 3 (o que carecen de estos, incluso de H 2 O) para formar complejos de coordinación octaédricos. El catión hexaminezinc (II) representado a continuación es típico.
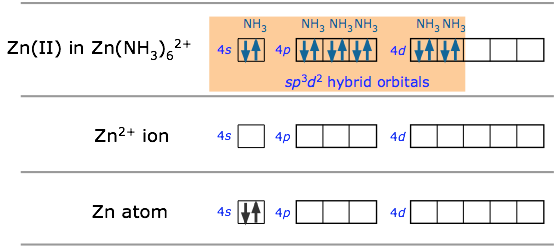
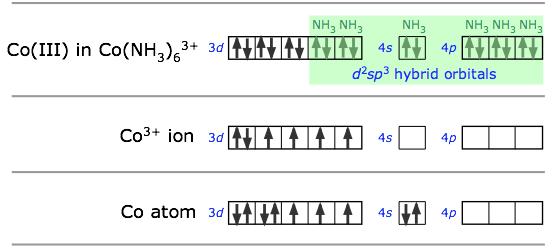
En la hibridación sp 3 d 2 los orbitales de unión se derivan mezclando orbitales atómicos que tienen el mismo número cuántico principal (n = 4 en el ejemplo anterior). Un arreglo ligeramente diferente, conocido como hibridación d 2 sp 3, involucra d orbitales de menor número cuántico principal. Esto es posible debido a las diferencias de energía bastante pequeñas entre los orbitales d en una “concha” con los orbitales s y p del siguiente superior, de ahí el término complejo “orbital interno” que a veces se usa para describir iones como hexaminecobalt ( III), que se muestran a continuación.. Ambos arreglos producen geometrías de coordinación octaédricas.
En algunos casos, el mismo átomo central puede formar complejos internos o externos dependiendo del ligando particular y de la manera en que su campo electrostático afecta las energías relativas de los diferentes orbitales.Así, el ion hexacianohierro (II) utiliza los orbitales de hierro 3 d, mientras que El hexaaquohierro (II) logra una menor energía al aceptar dos moléculas de H 2 O en sus orbitales de 4 d.
complexes.png)
Observaciones finales sobre orbitales híbridos
Como es el caso de cualquier modelo científico, el modelo de hibridación de unión es útil sólo en el grado en que puede predecir fenómenos que realmente se observan. La mayoría de los modelos contienen debilidades que ponen límites a su aplicabilidad general. La necesidad de precaución al aceptar este modelo en particular se hace más evidente cuando examinamos las formas de las moléculas debajo de la primera fila completa de la tabla periódica. Por ejemplo, esperaríamos que el enlace en sulfuro de hidrógeno sea similar al del agua, con geometría tetraédrica alrededor del átomo de azufre. Los experimentos, sin embargo, revelan que el ángulo de unión H-S—H es de solo 92°. Por lo tanto, el sulfuro de hidrógeno se desvía mucho más de la geometría tetraédrica que el agua, y no hay razón aparente y clara por la que debería hacerlo. Ciertamente es difícil argumentar que la repulsión de electrones entre los dos orbitales no enlazantes está empujando los enlaces H-S más cerca entre sí (como se supone que sucederá con los enlaces H-O en el agua); muchos argumentarían que esta repulsión sería menos en sulfuro de hidrógeno que en agua, ya que el azufre es un átomo más grande y es de ahí menos electronegativo.
orbitales no aplica a H 2 S. Parece que la explicación “simple” de que la unión se produce a través de dos orbitales p atómicos medio ocupados 90° de distancia se acerca más a la marca. Quizás la hibridación no sea un fenómeno de todo o nada; quizás los dos orbitales de 3 p estén sustancialmente intactos en sulfuro de hidrógeno, o se hibriden solo ligeramente. En general, el modelo de hibridación no funciona muy bien con elementos no metálicos más abajo en la tabla periódica, y aún no hay una explicación clara por qué. Simplemente debemos admitir que hemos llegado a uno de los muchos puntos de la química donde nuestra teoría no está suficientemente desarrollada para dar una respuesta clara e inequívoca. Sin embargo, esto no resta valor a la amplia utilidad del modelo de hibridación para dilucidar el carácter de enlace y las formas de enlace en los millones de moléculas basadas en elementos de primera fila, particularmente de carbono.¿Son reales los orbitales híbridos?
La justificación que dimos para invocar la hibridación en moléculas como BeH 2, BF 3 y CH 4 fue que los enlaces en cada uno son geométrica y químicamente equivalentes, mientras que los orbitales atómicos s y p en los átomos centrales no lo son. Al combinarlos en nuevos orbitales de los tipos sp, sp 2 y sp 3 obtenemos el número requerido de orbitales completamente equivalentes. Esto parecía bastante fácil de hacer en papel; simplemente dibujamos cajitas y escribimos “sp 2” o lo que sea debajo de ellas. Pero, ¿qué está pasando realmente aquí?
La respuesta completa está más allá del alcance de este curso, por lo que sólo podemos ofrecer la siguiente explicación muy general. Primero, recordemos lo que entendemos por “orbital”: una función matemática ψ que tiene el carácter de una onda estacionaria cuyo cuadrado ψ 2 es proporcional a la probabilidad de encontrar el electrón en cualquier ubicación particular en el espacio. Esta última, la distribución de la densidad electrónica, se puede observar (por dispersión de rayos X, por ejemplo), y en este sentido es lo único que es “real”.
Una onda estacionaria dada (función Y) se puede sintetizar combinando todo tipo de patrones de onda fundamentales (es decir, orbitales atómicos) de la misma manera que un color que observamos se puede reproducir combinando diferentes conjuntos de colores primarios en diversas proporciones. En ningún caso se deduce que estos orbitales originales (o colores) estén realmente presentes en el producto final. Entonces bien se podría argumentar que los orbitales híbridos no son “reales”; simplemente resultan convenientes para entender la unión de moléculas simples a nivel elemental, y es por eso que los usamos.
Una alternativa a los híbridos: el modelo Bent-Bond
Resulta, de hecho, que la distribución de electrones y la unión en etileno pueden describirse igualmente bien asumiendo que no hay hibridación alguna. El modelo de “enlace doblado” solo requiere que las direcciones de algunos de los orbitales atómicos se distorsionen lo suficiente como para proporcionar el solapamiento necesario para la unión; estos a veces se denominan "enlaces de banano”.
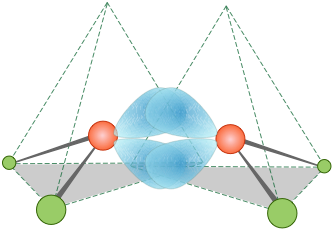
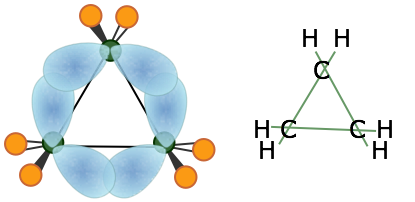

El más pequeño de los hidrocarburos de anillo cerrado es el ciclopropano, una molécula plana en la que los ángulos de enlace C-C son de 120°, ¡bastante alejándose del ángulo tetraédrico de 109.5° asociado con la hibridación sp 3! Los estudios teóricos sugieren que el modelo de unión doblada funciona bastante bien en la predicción de sus propiedades.


