9.5: Geometría Molecular
- Page ID
- 70665
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- Describir la manera en que la repulsión entre pares de electrones afecta la orientación de las regiones que los contienen.
- Definir la geometría de coordinación y describir la geometría particular asociada con la repulsión de pares de electrones entre dos, tres, cuatro, cinco o seis regiones de unión idénticas.
- Explicar la distinción entre geometría de coordinación y geometría molecular, y proporcionar una ilustración basada en la estructura del agua o amoníaco.
- Dibuja un diagrama de una molécula tetraédrica u octaédrica.
Las estructuras de punto de electrones de Lewis que has aprendido a dibujar no tienen ningún significado geométrico que no sea representar el orden en el que los diversos átomos están conectados entre sí. Sin embargo, una ligera extensión del concepto de par simple de electrones compartidos es capaz de racionalizar y predecir la geometría de los enlaces alrededor de un átomo dado en una amplia variedad de situaciones.
Repulsión de pares de electrones
El modelo de repulsión de pares de electrones de capa de valencia (VSEPR) que describimos aquí se centra en los pares de electrones de unión y no unión presentes en la capa más externa (“valencia”) de un átomo que se conecta con dos o más átomos. Como todos los electrones, estos ocupan regiones del espacio que podemos visualizar como nubes de electrones —regiones de carga eléctrica negativa, también conocidas como orbitales — cuyo carácter preciso puede dejarse a teorías más detalladas
. 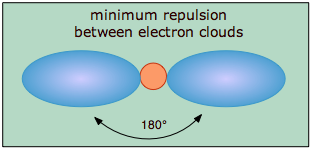
El modelo covalente de enlace químico supone que los pares de electrones responsables de la unión se concentran en la región de ritmo entre los átomos unidos. La idea fundamental de la teoría VSEPR es que estas regiones de carga eléctrica negativa se repelerán entre sí, haciendo que ellas (y por lo tanto los enlaces químicos que forman) se mantengan lo más alejadas posible. Así, las dos nubes de electrones contenidas en una simple molécula triatómica AX 2 se extenderán en direcciones opuestas; una separación angular de 180° coloca los dos orbitales de unión lo más lejos entre sí que puedan llegar. Por lo tanto, esperamos que los dos enlaces químicos se extiendan en direcciones opuestas, produciendo una molécula lineal.
Si el átomo central también contiene uno o más pares de electrones no enlazantes, estas regiones adicionales de carga negativa se comportarán de manera muy parecida a las asociadas con los átomos unidos. Los orbitales que contienen los diversos pares de unión y no unión en la capa de valencia se extenderán desde el átomo central en direcciones que minimizan sus repulsiones mutuas. Si el átomo central posee d-orbitales parcialmente ocupados, puede ser capaz de acomodar cinco o seis pares de electrones, formando lo que a veces se llama un “octeto expandido”.
Coordinación digonal y trigonal
Moléculas lineales
Como señalamos anteriormente, una molécula triatómica simple del tipo\(AX_2\) tiene sus dos orbitales de unión separados 180°, produciendo una molécula que describimos como de geometría lineal. Ejemplos de moléculas triatómicas para las cuales la teoría VSEPR predice una forma lineal son BeCl 2 (que, notará, no posee suficientes electrones para ajustarse a la regla del octeto) y CO 2. Si escribes la fórmula de punto electrónico para el dióxido de carbono, verás que los enlaces C-O son dobles enlaces. Esto no hace ninguna diferencia con la teoría de VSEPR; el átomo de carbono central todavía está unido a otros dos átomos, y las nubes de electrones que conectan los dos átomos de oxígeno están separadas 180°.


Moléculas trigonales
En una molécula AX 3 como BF 3, hay tres regiones de densidad electrónica que se extienden desde el átomo central. La repulsión entre estos será mínima cuando el ángulo entre dos cualesquiera sea (360° ÷ 3) = 120°. Esto requiere que los cuatro átomos estén en el mismo plano; la forma resultante se llama plano trigonal, o simplemente trigonal.

Coordinación tetraédrica
El metano, CH 4, contiene un átomo de carbono unido a cuatro hidrógenos. ¿Qué ángulo de enlace conduciría a la mayor separación posible entre las nubes de electrones asociadas a estos enlaces? En analogía con los dos casos anteriores, donde los ángulos de enlace eran 360°/2=180° y 360°/3=120°, podrías adivinar 360°/4=90°; si es así, estarías equivocado. Este último cálculo sería correcto si todos los átomos estuvieran obligados a estar en el mismo plano (veremos casos en los que esto suceda más adelante), pero aquí no existe tal restricción. En consecuencia, los cuatro enlaces equivalentes apuntarán en cuatro direcciones geométricamente equivalentes en tres dimensiones correspondientes a las cuatro esquinas de un tetraedro centrado en el átomo de carbono. El ángulo entre dos enlaces cualesquiera será de 109.5°. A esto se le llama coordinación tetraédrica.
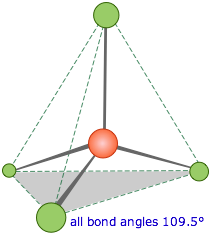
Esta es la geometría de coordinación más importante en Química: es imperativo que sea capaz de esbozar al menos una cruda vista en perspectiva de una molécula tetraédrica.
Es interesante señalar que la coordinación tetraédrica del carbono en la mayoría de sus compuestos orgánicos se elaboró en el siglo XIX sobre bases puramente geométricas y evidencias químicas, mucho antes de que se desarrollaran métodos directos de determinación de formas moleculares. Por ejemplo, se señaló que sólo hay un diclorometano, CH 2 Cl 2.

Si la coordinación alrededor del carbono fuera cuadrada, entonces tendría que haber dos isómeros de CH 2 Cl 2, como se muestra en el par de estructuras aquí. Las distancias entre los dos átomos de cloro serían diferentes, dando lugar a diferencias en las propiedades físicas permitiría distinguir y separar los dos isómeros.
La existencia de un solo tipo de molécula CH 2 Cl 2 significa que las cuatro posiciones que rodean al átomo de carbono son geométricamente equivalentes, lo que requiere una geometría de coordinación tetraédrica. Si estudias de cerca la figura tetraédrica, es posible que puedas convencerte de que representa la conectividad que se muestra en ambas estructuras “cuadradas” en la parte superior. Un modelo mecánico tridimensional de bola y varilla ilustraría esto muy claramente.
Cadenas de carbono coordinadas tetraédricamente
tetraedros unidos de extremo a extremo.
Se pueden construir cadenas de alcano similares que tienen la fórmula general H 3 C— (CH 2) n —CH 3 (o C n H 2 n +2); una vista de pentano, C 5 H 12, se muestra a continuación.

Observe que estos “hidrocarburos de cadena recta” (como a menudo se les conoce) tienen una estructura de “cadena principal” de carbono que no es realmente recta, como lo ilustra la figura en zig-zag que se usa frecuentemente para denotar estructuras hidrocarbonadas.
Geometría de coordinación y geometría molecular
El número de coordinación se refiere al número de pares de electrones que rodean un átomo dado; a menudo nos referimos a este átomo como el átomo central aunque este átomo no esté realmente ubicado en el centro geométrico de la molécula. Si todos los pares de electrones que rodean el átomo central son compartidos con átomos vecinos, entonces la geometría de coordinación es la misma que la geometría molecular. La aplicación de la teoría VSEPR reduce entonces al simple problema de nombrar (y visualizar) las formas geométricas asociadas con varios números de puntos que rodean un punto central (el átomo central) en los mayores ángulos posibles. Ambas clases de geometría llevan el nombre de las formas de las figuras geométricas imaginarias (en su mayoría polígonos sólidos regulares) que estarían centradas en el átomo central y tendrían un par de electrones en cada vértice.
Si uno o más de los pares de electrones que rodean al átomo central no se comparten con un átomo vecino (es decir, si es un par solitario), entonces la geometría molecular es más simple que la geometría de coordinación, y se puede elaborar inspeccionando un boceto de la figura de geometría de coordinación.
Coordinación tetraédrica con pares solitarios
En los ejemplos que hemos discutido hasta ahora, la forma de la molécula está definida por la geometría de coordinación; así el carbono en el metano está coordinado tetraédricamente, y hay un hidrógeno en cada esquina del tetraedro, por lo que la forma molecular también es tetraédrica.
El método AXE
Es práctica común representar patrones de unión por fórmulas “genéricas” como\(AX_4\),, etc.\(AX_2E_2\), en las que “X” significa pares de unión y “E” denota pares solitarios. Esta convención es conocida como el “Método AXE”.
Sin embargo, la geometría de unión no será tetraédrica cuando la capa de valencia del átomo central contenga electrones no enlazantes. La razón es que los electrones no enlazantes también están en orbitales que ocupan el espacio y repelen a los otros orbitales. Esto significa que al calcular el número de coordinación alrededor del átomo central, debemos contar tanto los átomos unidos como los pares no enlazados.
La molécula de agua:\(AX_2E_2\)
En la molécula de agua, el átomo central es O, y la fórmula de punto de electrones de Lewis predice que habrá dos pares de electrones no enlazantes. Por lo tanto, el átomo de oxígeno estará coordinado tetraédricamente, lo que significa que se asienta en el centro del tetraedro como se muestra a continuación.


Dos de las posiciones de coordinación están ocupadas por los pares de electrones compartidos que constituyen los enlaces O-H, y las otras dos por los pares no enlazantes. Así, aunque el átomo de oxígeno está coordinado tetraédricamente, la geometría de unión (forma) de la molécula H 2 O se describe como doblada .
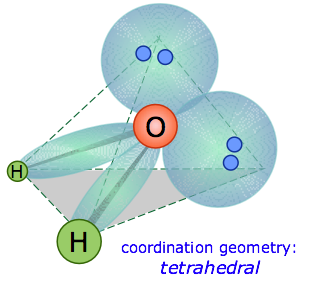
Existe una diferencia importante entre orbitales electrónicos enlazantes y no enlazantes. Debido a que un orbital no enlazante no tiene núcleo atómico en su extremo lejano para atraer la nube de electrones hacia él, la carga en dicho orbital se concentrará más cerca del átomo central. Como consecuencia, los orbitales no vinculantes ejercen más repulsión sobre otros orbitales que los orbitales vinculantes. Así, en H 2 O, los dos orbitales no adherentes empujan los orbitales de unión más cerca entre sí, haciendo que el ángulo H—O—H sea 104.5° en lugar del ángulo tetraédrico de 109.5°.

Amoníaco:\(AX_3E\)
La estructura electrón-punto de NH 3 coloca un par de electrones no enlazantes en la capa de valencia del átomo de nitrógeno. Esto significa que hay tres átomos unidos y un par solitario, para un número de coordinación de cuatro alrededor del nitrógeno, lo mismo que ocurre en H 2 O. Por lo tanto, podemos predecir que los tres átomos de hidrógeno estarán en las esquinas de un tetraedro centrado en el átomo de nitrógeno. El orbital de par solitario apuntará hacia la cuarta esquina del tetraedro, pero como esa posición estará vacante, la propia molécula NH 3 no puede ser tetraédrica. En cambio, asume una forma piramidal. Más precisamente, la forma es la de una pirámide trigonal (es decir, una pirámide que tiene una base triangular). Los átomos de hidrógeno están todos en el mismo plano, con el nitrógeno arriba (o abajo, o hacia un lado; ¡las moléculas por supuesto no saben nada de “arriba” o “abajo”!) El orbital más gordo que contiene los electrones no enlazantes empuja los orbitales de unión entre sí ligeramente, haciendo que los ángulos de enlace H—N—H sean de aproximadamente 107°.
Imagen generada por computadora de la molécula NH 3 que muestra potencial electrostático (rojo=+, azul=—.)
Átomos centrales con cinco enlaces
Los compuestos del tipo AX 5 están formados por algunos de los elementos del Grupo 15 de la tabla periódica; pCl 5 y AsF 5 son ejemplos.
¿En qué direcciones pueden disponerse cinco pares de electrones en el espacio para minimizar sus repulsiones mutuas? En los casos de los números de coordinación 2, 3, 4 y 6, podríamos imaginar que los pares de electrones se distribuyeron lo más lejos posible en la superficie de una esfera; para los dos números superiores, las formas resultantes corresponden al poliedro regular que tiene el mismo número de lados. El problema con la coordinación número 5 es que no existe tal cosa como un poliedro regular con cinco vértices.
Poliedros regulares
En 1758, el gran matemático Euler demostró que sólo hay cinco poliedros convexos regulares, conocidos como los sólidos platónicos: tetraedro (4 caras triangulares), octaedro (6 caras triangulares), icosaedro (20 caras triangulares), cubo (6 caras cuadradas) y dodecaedro (12 caras pentagonales). Se conocen ejemplos químicos de todos; la primera molécula icosaédrica,\(LaC_{60}\) (en la que el átomo de La tiene 20 vecinos C más cercanos) se preparó en 1986.
Además de los cinco sólidos regulares, puede haber 15 sólidos isogonales semi-regulares en los que las caras tienen diferentes formas, pero los ángulos de vértice son todos iguales. Estos principios geométricos son bastante importantes en la química estructural moderna.
La forma de PCl 5 y moléculas similares es una bipirámide trigonal. Esto consiste simplemente en dos pirámides de base triangular unidas de base a base. Tres de los átomos de cloro están en el plano del átomo central de fósforo (posiciones ecuatoriales), mientras que los otros dos átomos están por encima y por debajo de este plano (posiciones axiales). Los átomos ecuatoriales y axiales tienen diferentes relaciones geométricas con sus vecinos, y por lo tanto difieren ligeramente en su comportamiento químico.

En 5 moléculas coordinadas que contienen pares solitarios, estos orbitales no enlazantes (que recordarás están más cerca del átomo central y por lo tanto más propensos a ser repelidos por otros orbitales) residirán preferencialmente en el plano ecuatorial. Esto los colocará en ángulos de 90° con respecto a no más de dos orbitales de unión orientados axialmente.
Usando este razonamiento, podemos predecir que una molécula AX 4 E (es decir, una molécula en la que el átomo central A se coordina a otros cuatro átomos “X” y a un par de electrones no enlazantes) como SF 4 tendrá forma de “sierra de ver”; sustitución de más pares no enlazantes por átomos unidos reduce la coordinación bipiramidal triangular a formas moleculares aún más simples, como se muestra a continuación.

Coordinación octaédrica
Así como cuatro pares de electrones experimentan la mínima repulsión cuando se dirigen hacia las esquinas de un tetraedro, seis pares de electrones intentarán apuntar hacia las esquinas de un octaedro. Un octaedro no es una forma tan compleja como su nombre podría implicar; se trata simplemente de dos pirámides de base cuadrada unidas base a base. Deberías poder bosquejar esta forma así como la del tetraedro.
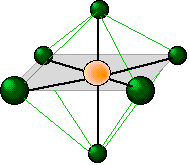
El plano sombreado que se muestra en esta molécula octaédricamente coordinada es solo uno de los tres planos equivalentes definidos por un eje de simetría cuádruple. Todos los ligandos son geométricamente equivalentes; no hay posiciones axiales y ecuatoriales separadas en una molécula AX 6.
Al principio, se podría pensar que un número de coordinación de seis es muy inusual; ciertamente viola la regla del octeto, y solo hay unas pocas moléculas (SF 6 es una) donde el átomo central es hexavalente. Resulta, sin embargo, que este es uno de los números de coordinación más comúnmente encontrados en la química inorgánica. Hay dos razones principales para esto:
- Muchos iones de metales de transición forman enlaces covalentes coordinados con átomos donantes de electrones de par solitario como N (en NH 3) y O (en H 2 O). Dado que los elementos de transición pueden tener una configuración externa de d 10 s 2, se pueden acomodar hasta seis pares de electrones alrededor del átomo central. Por lo tanto, un número de coordinación de 6 es bastante común en los hidratos de metales de transición, como el Fe (H 2 O) 6 3+.
- Aunque el átomo central de la mayoría de las moléculas está unido a menos de otros seis átomos, a menudo hay un número suficiente de electrones de pares solitarios para llevar el número total de pares de electrones a seis.
Coordinación octaédrica con pares solitarios
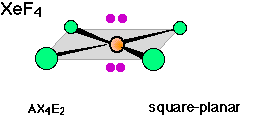
Existen ejemplos bien conocidos de átomos centrales de 6 coordenadas con 1, 2 y 3 pares solitarios. Así, las tres moléculas cuyas formas se representan a continuación poseen coordinación octaédrica alrededor del átomo central. Obsérvese también que la orientación de los planos sombreados que se muestran en las dos imágenes más a la derecha es arbitraria; dado que los seis vértices de un octaedro son idénticos, los planos bien podrían dibujarse en cualquiera de las tres posibles orientaciones verticales.

Resumen de VSEPR theory
El modelo VSEPR es extraordinariamente potente, considerando su gran simplicidad. Su aplicación a la predicción de estructuras moleculares se puede resumir de la siguiente manera:
- 1. Los pares de electrones que rodean un átomo central se repelen entre sí; esta repulsión se minimizará si los orbitales que contienen estos pares de electrones apuntan lo más lejos posible entre sí.
- 2. La geometría de coordinación alrededor del átomo central corresponde al poliedro cuyo número de vértices es igual al número de pares de electrones circundantes (número de coordinación). A excepción del caso especial de 5, y los casos triviales de 2 y 3, la forma será uno de los poliedros regulares.
- 3. Si algunos de los pares de electrones no se unen, la forma de la molécula será más simple que la del poliedro de coordinación.
- 4. Los orbitales que contienen electrones no enlazantes están más concentrados cerca del átomo central y, por lo tanto, ofrecen más repulsión que unir pares a otros orbitales.
Si bien la teoría VSEPR es bastante buena para predecir las formas generales de la mayoría de las moléculas, no puede dar detalles exactos. Por ejemplo, no explica por qué el ángulo de unión en H 2 O es de 104.5°, sino que en H 2 S es de aproximadamente 90°. Esto no es sorprendente, considerando que el énfasis está en las repulsiones electrónicas, sin tener en cuenta la naturaleza detallada de los orbitales que contienen los electrones, y por lo tanto de los propios enlaces.
La teoría Valence Shell Electron Repulsion fue desarrollada en la década de 1960 por Ronald Gillespie de la Universidad McMaster (Hamilton, Ontario, Canadá) y Ronald Nyholm (University College, Londres). Es notable que lo que parece ser una extensión lógica del modelo de unión de pares de electrones compartidos Lewis de 1916 tardó tanto en formularse; se presentó por primera vez en el artículo clásico de los autores Inorganic Stereochemistry publicado en 1957 Chemical Society of London Quarterly Reseñas (Vol 11, pg 339). Aunque es posterior a los modelos mecánicos cuánticos más completos, es fácil de entender y dentro de una década se había convertido en un elemento básico de cada curso universitario de química de primer año.


