9.8: Teoría Orbital Molecular
- Page ID
- 70659
Asegúrese de comprender a fondo las siguientes ideas esenciales
- ¿De qué manera fundamental se diferencia el modelo orbital molecular de los otros modelos de unión química que se han descrito en estas lecciones?
- Explique cómo los orbitales ligantes y antiligantes surgen de los orbitales atómicos, y cómo difieren físicamente.
- Describir la diferencia esencial entre un sigma y un orbital molecular pi.
- Definir el orden de los bonos y exponer su significado.
- Construir un “diagrama orbital molecular” del tipo mostrado en esta lección para una molécula diatómica simple, e indicar si la molécula o sus iones positivos y negativos deben ser estables.
El modelo orbital molecular es, con mucho, el más productivo de los diversos modelos de unión química, y sirve como base para la mayoría de los cálculos cuantitativos, incluyendo aquellos que conducen a muchas de las imágenes generadas por computadora que se han visto en otras partes de estas unidades. En su pleno desarrollo, la teoría orbital molecular involucra muchas matemáticas complicadas, pero las ideas fundamentales detrás de ella se entienden con bastante facilidad, y esto es todo lo que intentaremos lograr en esta lección.
Esta es una gran desviación de los modelos simples de Lewis y VSEPR que se basaron en los orbitales de un solo centro de átomos individuales. El modelo de hibridación más sofisticado reconoció que estos orbitales serán modificados por su interacción con otros átomos. Pero todos estos modelos de enlace de valencia, como generalmente se les llama, son muy limitados en su aplicabilidad y poder predictivo, porque no reconocen que la distribución de los electrones de valencia agrupados se rige por la totalidad de los centros positivos.
Orbitales Moleculares
La unión química ocurre cuando las fuerzas netas de atracción entre un electrón y dos núcleos exceden la repulsión electrostática entre los dos núcleos. Para que esto suceda, el electrón debe estar en una región del espacio a la que llamamos la región de unión. Por el contrario, si el electrón está apagado hacia un lado, en una región anti-unión, en realidad se suma a la repulsión entre los dos núcleos y ayuda a alejarlos.
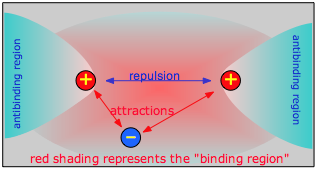
La forma más fácil de visualizar un orbital molecular es comenzar imaginando dos átomos aislados y los orbitales de electrones que cada uno tendría por separado. Estos son solo los orbitales de los átomos separados, por sí mismos, que ya entendemos. Luego intentaremos predecir la manera en que estos orbitales atómicos interactúan a medida que gradualmente acercamos los dos átomos. Finalmente, llegaremos a algún punto donde la distancia internuclear corresponde a la de la molécula que estamos estudiando. Los orbitales correspondientes serán entonces los orbitales moleculares de nuestra nueva molécula.
El ion de la molécula de hidrógeno: la molécula más simple
Para ver cómo funciona esto, consideraremos la molécula más simple posible,\(\ce{H2^{+}}\). Se trata del ion de molécula de hidrógeno, que consiste en dos núcleos de carga +1, y un solo electrón compartido entre ellos.

A medida que dos núcleos H se mueven uno hacia el otro, los orbitales atómicos de 1 s de los átomos aislados se fusionan gradualmente en un nuevo orbital molecular en el que la mayor densidad de electrones cae entre los dos núcleos. Dado que esta es solo la ubicación en la que los electrones pueden ejercer la fuerza más atractiva sobre los dos núcleos simultáneamente, esta disposición constituye un orbital molecular de unión. Considerándolo como una región tridimensional del espacio, vemos que es simétrica alrededor de la línea de centros entre los núcleos; de acuerdo con nuestra nomenclatura habitual, nos referimos a esto como orbital σ (sigma).
Orbitales moleculares de unión y antiadhesión
Hay una dificultad menor: comenzamos con dos orbitales (los orbitales atómicos de 1 s), y terminamos con una sola órbita. Ahora según las reglas de la mecánica cuántica, los orbitales no pueden simplemente aparecer y desaparecer a nuestra conveniencia. Por un lado, esto plantearía la cuestión de ¿a qué distancia internuclear cambiamos repentinamente de tener dos orbitales, a tener solo uno? Resulta que cuando los orbitales interactúan, son libres de cambiar sus formas, pero siempre debe haber el mismo número. Esta es solo otra forma de decir que siempre debe haber el mismo número de posibles conjuntos permitidos de números cuánticos de electrones.
¿Cómo podemos encontrar el orbital faltante? Para responder a esta pregunta, debemos volver al carácter ondular de los orbitales que desarrollamos en nuestro tratamiento anterior del átomo de hidrógeno. Probablemente estés consciente de que los fenómenos de las olas como las ondas sonoras, las ondas de luz o incluso las olas del océano pueden combinarse o interactuar entre sí de dos maneras: pueden reforzarse entre sí, dando como resultado una ola más fuerte, o pueden interferir y destruirse parcialmente entre sí. Algo más o menos similar ocurre cuando las “ondas de materia” correspondientes a los dos orbitales separados de hidrógeno 1 s interactúan; ambas combinaciones dentro y fuera de fase son posibles, y ambas ocurren. La interacción de refuerzo en fase produce el orbital de unión que acabamos de considerar. El otro, correspondiente a la combinación fuera de fase de los dos orbitales, da lugar a un orbital molecular que tiene su mayor probabilidad electrónica en lo que es claramente la región antiunión del espacio. Por lo tanto, este segundo orbital se denomina orbital antiadhesión.

Cuando las dos funciones de onda de 1 s se combinan fuera de fase, las regiones de alta probabilidad de electrones no se fusionan. De hecho, los orbitales actúan como si realmente se repelen entre sí. Observe particularmente que existe una región de espacio exactamente equidistante entre los núcleos en la que la probabilidad de encontrar el electrón es cero. Esta región se denomina superficie nodal, y es característica de los orbitales antiadhesión. Debe quedar claro que cualquier electrón que se encuentre en un orbital antienlace no puede contribuir posiblemente a la formación de enlaces; de hecho, se opondrán activamente a ello.
Vemos, entonces, que cada vez que dos orbitales, originalmente sobre átomos separados, comienzan a interactuar a medida que empujamos los dos núcleos uno hacia el otro, estos dos orbitales atómicos se fusionarán gradualmente en un par de orbitales moleculares, uno de los cuales tendrá carácter de unión, mientras que el otro será antienlace. En un tratamiento más avanzado, sería bastante fácil demostrar que este resultado se deriva de manera bastante natural de la naturaleza ondulada de los orbitales combinantes.
¿Cuál es la diferencia entre estos dos tipos de orbitales, en lo que respecta a sus energías potenciales? Más precisamente, ¿qué tipo de orbital permitiría que un electrón estuviera a una energía potencial menor? Claramente, la energía potencial disminuye a medida que el electrón se mueve hacia una región que le permite “ver” la cantidad máxima de carga positiva. En una molécula diatómica simple, esto será en la región internuclear, donde el electrón puede estar simultáneamente cerca de dos núcleos. Por lo tanto, el orbital de unión tendrá la menor energía potencial.
Diagramas orbitales moleculares
Este esquema de orbitales ligantes y antiligantes suele ser representado por un diagrama orbital molecular como el que se muestra aquí para el ion dihidrógeno H 2 +. Los electrones de valencia atómica (mostrados en cuadros a la izquierda y a la derecha) llenan los orbitales moleculares de menor energía antes que los superiores, tal como es el caso de los orbitales atómicos. Así, el electrón único en esta más simple de todas las moléculas entra en el orbital de unión, dejando vacío el orbital antienlace.
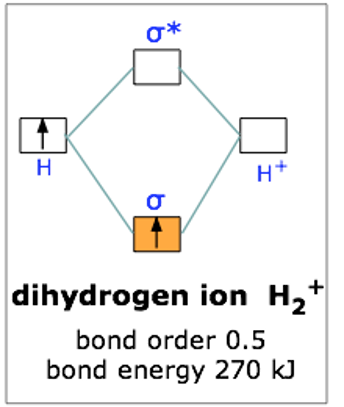
Dado que cualquier orbital puede contener un máximo de dos electrones, el orbital de unión en H 2 + está solo medio lleno. Sin embargo, este solo electrón es suficiente para reducir la energía potencial de un mol de pares de núcleos de hidrógeno en 270 kJ, suficiente para que se adhieran y se comporten como una especie molecular distinta. Aunque H 2 + es estable en este sentido energético, pasa a ser una molécula extremadamente reactiva, tanto que incluso reacciona consigo misma, por lo que estos iones no se encuentran comúnmente en la química cotidiana.
Dihidrógeno
Si un electrón en el orbital de enlace es propicio para la formación de enlaces, ¿podrían ser aún mejores dos electrones? Podemos arreglar esto combinando dos átomos de hidrógeno, dos núcleos y dos electrones. Ambos electrones entrarán en el orbital de unión, como se representa en la Figura.

Recordamos que un electrón redujo la energía potencial de los dos núcleos en 270 kJ/mol, por lo que podríamos esperar que dos electrones produzcan el doble de esta estabilización, o 540 kJ/mol.
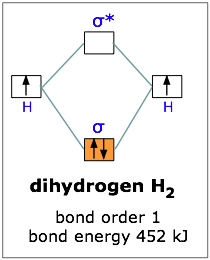
Experimentalmente, uno encuentra que solo se necesitan 452 kJ para romper un mol de moléculas de hidrógeno. La razón por la que la energía potencial no se redujo en la cantidad total es que la presencia de dos electrones en un mismo orbital da lugar a una repulsión que actúa contra la estabilización. Este es exactamente el mismo efecto que vimos al comparar las energías de ionización de los átomos de hidrógeno y helio.
Dihelio
Con dos electrones todavía estamos por delante, así que intentemos por tres. El ion dihelio positivo es una molécula de tres electrones. Podemos pensar que contiene dos núcleos de helio y tres electrones. Esta molécula es estable, pero no tan estable como el dihidrógeno; la energía requerida para romper He 2 + es de 301 kJ/mol. La razón de esto debería ser obvia; dos electrones se acomodaron en el orbital de unión, pero el tercer electrón debe entrar en la siguiente ranura superior, que resulta ser el orbital sigma antienlace. La presencia de un electrón en este orbital, como hemos visto, da lugar a un componente repulsivo que actúa contra, y parcialmente cancela, el efecto atractivo del orbital de unión relleno.

Llevando nuestro proceso de acumulación un paso más allá, podemos ver las posibilidades de combinar con átomos de helio para formar dihelio. Ahora debería poder predecir que He 2 no puede ser una molécula estable; la razón, por supuesto, es que ahora tenemos cuatro electrones, dos en el orbital de unión y dos en el orbital antienlace. El orbital uno cancela casi exactamente el efecto del otro. Experimentalmente, la energía de enlace del dihelio es de solo .084 kJ/mol; esto no es suficiente para mantener los dos átomos juntos en presencia de movimiento térmico aleatorio a temperaturas ordinarias, por lo que el dihelio se disocia tan rápido como se forma, y por lo tanto no es una especie química distinta.
Moléculas diatómicas con átomos de segunda fila
Las cuatro moléculas más simples que hemos examinado hasta ahora involucran orbitales moleculares derivados de dos orbitales atómicos de 1 s. Si queremos extender nuestro modelo a átomos más grandes, también tendremos que lidiar con orbitales atómicos superiores. Un principio muy simplificador aquí es que solo se necesitan considerar los orbitales de valencia-concha. Orbitales atómicos internos como 1 s están profundamente dentro del átomo y bien protegidos del campo eléctrico de un núcleo vecino, de modo que estos orbitales conservan en gran medida su carácter atómico cuando se forman enlaces.
Dilitio
Por ejemplo, cuando el litio, cuya configuración es 1 s 2 2 s 1, se une consigo mismo para formar Li 2, podemos olvidarnos de los orbitales atómicos de 1 s y considerar solo los orbitales de unión σ y antiadhesión. Como no hay suficientes electrones para poblar el orbital antienlace, las fuerzas atractivas ganan y tenemos una molécula estable.

La energía de enlace del dilitio es de 110 kJ/mol; observe que este valor es menor que la mitad de la energía de enlace de 270 kJ en dihidrógeno, que también tiene dos electrones en un orbital de enlace. La razón, por supuesto, es que el orbital de 2 s de Li está mucho más lejos de su núcleo que el orbital de 1 s de H, y esto es igualmente cierto para los orbitales moleculares correspondientes. Es una regla general, entonces, que cuanto mayor sea el átomo parental, menos estable será la molécula diatómica correspondiente.
Hidruro de litio
Todas las moléculas que hemos considerado hasta ahora son homonucleares; están constituidas por un tipo de átomo. Como ejemplo de una molécula heteronuclear, echemos un vistazo a un ejemplo muy simple: el hidruro de litio. El hidruro de litio es una molécula estable, aunque altamente reactiva. El diagrama muestra cómo los orbitales moleculares en hidruro de litio pueden relacionarse con los orbitales atómicos de los átomos progenitores. Una cosa que hace que este diagrama se vea diferente de los que hemos visto anteriormente es que los orbitales atómicos progenitores tienen energías muy diferentes; la mayor carga nuclear del litio reduce la energía de su orbital de 1 s a un valor muy por debajo del orbital de hidrógeno de 1 s.

Hay dos orbitales atómicos ocupados en el átomo de litio, y sólo uno en el hidrógeno. ¿Con cuál de los orbitales de litio interactúa el orbital del hidrógeno 1 s? El orbital de litio 1 s es el orbital de menor energía en el diagrama. Debido a que este orbital es tan pequeño y retiene sus electrones tan fuertemente, no contribuye a la unión; necesitamos considerar solo el orbital de 2 s de litio que se combina con el orbital de 1 s de hidrógeno para formar el par habitual de orbitales sigma y antienlace. De los cuatro electrones en litio e hidrógeno, dos se retienen en el orbital de litio 1 s, y los dos restantes residen en el orbital σ que constituye el enlace covalente Li—H.
La molécula resultante es 243 kJ/mol más estable que los átomos progenitores. Como cabría esperar, la energía de enlace de la molécula heteronuclear está muy cerca del promedio de las energías de las moléculas homonucleares correspondientes. En realidad, resulta que la forma correcta de hacer esta comparación es tomar la media geométrica, más que la media aritmética, de las dos energías de enlace. La media geométrica es simplemente la raíz cuadrada del producto de las dos energías.
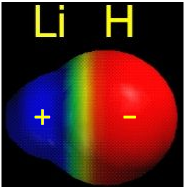
La media geométrica de las energías de enlace H 2 y Li 2 es 213 kJ/mol, por lo que parece que la molécula de hidruro de litio es 30 kJ/mol más estable de lo que “se supone” que es. Esto se atribuye al hecho de que los electrones en el orbital de enlace 2σ no son igualmente compartidos entre los dos núcleos; el orbital está ligeramente sesgado de manera que los electrones son atraídos algo más hacia el átomo de hidrógeno. Esta polaridad de enlace, que consideramos con cierto detalle cerca del inicio de nuestro estudio del enlace covalente, surge del mayor poder de atracción de electrones del hidrógeno, consecuencia del tamaño muy pequeño de este átomo. Los electrones pueden tener una menor energía potencial si están ligeramente más cerca del extremo de hidrógeno de la molécula de hidruro de litio. Cabe señalar, sin embargo, que los electrones están, en promedio, también más cerca del núcleo de litio, en comparación con donde estarían en el orbital de 2 s del átomo de litio aislado. ¡Entonces parece que todo el mundo gana y nadie pierde aquí!
\(\Sigma\)y\(\pi\) orbitales
Las moléculas que hemos considerado hasta ahora están compuestas por átomos que no tienen más de cuatro electrones cada uno; por lo tanto, nuestros orbitales moleculares se han derivado únicamente de orbitales atómicos de tipo s. Si queremos aplicar nuestro modelo a moléculas que involucran átomos más grandes, debemos analizar de cerca la forma en que los orbitales de tipo p interactúan también. Si bien se espera que dos orbitales p atómicos se dividan en orbitales ligantes y antiadherentes como antes, resulta que la extensión de esta división, y por lo tanto las energías relativas de los orbitales moleculares resultantes, dependen en gran medida de la naturaleza del orbital p particular que está involucrado.
Recordará que existen tres posibles orbitales p para cualquier valor del número cuántico principal. También hay que recordar que los orbitales p no son esféricos como los orbitales s, sino que son alargados, y por lo tanto poseen propiedades direccionales definidas. Los tres orbitales p corresponden a las tres direcciones del espacio cartesiano, y frecuentemente se designan p x, p y pz, para indicar el eje a lo largo del cual se alinea el orbital. Por supuesto, en el átomo libre, donde no se define ningún sistema de coordenadas, todas las direcciones son equivalentes, y también lo son los orbitales p. Pero cuando el átomo está cerca de otro átomo, el campo eléctrico debido a ese otro átomo actúa como punto de referencia que define un conjunto de direcciones. La línea de centros entre los dos núcleos se toma convencionalmente como eje x. Si esta dirección se representa horizontalmente en una hoja de papel, entonces el eje y está en la dirección vertical y el eje z sería normal a la página.
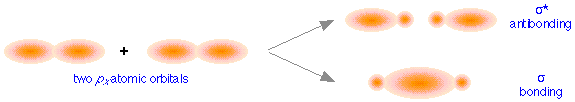
Estas diferencias direccionales conducen a la formación de dos clases diferentes de orbitales moleculares. La figura anterior muestra cómo interactúan dos orbitales atómicos p x. En muchos sentidos, los orbitales moleculares resultantes son similares a lo que obtuvimos cuando se combinaron los orbitales atómicos; el orbital de enlace tiene una gran densidad de electrones en la región entre los dos núcleos, y por lo tanto corresponde a la menor energía potencial. En la combinación fuera de fase, la mayor parte de la densidad electrónica está lejos de la región internuclear, y como antes, hay una superficie exactamente a mitad de camino entre los núcleos que corresponde a densidad electrónica cero. Esto es claramente un orbital antienlace— nuevamente, en forma general, muy parecido al tipo que vimos en el hidrógeno y moléculas similares. Al igual que los derivados de orbitales s-atómicos, estos orbitales moleculares son orbitales σ (sigma).
Los orbitales sigma son simétricos cilindricamente con respecto a la línea de centros de los núcleos; esto significa que si pudieras mirar hacia abajo esta línea de centros, la densidad de electrones sería la misma en todas las direcciones.

orbitales, obtenemos los pares de unión y antiunión que esperaríamos, pero los orbitales moleculares resultantes tienen una simetría diferente: en lugar de ser rotacionalmente simétricos alrededor de la línea de centros, estos orbitales se extienden en ambas direcciones perpendiculares desde esta línea de centros. Los orbitales que tienen esta simetría más complicada se denominan orbitales π (pi). Hay dos de ellos, π y y π z que difieren solo en orientación, pero por lo demás completamente equivalentes.
Las diferentes propiedades geométricas de los orbitales π y σ hacen que estos últimos orbitales se dividan más que los orbitales π, de manera que el orbital σ* antienlace siempre tiene la mayor energía. El orbital de unión σ puede ser mayor o menor que los orbitales de enlace π, dependiendo del átomo particular.
Diatómica de segunda fila
Si combinamos los esquemas de división para los orbitales 2 s y 2 p, podemos predecir el orden de enlace en todas las moléculas diatómicas e iones compuestos por elementos en la primera fila completa de la tabla periódica. Recordemos que solo se deben considerar los orbitales de valencia de los átomos; como vimos en los casos de hidruro de litio y dilitio, los orbitales internos permanecen fuertemente unidos y conservan su carácter atómico localizado.
Dicarbono
El carbono tiene cuatro electrones de capa exterior, dos de 2 s y dos de 2 p. Para dos átomos de carbono, por lo tanto, tenemos un total de ocho electrones, que pueden acomodarse en los primeros cuatro orbitales moleculares. Los dos más bajos son el par de enlace derivado de 2 s y el par antienlace, por lo que los “primeros” cuatro electrones no hacen ninguna contribución neta a la unión. Los otros cuatro electrones entran en el par de orbitales de unión pi, y no hay más electrones para los orbitales antienlace, así que esperaríamos que la molécula de dicarbono sea estable, y lo es. (Pero al ser extremadamente reactivo, se conoce sólo en fase gaseosa.)

Recordarán que un par de electrones compartidos entre dos átomos constituye un enlace químico “sencillo”; esta es la definición original de Lewis del enlace covalente. En C 2 hay dos parís de electrones en los orbitales de enlace π, entonces tenemos lo que equivale a un doble enlace aquí; en otras palabras, el orden de enlace en dicarbono es dos.
Dioxígeno
La configuración electrónica del oxígeno es de 1 s 2 2 s 2 2 p 4. En O 2, por lo tanto, necesitamos acomodar doce electrones de valencia (seis de cada átomo de oxígeno) en orbitales moleculares. Como se puede ver en el diagrama, esto coloca dos electrones en orbitales antiligantes. Cada uno de estos electrones ocupa un orbital π* separado porque esto conduce a una menor repulsión electrón-electrón (Regla de Hund).
La energía de enlace del oxígeno molecular es 498 kJ/mol. Esto es más pequeño que la energía de enlace de 945 kJ de N 2, lo que no es sorprendente, considerando que el oxígeno tiene dos electrones en un orbital antienlace, en comparación con el del nitrógeno.
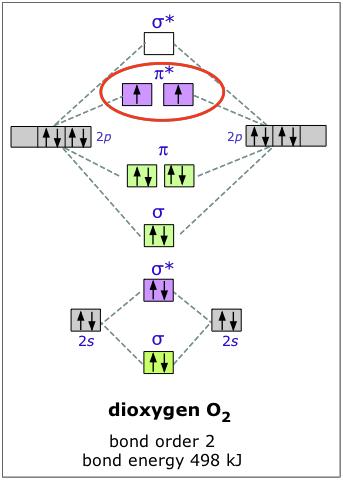
Los dos electrones desapareados de la molécula de dioxígeno confieren a esta sustancia una propiedad inusual y distintiva: O 2 es paramagneti c. El paramagnetismo del oxígeno se puede demostrar fácilmente vertiendo líquido O 2 entre los polos de un fuerte imán permanente; la corriente líquida queda atrapado por el campo y llena el espacio entre los polos.
Dado que el oxígeno molecular contiene dos electrones en un orbital antienlace, podría ser posible hacer que la molécula sea más estable eliminando uno de estos electrones, aumentando así la relación de unión a electrones antienlace en la molécula. Tal como cabría esperar, y de acuerdo con nuestro modelo, O 2 + tiene una energía de enlace superior a la del dioxígeno neutro; la eliminación de un electrón en realidad nos da una molécula más estable. Esto constituye una muy buena prueba de nuestro modelo de orbitales de unión y antiadhesión. De la misma manera, agregar un electrón a O 2 resulta en un debilitamiento del enlace, como lo demuestra la menor energía de enlace de O 2 —. No se conoce la energía de enlace en este ion, pero la longitud del enlace es mayor, y esto es indicativo de una menor energía de enlace. Estos dos iones dioxígeno, por cierto, son altamente reactivos y solo se pueden observar en la fase gaseosa.


