13.2: Ácidos y Bases Monopróticos Fuertes
- Page ID
- 70647
Asegúrese de comprender a fondo los siguientes conceptos esenciales que se han presentado anteriormente.
- Estimar el pH de una solución de un ácido o base fuerte, dada su concentración.
- Explicar la distinción entre la concentración de una sustancia y su actividad en una solución.
- Describir el origen y los efectos del emparejamiento iónico en soluciones concentradas de ácidos fuertes.
- Nombra y escribe fórmulas para los cuatro principales ácidos fuertes.
A una buena aproximación, los ácidos fuertes, en las formas que encontramos en el laboratorio y en gran parte del mundo industrial, no tienen existencia real; todos son realmente soluciones de\(\ce{H3O^{+}}\). Entonces, si lo piensas, ¡las etiquetas de esas botellas de reactivo que ves en el laboratorio no son estrictamente ciertas! Sin embargo, si el ácido fuerte está altamente diluido, la cantidad de\(\ce{H3O^{+}}\) éste contribuye a la solución se vuelve comparable a la que deriva de la autoprotólisis del agua. Bajo estas condiciones, necesitamos desarrollar una forma más sistemática de elaborar concentraciones de equilibrio.
A concentraciones moderadas, olvídate de los equilibrios
Un ácido fuerte, recordarás, es uno que es más fuerte que el ion hidronio\(\ce{H3O^{+}}\). Esto significa que en presencia de agua, el protón sobre un ácido fuerte como el HCl “caerá” en el “sumidero” proporcionado por H 2 O, convirtiendo este último en su ácido conjugado\(\ce{H3O^{+}}\). En otras palabras,\(\ce{H3O^{+}}\) es el ácido más fuerte que puede existir en solución acuosa.
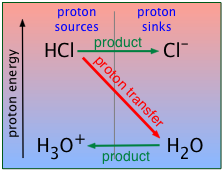
Como explicamos en la lección anterior, todos los ácidos fuertes parecen ser igualmente fuertes en solución acuosa porque siempre hay muchas moléculas de H 2 O para aceptar sus protones. A esto se le llama el “efecto nivelador”.
Esto simplifica enormemente nuestro tratamiento de los ácidos fuertes porque no hay necesidad de lidiar con equilibrios como para el ácido clorhídrico
\[\ce{HCl + H_2O → H_3O^{+} + Cl^{–}}\]
Las constantes de equilibrio para tales reacciones son tan abrumadoramente grandes que generalmente podemos considerar que las concentraciones de especies ácidas como “HCl” son indistinguibles de cero. Como veremos más adelante, esto no es estrictamente cierto para soluciones altamente concentradas de ácidos fuertes (Figura\(\PageIndex{3}\)).
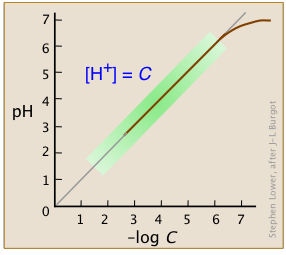
En el rango normal de concentraciones con las que comúnmente trabajamos (indicado por el sombreado verde en esta parcela), el pH de una solución ácida fuerte viene dado por el logaritmo negativo de su concentración en mol L —1. Tenga en cuenta que en soluciones muy diluidas, la parcela se nivela, demostrando que esta sencilla relación se descompone; ¡no hay forma de que pueda alcalinizar la solución diluyendo un ácido!
¿Cuál será el pH de una solución 0.025 mol/l de ácido clorhídrico?
Solución
Si asumimos que toda la concentración de hidronio se origina a partir del ácido agregado. Entonces
\[\ce{H3O^{+}}\]
y nos encontramos con el logaritmo negativo de la concentración
\[pH = -\log_{10} [\ce{H3o^{+}}] = –\log_{10} 0.025 = 1.6\]
Dado que este pH está tan lejos de 7, nuestra suposición es razonable.
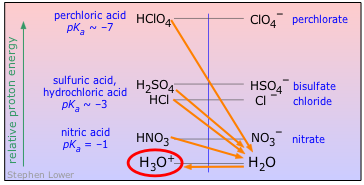
Ácidos Fuertes Principales
Los ácidos minerales son aquellos que son totalmente inorgánicos. No todos los ácidos minerales son fuertes; los ácidos bórico y carbónico son ejemplos comunes de los muy débiles. Sin embargo, en el uso ordinario, el término suele implicar uno de los que se describen a continuación. A excepción del ácido perclórico, que requiere un manejo especial, todos estos son ampliamente utilizados en la industria y casi siempre se encuentran en laboratorios de química. La mayoría se conocen desde la antigüedad
| ácido | nombre | pK a | base | pK b |
|---|---|---|---|---|
| HClO 4 | ácido perclórico | ~ —7 | ClO 4 — | ~ 21 |
| HCl | ácido clorhídrico | ~ —7 | Cl — | ~ 17 |
| H 2 SO 4 | ácido sulfúrico | ~ —7 | HSO 4 — | ~ 17 |
| HNO 3 | ácido nítrico | —1 | NO 3 — | 15 |
| H 3 O + | ión hidronio | H 2 O | 14 | |
Debes conocer los nombres y fórmulas de los cuatro ácidos minerales fuertes ampliamente encontrados.
- Ácido clorhídrico\(HCl\): A diferencia de los otros ácidos minerales fuertes, no existe compuesto puro “ácido clorhídrico”. Uno de los ácidos más utilizados, el ácido clorhídrico se suele vender como una solución al 37% de ebullición constante de gas de cloruro de hidrógeno en agua, haciendo que su concentración sea de unos 10 M. Aunque son posibles concentraciones más altas, las altas presiones parciales de HCl en equilibrio con la solución dificultan su almacenamiento, envío y trabajo con ellos. El ácido clorhídrico de grado comercial a menudo se llama ácido muriático.
- Ácido nítrico\(HNO_3\): El ácido nítrico concentrado es una solución al 68% de ebullición constante de HNO 3 en agua, correspondiente a aproximadamente 11M. Aunque el ácido en sí es incoloro, su lenta descomposición en NO 2 (especialmente en presencia de luz) a menudo resulta en un color amarillo o naranja. Las soluciones más concentradas se venden como “ácido nítrico fumante”; una forma, disponible como “ácido nítrico fumante blanco” o “ácido nítrico anhidro” contiene 97.5% de HNO 3 y solo 2% de agua; el resto consiste en NO 2 disuelto. El HNO 3 puro forma cristales que se funden a —42°C. Además de ser un ácido fuerte, el ácido nítrico a altas concentraciones actúa como un poderoso agente oxidante, una propiedad que explica su uso como combustible para cohetes.
- Ácido perclórico\(HClO_4\): Este es el más fuerte de los ácidos minerales, gracias a la acción de extracción de electrones de los átomos de oxígeno que facilitan energéticamente que HClO 4 pierda su protón. Su forma comercial habitual es una solución de 72.5% de ebullición constante en agua. El ácido perclórico concentrado es un poderoso agente oxidante que puede reaccionar explosivamente con materiales orgánicos y ciertos metales. Su uso en el laboratorio requiere un manejo especial. Una explosión en 1947 de una cuba de 1000 litros de HClo 4 en una planta de galvanoplastia de Los Ángeles mató a 17 personas y dañó más de 250 viviendas y otros edificios.
- Ácido sulfúrico\(H_2SO_4\): El ácido sulfúrico es, con mucho, el ácido más importante desde el punto de vista industrial, y también es el más concentrado disponible. El ácido sulfúrico “concentrado” contiene 98% en peso de H 2 SO 4; su densidad de 1.83 kg/L y su viscosidad similar al aceite reflejan esta alta concentración. "100% H 2 SO 4" (que se puede preparar Sin embargo, no es estable) en realidad contiene una variedad de otras especies, todo en equilibrio con H 2 SO 4. Estos incluyen los productos de autoprotólisis de H 2 S 2 O 7, H 2 S 4 O 13 y H 2 SO 4, H 3 SO 4 — y HSO 4 +.
Super ácidos
Existe una clase de súper ácidos que son más fuertes que algunos de los ácidos minerales comunes. Según la definición clásica, un superácido es un ácido con una acidez mayor que la del ácido sulfúrico 100% puro. Algunos, como el ácido fluorosulfurico,\(FSO_3H\) están disponibles comercialmente. Los superácidos fuertes se preparan mediante la combinación de un ácido fuerte de Lewis y un ácido fuerte de Brønsted. El súper ácido más fuerte conocido es el ácido fluoroantimónico (\(H_2FSbF_6\)). Este ácido es tan corrosivo que los humos por sí solos disolverán campanas de humos enteras, vasos de precipitados de vidrio y plástico, piel humana, hueso y la mayoría de compuestos sintéticos.
Bases fuertes
Las únicas bases fuertes que se encuentran comúnmente son soluciones de hidróxidos del Grupo 1, principalmente NaOH y KOH. A diferencia de la mayoría de los hidróxidos metálicos, estos sólidos son altamente solubles en agua y, por lo tanto, pueden producir soluciones concentradas de iones hidróxido, la base más fuerte que puede existir en el agua, el último sumidero de protones acuáticos. El hidróxido de sodio es, con mucho, la más importante de estas bases fuertes; sus nombres comunes “lejía”, “soda cáustica” (o, en la industria, a menudo solo “cáustica”), reflejan los diversos usos del NaOH.
El NaOH sólido generalmente se vende en forma de pellets. Cuando se exponen al aire, se humedecen (delicuescencia) y absorben CO 2, contaminándose con carbonato de sodio. El NaOH es el más soluble de los hidróxidos del Grupo 1, disolviéndose en menos de su propio peso de agua (111 g/100 ml) para formar una solución 2.8 M/L a 20°C; sin embargo, al igual que con los ácidos fuertes, el pH de dicha solución no puede calcularse de manera confiable a partir de una concentración tan alta.
Ácidos a altas concentraciones
A concentraciones más altas, las interacciones intermoleculares y el emparejamiento iónico pueden hacer que la concentración efectiva (conocida como la actividad) de\(\ce{H3O^{+}}\) se desvíe del valor correspondiente a la concentración nominal o “analítica” del ácido. Las actividades son importantes porque solo estas funcionan correctamente en los cálculos de equilibrio. Además, el pH se define como el logaritmo negativo de la actividad del ión hidrógeno, no su concentración. La relación entre la concentración de una especie y su actividad se expresa por el coeficiente de actividad\(\gamma\):
\[a = \gamma C\]
A medida que una solución se diluye, se\(\gamma\) acerca a la unidad. A concentraciones iónicas que no excedan aproximadamente 2 M, generalmente se pueden usar concentraciones de ácidos fuertes típicos en lugar de actividades sin errores graves. Obsérvese que las actividades de iones individuales distintas a\(\ce{H3O^{+}}\) no pueden determinarse, por lo que los coeficientes de actividad en las soluciones iónicas son siempre el promedio, o la media, de los de las especies iónicas presentes. Esta cantidad se denota como\(\gamma_±\).
| molaridad | \(\gamma_±\) |
|---|---|
| 0.0005 | 0.975 |
| 0.01 | 0.904 |
| 0.10 | 0.796 |
| 1 | 0.809 |
| 2 | 1.01 |
| 5 | 2.38 |
| 10 | 10.44 |
| 12 | 17.25 |
Debido a que no se pueden medir las actividades de iones individuales, estos valores medios son los más cercanos a los que podemos llegar\(\{H^+\}\) en soluciones de ácidos fuertes.
La actividad es importante para las muestras concentradas
La actividad es una consideración práctica cuando se trata de ácidos minerales fuertes que están disponibles en concentraciones de 10 M o mayores.
En una solución 12 M de ácido clorhídrico, por ejemplo, el coeficiente medio de actividad iónica es 17.25. Esto significa que bajo estas condiciones con [H 3 O +] = 12 M, la actividad {H 3 O +} = 12 × 17.25 = 207, correspondiente a un pH de aproximadamente —2.3, en lugar de —1.1 como podría predecirse si se estuvieran utilizando concentraciones.
Estos coeficientes de actividad muy altos también explican otro fenómeno: por qué se puede detectar el olor de HCl (g) sobre una solución concentrada de ácido clorhídrico a pesar de que este ácido está supuestamente 100% disociado. Resulta que la actividad {HCl} (que representa la “tendencia a escapar” del HCl (g) de la solución) es casi 49,000 para una solución de 10 M! La fuente de este gas se describe mejor como el resultado del emparejamiento iónico.
De igual manera, en una solución preparada añadiendo 0.5 moles del ácido muy fuerte HClO 4 a agua suficiente para hacer el volumen 1 litro, las mediciones de depresión del punto de congelación indican que las concentraciones de iones hidronio y perclorato son solo de aproximadamente 0.4 M. Esto no significa que el ácido sea solo 80% disociado; no hay evidencia de moléculas de HClO 4 en la solución. Lo que ha ocurrido es que alrededor del 20% de los iones\(\ce{H3O^{+}}\) y ClO 4 — han formado complejos de pares iónicos en los que las especies con carga contraria están ligadas libremente por fuerzas electrostáticas (Figura\(\PageIndex{4}\)).
El emparejamiento iónico reduce la disociación efectiva a altas concentraciones. Si has trabajado con ácido clorhídrico concentrado en el laboratorio, habrás notado que el olor asfixiante del gas cloruro de hidrógeno es muy evidente. ¿Cómo puede suceder esto si este ácido fuerte está realmente “100 por ciento disociado” como se dice que son todos los ácidos fuertes?
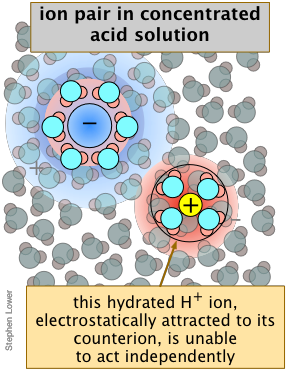
A concentraciones muy altas, muy pocas moléculas de H 2 O están disponibles para llenar completamente las cáscaras de hidratación extendidas que normalmente ayudan a mantener los iones separados, reduciendo la fracción de\(\ce{H3O^{+}}\) iones “libres” capaces de actuar independientemente. Bajo estas condiciones, el término “disociación” comienza a perder su significado. Si bien la concentración de HCl (ac) nunca es muy alta, su propio coeficiente de actividad puede ser tan grande como 2000 (Tabla\(\PageIndex{2}\)), lo que significa que su tendencia a escapar de la solución es extremadamente alta, por lo que la presencia de incluso una pequeña cantidad es muy notable.
Estimar el pH de una solución 10.0 M de ácido clorhídrico en la que el coeficiente medio de actividad iónica - es 10.4.
Solución
pH = — log {H +} ≈ — log (10.4 × 10.0) = — log 104 = — 2.0
Compara este resultado con lo que obtendrías usando — log [H +]
Tratamiento sistemático de ácidos fuertes
En esta sección, derivaremos expresiones que relacionan el pH de solución de un ácido fuerte con su concentración en una solución de agua pura. Utilizaremos ácido clorhídrico como ejemplo. Cuando el gas HCl se disuelve en agua, la solución resultante contiene los iones H 3 O +, OH —, y Cl−, Sin embargo, excepto en soluciones muy concentradas, la concentración de HCl es insignificante; para todos los fines prácticos, las moléculas de “ácido clorhídrico”, HCl, no existen en diluir soluciones acuosas.
Para especificar las concentraciones de las tres especies presentes en una solución acuosa de HCl, necesitamos tres relaciones independientes entre ellas. Estas relaciones se obtienen observando que ciertas condiciones siempre deben ser ciertas en cualquier solución de HCl. Estos son:
1. El equilibrio de autoprotólisis del agua siempre debe satisfacerse:
\[[H_3O^+][OH^–] = K_w \label{4-1}\]
2. Para cualquier sistema ácido-base, se puede escribir una ecuación de balance de masas que relacione las concentraciones de los diversos productos de disociación de la sustancia con su “concentración nominal”, que designamos aquí como C a. Para una solución de HCl, esta ecuación sería
\[[HCl] + [Cl^–] = C_a \label{4-2}\]
Sin embargo, dado que el HCl es un ácido fuerte y por lo tanto no existe “HCl” en la solución, podemos descuidar el primer término, por lo que la ecuación del balance de masas se vuelve simplemente
\[[Cl^–] = C_a \label{4-3}\]
3. En cualquier solución iónica, la suma de las cargas eléctricas positivas y negativas debe ser cero; es decir, todas las soluciones son eléctricamente neutras. Esto se conoce como el principio de electroneutralidad.
\[[H_3O^+] = [OH^–] + [Cl^–] \label{4-4}\]
El siguiente paso es combinar estas tres ecuaciones en una sola expresión que relaciona la concentración de iones hidronio con\(C_a\). Esto se hace mejor comenzando con una ecuación que relaciona varias cantidades, como Ecuación\(\ref{4-4}\), y sustituyendo los términos que queremos eliminar. Así podemos deshacernos del término [Cl−] sustituyendo Ecuación\(\ref{4-3}\) en Ecuación\(\ref{4-4}\):
\[[H_3O^+] = [OH^–] + C_a \label{4-5}\]
El término [OH —] se puede eliminar mediante el uso de la ecuación\(\ref{4-3}\):
\[[H_3O^+] = C_a + \dfrac{K_w}{[H_3O^+]} \label{4-6}\]
Esta ecuación nos dice que la concentración de iones hidronio será la misma que la concentración nominal de un ácido fuerte siempre y cuando la solución no esté muy diluida. Observe que Ecuación\(\ref{4-6}\) es una ecuación cuadrática. Recordando que K w = 10 —14, es evidente que el término final de la ecuación anterior será ordinariamente muy pequeño en comparación con los otros términos, por lo que se puede descartar ordinariamente, produciendo la relación simple
\[[H_3O^+] \approx C_a \label{4-7}\]
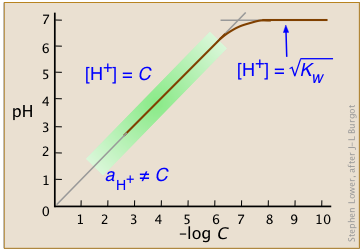
Solo en soluciones extremadamente diluidas, alrededor de 10 —6 M o menos (donde se curva la trama), esta aproximación se vuelve insostenible. Sin embargo, incluso entonces, el efecto es pequeño. Después de todo, la concentración de iones hidronio en una solución de un ácido fuerte nunca puede caer por debajo de 10 —7 M; ¡ninguna cantidad de dilución puede hacer que la solución sea alcalina! Entonces para casi todos los propósitos prácticos, Equaton\(\ref{4-7}\) es todo lo que necesitarás para una solución de un ácido fuerte.


