14.3: Moléculas como Transportadores y Convertidores de Energía
- Page ID
- 70613
Asegúrese de comprender a fondo los siguientes conceptos esenciales:
- Describir las fuentes de energía potencial y energía cinética contenidas en una molécula.
- Describir la naturaleza de la energía “térmica” y cómo se relaciona con otras formas de energía cinética y con la temperatura.
- Explique por qué las moléculas más simples (monoatómicas y diatómicas) tienen menor capacidad calorífica que las moléculas poliatómicas.
- De igual manera, explique por qué la dependencia de la capacidad calorífica de la temperatura es diferente para las moléculas monoatómicas y poliatómicas.
Todas las moléculas a temperaturas superiores a cero absoluto poseen energía térmica —la energía cinética aleatoria asociada a los diversos movimientos que pueden sufrir las moléculas en su conjunto, y también los átomos dentro de ellas. Las moléculas poliatómicas también poseen energía potencial en forma de enlaces químicos. Por lo tanto, las moléculas son vehículos para almacenar y transportar energía, y los medios para convertirla de una forma a otra cuando la formación, ruptura o reordenamiento de los enlaces químicos dentro de ellas va acompañada de la absorción o liberación de calor.
Energía Química: Potencial + Cinética
Cuando compras un litro de gasolina para tu auto, un metro cúbico de gas natural para calentar tu casa, o una batería pequeña para tu linterna, estás comprando energía en forma química. En cada caso, tendrá que ocurrir algún tipo de cambio químico antes de que esta energía pueda ser liberada y utilizada: el combustible debe quemarse en presencia de oxígeno, o los dos polos de la batería deben estar conectados a través de un circuito externo (iniciando así una reacción química dentro de la batería). Y eventualmente, cuando cada una de estas reacciones esté completa, nuestra fuente de energía se agotará; el combustible se agotará, o la batería estará “muerta”.
¿A dónde fue la energía? Podría haber ido a elevar la temperatura de los productos, a realizar trabajos de expansión de cualquier producto gaseoso o a empujar electrones a través de un circuito. El resto residirá en la energía potencial química asociada a los productos de la reacción.
Las sustancias químicas están hechas de átomos, o más generalmente, de núcleos cargados positivamente rodeados por electrones cargados negativamente. Una molécula como el dihidrógeno, H 2, se mantiene unida por atracciones electrostáticas mediadas por los electrones compartidos entre los dos núcleos. La energía potencial total de la molécula es la suma de las repulsiones entre cargas similares y las atracciones entre electrones y núcleos:
\[PE_{total} = PE_{electron-electron} + PE_{nucleus-nucleus} + PE_{nucleus-electron} \label{1-1}\]
En otras palabras, la energía potencial de una molécula depende de las ubicaciones relativas promediadas en el tiempo de sus núcleos y electrones constituyentes. Esta dependencia se expresa por la conocida curva de energía potencial que sirve como una descripción importante del enlace químico entre dos átomos.
La traducción se refiere al movimiento de un objeto como una unidad completa. Los movimientos traslacionales de las moléculas en sólidos o líquidos están restringidos a distancias muy cortas comparables a las dimensiones de las propias moléculas, mientras que en los gases las moléculas suelen viajar cientos de diámetros moleculares entre colisiones.
En el hidrógeno gaseoso, por ejemplo, las moléculas se moverán libremente de un lugar a otro; esto se llama movimiento traslacional, y las moléculas por lo tanto poseen energía cinética traslacional
\[KE_{trans} = \dfrac{mv^2}{2}\]
en el que\(v\) representa la velocidad promedio de las moléculas; tal vez recuerdes de tu estudio de gases que\(v\), y por lo tanto\(KE_{trans}\), depende de la temperatura.
Además de la traducción, las moléculas compuestas por dos o más átomos pueden poseer otro tipo de movimiento. Debido a que un enlace químico actúa como una especie de resorte, los dos átomos en H 2 tendrán una frecuencia vibracional natural. En moléculas más complicadas, se hacen posibles muchos modos diferentes de vibración, y todos ellos aportan un término vibracional KE vib a la energía cinética total. Finalmente, una molécula puede sufrir movimientos rotacionales que dan lugar a un tercer término\(KE_{rot}\). Así, la energía cinética total de una molécula es la suma
\[KE_{total} = KE_{trans} + KE_{vib} + KE_{rot} \label{1-2}\]
La energía total de la molécula (su energía interna U) es solo la suma
\[U = KE_{total} + PE_{total} \label{1-3}\]
Si bien esta fórmula es simple y directa, no puede llevarnos muy lejos en comprender y predecir el comportamiento de ni siquiera una molécula, y mucho menos de una gran cantidad de ellas. La razón, por supuesto, es la naturaleza caótica e impredecible del movimiento molecular. Afortunadamente, el comportamiento de una gran colección de moléculas, como el de una gran población de personas, puede describirse mediante métodos estadísticos.
Cómo almacenan las moléculas la energía térmica
Como se señaló anteriormente, la capacidad calorífica de una sustancia es una medida de cuán sensible se ve afectada su temperatura por un cambio en el contenido de calor; cuanto mayor sea la capacidad calorífica, menor efecto tendrá un flujo de calor dado q sobre la temperatura.
La energía térmica es energía cinética aleatoria
También señalamos que la temperatura es una medida de la energía cinética promedio debido a los movimientos de traslación de las moléculas. Si los movimientos vibracionales o rotacionales también están activos, estos también aceptarán energía térmica y reducirán la cantidad que va a los movimientos de traslación. Debido a que la temperatura depende únicamente de esta última, el efecto de los otros tipos de movimientos será reducir la dependencia de la energía interna de la temperatura, elevando así la capacidad calorífica de una sustancia.
| monatómica | diatómico | triatómico | |||
|---|---|---|---|---|---|
| Él | 20.5 | CO | 29.3 | H 2 O | 33.5 |
| Ne | 20.5 | N 2 | 29.5 | D 2 O | 34.3 |
| Ar | 20.5 | F 2 | 31.4 | CO 2 | 37.2 |
| Kr | 20.5 | Cl 2 | 33.9 | CS 2 | 45.6 |
Mientras que las moléculas monatómicas solo pueden poseer energía térmica traduccional, dos tipos adicionales de movimientos se hacen posibles en las moléculas poliatómicas.
Una molécula lineal tiene un eje que define dos direcciones perpendiculares en las que pueden ocurrir rotaciones; cada una representa un grado adicional de libertad, por lo que las dos juntas aportan un total de ½ R a la capacidad calorífica.
Los movimientos vibracionales y rotacionales no son posibles para especies monatómicas como los elementos de gas noble, por lo que estas sustancias tienen las capacidades de calor más bajas. Además, como puede ver en la columna más a la izquierda del Cuadro 1, sus capacidades térmicas son todas iguales. Esto refleja el hecho de que los movimientos traslacionales son los mismos para todas las partículas; todos esos movimientos pueden resolverse en tres direcciones en el espacio, cada una de las cuales aporta un grado de libertad a la molécula y ½ R a su capacidad calorífica. (R es la constante de gas, 8.314 J K — 1).
Piense en un “grado de libertad” como una especie de movimiento que agrega energía cinética a una molécula.
Para una molécula no lineal, las rotaciones son posibles a lo largo de las tres direcciones del espacio, por lo que estas moléculas tienen una capacidad calorífica rotacional de 3/2 R. Finalmente, los átomos individuales dentro de una molécula pueden moverse unos con respecto a otros, produciendo un movimiento vibracional. Una molécula compuesta por átomos de N puede vibrar de 3 N —6 formas o modos diferentes. Cada modo vibratorio aporta R (en lugar de ½ R) a la capacidad calorífica total. (Estos resultados provienen de mecánicas avanzadas y no se probarán aquí).
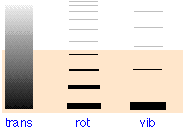
| tipo de movimiento→ | traducción |
rotación |
vibración |
|---|---|---|---|
| monatómica | 3/2 R | 0 | 0 |
| diatómico | 3/2 R | R | R |
| poliatómico | 3/2 R | 3/2 R | 3 N — 6 |
| separación entre niveles adyacentes, (kJ mol —1) | 6.0 × 10 —17 J (O 2) | 373 J (HCl) | 373 J (HCl) |
Las moléculas monatómicas tienen las capacidades de calor más pequeñas
Ahora estamos en condiciones de entender por qué las moléculas más complicadas tienen mayores capacidades térmicas. La energía cinética total de una molécula es la suma de las debidas a los diversos tipos de movimientos:
\[KE_{total} = KE_{trans} + KE_{rot} + KE_{vib} \label{2-1}\]
Cuando un gas monatómico absorbe calor, toda la energía termina en movimiento traslacional, y así va a aumentar su temperatura. En un gas poliatómico, por el contrario, la energía absorbida se divide entre los otros tipos de movimientos; ya que solo los movimientos de traslación contribuyen a la temperatura, el aumento de temperatura es menor, y así la capacidad calorífica es mayor. Sin embargo, hay una complicación muy significativa: la mecánica clásica predice que la energía siempre se divide por igual entre todos los grados de libertad. Los experimentos, sin embargo, muestran que esto se observa sólo a temperaturas bastante altas. La razón es que todos estos movimientos están cuantificados. Esto significa que solo son posibles ciertos incrementos de energía para cada modo de movimiento, y a menos que se disponga de una cierta cantidad mínima de energía, un modo dado no estará activo en absoluto y no aportará nada a la capacidad calorífica.
Los niveles de energía traslacional son efectivamente un continuo
El sombreado indica la energía térmica promedio disponible en 300 K. Solo aquellos niveles dentro de este rango tendrán una ocupación significativa como lo indica el grosor de las líneas en las dos columnas más a la derecha. A 300 K, solo estarán activos el estado vibracional más bajo y los primeros estados rotacionales. La mayor parte de la energía térmica se limitará a los niveles de traslación cuyo espaciado de minutos (10 —17 J) hace que aparezcan como un continuo.
Capacidad calorífica del dihidrógeno en función de la temperatura. Esta gráfica es típica de las de otras moléculas poliatómicas, y muestra las consecuencias prácticas de los espaciamientos de las diversas formas de energía térmica. Así, los movimientos de traslación están disponibles prácticamente a todas las temperaturas, pero las contribuciones a la acapacidad térmica por movimientos rotacionales o vibracionales solo pueden desarrollarse a temperaturas suficientemente grandes para excitar estos movimientos.
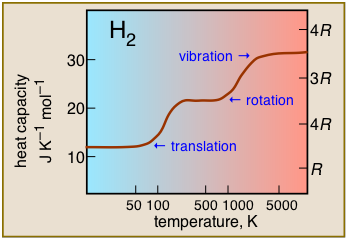
Resulta que los niveles de energía traslacional están tan espaciados que estos movimientos están activos casi hasta el cero absoluto, por lo que todos los gases poseen una capacidad calorífica de al menos 3/2 R a todas las temperaturas. Los movimientos rotacionales no comienzan hasta temperaturas intermedias, típicamente 300-500K, por lo que dentro de este rango las capacidades de calor comienzan a aumentar con la temperatura. Finalmente, a temperaturas muy altas, las vibraciones comienzan a hacer un aporte significativo a la capacidad calorífica
Las fuertes fuerzas intermoleculares de los líquidos y muchos sólidos permiten que el calor se canalice en movimientos vibratorios que involucran más de una sola molécula, aumentando aún más las capacidades de calor. Una de las propiedades “anómalas” bien conocidas del agua líquida es su alta capacidad calorífica (75 J mol —1 K —1) debido a los enlaces intermoleculares de hidrógeno, que es directamente responsable de la influencia moderadora de grandes masas de agua en los climas costeros.
Capacidades de calor de los metales
Los sólidos metálicos son un caso bastante especial. En los metales, los átomos oscilan alrededor de sus posiciones de equilibrio de una manera bastante uniforme que es esencialmente la misma para todos los metales, por lo que todos deben tener aproximadamente la misma capacidad calorífica. Que este es efectivamente el caso está plasmado en la Ley de Dulong y Petit. En el siglo XIX estos trabajadores descubrieron que las capacidades de calor molar de todos los elementos metálicos que estudiaron rondaban los 25 J mol —1 K —1, lo que está cerca de lo que la física clásica predice para los metales cristalinos. Esta observación jugó un papel importante en la caracterización de nuevos elementos, ya que proporcionó un medio para estimar sus masas molares mediante una simple medición de la capacidad calorífica.
Cambio de entalpía estándar
Bajo las condiciones especiales en las que la presión es de 1 atm y los reactivos y productos están a una temperatura de 298 K, Δ H se convierte en el cambio de entalpía estándar Δ H°. Los químicos suelen referirse al “cambio de entalpía de una reacción” como simplemente la “entalpía de reacción”, o incluso más simplemente como el "calor de reacción”. Pero a los estudiantes se les permite emplear este último atajo solo si son capaces de demostrar que conocen el significado de la entalpía.
Dado que la mayoría de los cambios que ocurren en el laboratorio, en la superficie de la tierra, y en los organismos están sometidos a una presión aproximadamente constante de “una atmósfera” y temperaturas razonablemente salubriosas, la mayoría de los calores de reacción citados en la literatura se refieren a Δ H°. Pero las altas presiones y temperaturas extremas que frecuentemente encuentran los ingenieros químicos, geoquímicos y practicantes de la oceanografía química, a menudo impiden la conveniencia de los valores “estándar”.
El reordenamiento de los átomos que se produce en una reacción química prácticamente siempre va acompañado de la liberación o absorción de calor. Si el propósito de la reacción es servir como fuente de calor, como en la combustión de un combustible, entonces estos efectos térmicos son de interés directo y obvio. Pronto veremos, sin embargo, que un estudio de la energética de las reacciones químicas en general puede llevarnos a una comprensión más profunda del equilibrio químico y la base del cambio químico mismo.
En termodinámica química, definimos el cero de la entalpía y la energía interna como el de los elementos tal como existen en sus formas estables a 298K y 1 atm de presión. Así las entalpías H de Xe (g), O 2 (g) y C (diamante) son todas cero, al igual que las de H 2 y Cl 2 en la reacción
\[H_{2(g)} + Cl_{2(g)} → 2 HCl_{(g)}\]
La entalpía de dos moles de HCl es menor que la de los reactivos, por lo que la diferencia se libera como calor. Se dice que tal reacción es exotérmica. Lo contrario de esta reacción absorbería la misma cantidad de calor del entorno y sería endotérmico. Al comparar las energías internas y entalpías de diferentes sustancias como lo venimos haciendo aquí, es importante comparar números iguales de moles, porque la energía es una propiedad extensa de la materia. Sin embargo, los calores de reacción se expresan comúnmente sobre una base molar y se tratan como propiedades intensivas.
Cambios en la entalpía y la energía interna
Podemos caracterizar cualquier reacción química por el cambio en la energía interna o entalpía:
\[ΔH = H_{final} – H_{initial} \label{3-1}\]
El significado de esto difícilmente puede exagerarse porque Δ H, al ser una función de estado, es totalmente independiente de cómo el sistema pasa del estado inicial al estado final. En otras palabras, el valor de Δ H o Δ U para un cambio de estado dado es independiente de la ruta del proceso.
Considere, por ejemplo, la oxidación de un terrón de azúcar a dióxido de carbono y agua:
\[\ce{C12H22O11 + 12 O2(g) → 12 CO2(g) + 11 H2O(l)}\]
Este proceso se puede llevar a cabo de muchas maneras, por ejemplo quemando el azúcar en el aire, o comiendo el azúcar y dejando que tu cuerpo lleve a cabo la oxidación. Aunque los mecanismos de la transformación son completamente diferentes para estas dos vías, el cambio general en la entalpía del sistema (los átomos de carbono, hidrógeno y oxígeno que originalmente estaban en el azúcar) será idéntico, y se puede calcular simplemente buscando el estándar entalpías de los reactivos y productos y cálculo de la diferencia
\[ΔH = [12 \times H(\ce{CO2})] + [11 \times H(\ce{H2O})] – H(\ce{C12H22O11}) = –5606\, kJ\]
Se libera la misma cantidad de calor tanto si el azúcar se quema en el aire como si se oxida en una serie de pasos catalizados por enzimas en su cuerpo.
La entalpía aumenta con la temperatura
Cuando se eleva la temperatura de una sustancia, absorbe calor. La entalpía de un sistema aumenta con la temperatura por la cantidad\(ΔH = C_p ΔT\). La relación definitoria
\[ΔH = ΔU + P ΔV\]
nos dice que este cambio está dominado por la energía interna, sujeta a una ligera corrección para el trabajo asociado al cambio de volumen. El calentamiento de una sustancia hace que se expanda, haciendo Δ V positivo y haciendo que la entalpía aumente ligeramente más que la energía interna. Físicamente, lo que esto significa es que si se aumenta la temperatura mientras se mantiene constante la presión, se debe gastar algo de energía extra para empujar hacia atrás la atmósfera externa mientras el sistema se expande. La diferencia entre la dependencia de U y H de la temperatura sólo es realmente significativa para los gases, ya que los coeficientes de expansión térmica de líquidos y sólidos son muy pequeños.
Entalpía de cambios de fase
Una gráfica de la entalpía de un sistema en función de su temperatura se denomina diagrama de entalpía. La pendiente de la línea viene dada por C p. El diagrama de entalpía de una sustancia pura como el agua muestra que esta gráfica no es uniforme, sino que se ve interrumpida por roturas bruscas en las que el valor de C p es aparentemente infinito, lo que significa que la sustancia puede absorber o perder calor sin sufrir ningún cambio de temperatura en absoluto. Esto, por supuesto, es exactamente lo que sucede cuando una sustancia sufre un cambio de fase; ya se sabe que la temperatura del agua que hierve en una tetera nunca puede superar los 100 hasta que todo el líquido se haya evaporado, momento en el que la temperatura del vapor subirá a medida que más calor fluya hacia el sistema.
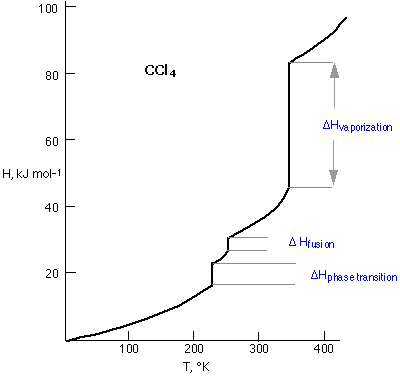
Una gráfica de la entalpía del tetracloruro de carbono en función de su temperatura proporciona una visión concisa de su comportamiento térmico. La pendiente de la línea viene dada por la capacidad calorífica C p. Todo H -vs. - Las gráficas C muestran roturas pronunciadas en las que el valor de C p es aparentemente infinito, lo que significa que la sustancia puede absorber o perder calor sin sufrir ningún cambio de temperatura en absoluto. Esto, por supuesto, es exactamente lo que sucede cuando una sustancia sufre un cambio de fase; ya se sabe que la temperatura del agua que hierve en una tetera nunca podrá superar los 100°C hasta que todo el líquido se haya evaporado, momento en el que la temperatura (del vapor) subirá a medida que más calor fluya hacia el sistema.
La discontinuidad de temperatura más baja en el diagrama CCl 4 corresponde a una transición de fase sólido-sólido asociada con un reordenamiento de moléculas en el sólido cristalino.


