15.3: La Segunda Ley de la Termodinámica
- Page ID
- 71018
Se espera que sea capaz de definir y explicar la significación de los términos identificados en tipo verde.
- En cualquier cambio macroscópico, la entropía del mundo (es decir, sistema + entorno) siempre aumenta; nunca disminuye.
- Los procesos que no intercambian calor con el entorno (como la libre expansión de un gas en un vacío) implican el cambio de entropía del sistema solo, y siempre son espontáneos.
- Un motor térmico es un dispositivo que convierte el calor en trabajo. La fracción de calor que se puede convertir en trabajo está limitada por la caída de temperatura entre la entrada al motor y el escape.
- De acuerdo con la Segunda Ley de la Termodinámica, la conversión completa del calor en trabajo por un proceso cíclico espontáneo es imposible.
La Primera Ley de la termodinámica, expresada como Δ U = q + w, es esencialmente una declaración de la ley de conservación de la energía. El significado de esta ley es que nos dice que cualquier proceso propuesto que viole esta condición puede ser descartado como imposible, sin siquiera indagar más en los detalles del proceso.
¿Por qué la Primera Ley no es suficiente?
Para operaciones mecánicas simples sobre objetos macroscópicos, la Primera Ley, conservación de energía, es todo lo que solemos necesitar para determinar cosas como cuántos julios de energía se requieren para levantar un peso o hervir un poco de agua, cuántos gramos de glucosa debes metabolizar para poder subir un cerro, o cuánto combustible tu auto necesita conducir una distancia determinada.
Pero si lo piensas, hay una serie de “operaciones mecánicas simples” que nunca ocurren, aunque no violarían la conservación de energía.
- Supongamos que deja caer un libro sobre una mesa. La energía cinética contenida en el libro descendente se dispersa como energía térmica, calentando ligeramente el libro y el tablero de la mesa. De acuerdo con la Primera Ley, no hay razón para que colocar el libro precalentado sobre una mesa calentada no sea capaz de impulsar el libro de nuevo al aire. Del mismo modo, ¿por qué la energía impartida al clavo (y a la madera) por un martillo no puede volver a sacar el clavo?
- Se podría proponer un esquema para impulsar un barco por medio de una máquina que toma agua de mar, extrae parte de su energía térmica que se utiliza para hacer girar la hélice, y luego arrojar los cubitos de hielo resultantes por la borda. Siempre y cuando el trabajo realizado para girar la hélice no sea mayor que el calor requerido para derretir el hielo, se satisface la Primera Ley.
- Debido a que el movimiento de las moléculas de aire es completamente aleatorio, no hay razón por la que todas las moléculas en la mitad de una habitación no puedan “decidir” repentinamente trasladarse a la otra mitad, asfixiando a los desafortunados ocupantes de ese lado. (En la medida en que el aire se comporta como un gas perfecto, esto no involucra en absoluto a la Primera Ley).
¿Qué tienen en común todos estos escenarios que se ajustan a la Primera Ley pero que sin embargo nunca se ven ocurrir? En todos los casos, la energía se vuelve menos dispersa, menos “diluida”. En los dos primeros ejemplos, la energía térmica (dispersa) se concentra en energía cinética organizada de un objeto macroscópico: un libro, una hélice. En el tercer caso, la energía térmica se concentra en un volumen menor a medida que el gas se contrae.
La segunda ley de la termodinámica dice en efecto, que la medida en que puede ocurrir cualquier proceso natural está limitado por la dilución de la energía térmica (aumento de la entropía) que la acompaña, y una vez que se ha producido el cambio, nunca se puede deshacer sin esparcir aún más energía alrededor. Esta es una de las leyes más profundas de la naturaleza, y debe ser parte de la visión del mundo de toda persona educada. Es lamentable que esta ley esté tan ampliamente tergiversada como simplemente ordenar el aumento del “desorden”. Una declaración más breve de la Segunda Ley (para quienes conocen el significado de “entropía”) es
Segunda Ley de la Termodinámica: La entropía del mundo sólo aumenta y nunca disminuye.
Las formas más formales e históricas de enunciar la Segunda Ley se presentarán más adelante después de que introduzcamos el tema de los motores térmicos. También vale la pena conocer esta importante consecuencia de la Segunda Ley: El hecho de que la energía esté “ahí” no significa que esté disponible para hacer algo útil.
Entropía y Cambio Espontáneo
Explicamos cómo los procesos que tienen lugar espontáneamente siempre proceden en una dirección que conduce a la difusión y distribución de la energía térmica.
- Un libro cae a la mesa (en lugar de absorber calor y saltar de él) porque su energía cinética se transforma en energía térmica que se dispersa ampliamente en las moléculas del libro y la mesa.
- Un gas se expande y las soluciones se mezclan porque la energía térmica que poseen sus moléculas se extiende sobre un mayor volumen de espacio.
- El gas hidrógeno se disocia en átomos de H que comparten energía térmica entre más partículas y un mayor volumen de espacio. (Pero solo si la temperatura es lo suficientemente alta como para que la enorme cantidad de nuevos microestados sea energéticamente accesible).
Debido a que todos los procesos naturales conducen a la difusión y distribución de la energía térmica, y debido a que la entropía es una medida del grado en que la energía se dispersa en el mundo, se deduce que:
En cualquier cambio macroscópico espontáneo, la entropía del mundo aumenta.
Todos los procesos naturales que permiten el libre intercambio de energía térmica entre números químicamente significativos de partículas van acompañados de una dispersión o “dilución” de energía que deja el mundo cambiado para siempre. En otras palabras, todo cambio espontáneo conduce a un incremento en la entropía del mundo. A primera vista, esto puede parecer inconsistente con nuestras observaciones de casos muy comunes en los que hay una clara disminución de la entropía, como la congelación de un líquido, la formación de un precipitado, o el crecimiento de un organismo.
Sistema + alrededores = ¡el mundo!
... ¡pero es la entropía del sistema más el entorno lo que cuenta! Es importante entender que el criterio para el cambio espontáneo es el cambio de entropía del sistema y el entorno, es decir, del “mundo”, que denotamos por Δ S total:
\[ΔS_{total} = ΔS_{system} + ΔS_{surroundings} \label{23.1}\]
La única forma en que la entropía del entorno puede verse afectada es por el intercambio de calor con el sistema:
\[ΔS_{surroundings} = \dfrac{q_{surr}}{ T} \label{23.2}\]
Así, la congelación del agua va acompañada de un flujo de calor (el calor de fusión) hacia el entorno, provocando que ΔS surr aumente. A temperaturas por debajo del punto de congelación, este incremento compensa con creces la disminución en la entropía del agua misma, por lo que ΔsWorld supera cero y el proceso es espontáneo. El siguiente ejemplo de problema resuelve esto en detalle para un ejemplo específico.
Obsérvese que no importa si el cambio en el sistema ocurre de manera reversible o irreversible; como se mencionó anteriormente, siempre es posible definir una vía alternativa (irreversible) en la que la cantidad de calor intercambiado con el entorno sea la misma que q rev; porque Δ S es una función de estado, el cambio de entropía del entorno tendrá el mismo valor que para la vía reversible irrealizable.
Si no hay flujo de calor dentro o fuera del entorno, el cambio de entropía del sistema y el del mundo son idénticos. Ejemplos de tales procesos, que son siempre espontáneos, son la libre expansión de un gas ideal a vacío, y la mezcla de dos gases ideales. En la práctica, casi todos los procesos que involucran mezcla y difusión pueden considerarse impulsados exclusivamente por el aumento de entropía del sistema.
La mayoría de los procesos que involucran cambios químicos y de fase implican el intercambio de calor con el entorno, por lo que su tendencia a ocurrir no siempre se puede predecir centrando la atención solo en el sistema. Además, debido al término — Q/t en el entorno Δ S, la espontaneidad de todos estos procesos dependerá de la temperatura, como ilustramos anteriormente para la disociación de H 2.
Como ejemplo cuantitativo, consideremos la congelación del agua. Sabemos que el agua líquida cambiará espontáneamente en hielo cuando la temperatura baje por debajo de 0°C a una presión de 1 atm. Dado que la entropía del sólido es menor que la del líquido, sabemos que la entropía del agua (el sistema aquí) disminuirá al congelarse. La cantidad de disminución se encuentra dividiendo el calor de fusión del hielo por la temperatura para la vía reversible, que ocurre en el punto de congelación normal:
\[ΔS_{system} = \dfrac{-6000 \; J/mol}{273 \;K} = -21.978 \; J/mol\]
Si el proceso se lleva realmente a 0°C, entonces el calor de fusión se transfiere al entorno a la misma temperatura, y la entropía del entorno aumenta en
\[ΔS_{surroundings} = \dfrac{6000 \; J/mol}{273 \;K} = 21.979\; J/mol\]
de manera que Δ S total = 0. Bajo estas condiciones el proceso puede proceder en cualquier dirección (congelación o fusión) sin afectar la entropía del mundo; esto significa que tanto el hielo como el agua líquida pueden estar presentes simultáneamente sin que se produzca ningún cambio; se dice que el sistema está en equilibrio.
Supongamos ahora que el agua se sobreenfría a —1°C antes de que se congele. El cambio de entropía del alambique de agua corresponde al valor reversible q rev /T = (—6000J)/(273K). El cambio de entropía del entorno, sin embargo, ahora viene dado por
\[ΔS_{surroundings} = \dfrac{6000 \; J/mol}{273 \;K} = 22.059\; J/mol\]
El cambio total de entropía es ahora
\[ΔS_{total} = (–21.978 + 22.059) J;\ K^{–1} mol^{–1} = +0.081\; J \;K^{–1} mol^{–1}\]
indicando que el proceso ahora puede ocurrir (“es espontáneo”) sólo en una dirección.
¿Por qué utilizamos 273 K al evaluar el sistema Δ S y 272 K para calcular el entorno Δ S? En este último caso es posible formular una vía reversible por la cual el calor puede transferirse al entorno a cualquier temperatura. El sistema Δ S, sin embargo, es una función de estado del agua, y variará con la temperatura solo ligeramente.
Tenga en cuenta que para realmente congelar el agua, debe enfriarse muy ligeramente por debajo de su punto de congelación normal, condición conocida como sobreenfriamiento. La congelación del agua superenfriada es, por supuesto, un proceso irreversible (una vez que se inicia, no se puede detener excepto elevando la temperatura en una cantidad finita), y el valor positivo de nos\(ΔS_{total}\) dice que este proceso ocurrirá espontáneamente a temperaturas por debajo de 273 K. Bajo estas condiciones, el proceso es impulsado por el aumento de entropía del entorno resultante del flujo del calor de fusión del agua hacia el entorno.
¿La entropía del mundo alguna vez disminuye?
El principio de que la energía térmica (y las moléculas que la portan) tiende a extenderse se basa en estadísticas simples. Hay que recordar, sin embargo, que las leyes de probabilidad tienen una aplicación significativa sólo a sistemas conformados por un gran número de actores independientes. Si atrapas a cien moscas en una botella, generalmente se distribuirán más o menos uniformemente por todo el contenedor; si solo hay cuatro moscas, sin embargo, es muy probable que todas ellas ocasionalmente se ubiquen en una mitad particular de la botella.
Por qué el cielo es azul
De igual manera, puedes confiar con total certeza en que el movimiento espontáneo de la mitad de las moléculas del aire hacia un lado de la habitación que ahora ocupas no ocurrirá, a pesar de que las moléculas se mueven de manera aleatoria e independiente. Por otro lado, si consideramos una caja cuyas dimensiones son sólo unos pocos diámetros moleculares, entonces esperaríamos que el desplazamiento aleatorio y a corto plazo del pequeño número de partículas que contiene a un lado de la caja ocurriera con bastante frecuencia. Esto es, de hecho, la causa del azulado del cielo: fluctuaciones aleatorias en la densidad del aire sobre pequeños volúmenes de espacio cuyas dimensiones son comparables con la longitud de onda de la luz dan como resultado una dispersión selectiva de las longitudes de onda más cortas, de manera que la luz azul se dispersa, dejando la luz roja para el disfrute de los observadores de puestas de sol hacia el oriente.
Movimiento browniano
Esto se refiere al movimiento irregular en zigzag de partículas extremadamente pequeñas como el polen de plantas cuando están suspendidas en una gota de líquido. Cualquier partícula de este tipo está siendo continuamente golpeada por los movimientos térmicos de las moléculas líquidas circundantes. Si el tamaño de la partícula es muy grande en comparación con el de las moléculas líquidas, las fuerzas que resultan de las colisiones de estas moléculas con la partícula se cancelarán y la partícula permanece intacta. Si la partícula es muy pequeña, sin embargo (quizás solo mil veces más grande que una molécula del líquido), entonces las posibilidades de que sufra suficientemente más golpes de una dirección que de otra durante un breve intervalo de tiempo se vuelven significativas.
En estos dos ejemplos, la entropía del sistema disminuye sin ningún flujo compensador de calor hacia el entorno, lo que lleva a una disminución neta (pero sólo temporal) de la entropía del mundo. Esto no representa un fracaso de la Segunda Ley, sin embargo, porque nadie ha ideado jamás una manera de extraer trabajo útil de estos procesos.
Motores de Calor
La Revolución Industrial del siglo XIX fue impulsada en gran parte por la invención de la máquina de vapor. El primer uso importante de dichos motores fue bombear agua fuera de las minas, cuyas inundaciones por filtraciones naturales limitaban seriamente las profundidades a las que podían ser conducidas, y así la disponibilidad de los minerales metálicos que eran esenciales para la expansión de las actividades industriales. La máquina de vapor es un tipo de motor térmico, un dispositivo que convierte el calor, proporcionado al quemar un combustible, en trabajo mecánico, generalmente entregado a través del movimiento de un pistón en oposición a una fuerza opuesta. Por lo tanto, un motor es un dispositivo de conversión de energía en el que, idealmente, cada julio de calor liberado por la combustión del combustible podría extraerse como trabajo en el eje de salida; dicho motor operaría con una eficiencia del 100 por ciento.
Sin embargo, los ingenieros de la época se quedaron perplejos al descubrir que las eficiencias de las máquinas de vapor eran bastante bajas (generalmente alrededor del 20%), siendo la mayor parte del calor agotado inútilmente al medio ambiente. Todos entendieron que sería imposible una eficiencia superior al 100% (eso violaría la conservación de la energía, y así la Primera Ley), pero no estaba claro por qué las eficiencias no podían elevarse significativamente más allá de los pequeños valores observados aun cuando mejoraran los diseños mecánicos

La respuesta fue encontrada por un joven ingeniero francés, Sadi Carnot, quien en 1824 publicó un análisis de un motor térmico idealizado que generalmente se considera el fundamento de la ciencia de la termodinámica, a pesar de que Carnot aún aceptaba la creencia de que el calor es una sustancia fluida llamada “calórico”. Aquí no vamos a replicar su análisis (esto se hace normalmente en cursos más avanzados de química física), sino que simplemente expresaremos su conclusión en sus propias palabras [traducidas]:
“La producción de fuerza motriz se debe entonces en los motores de vapor no a un consumo real de calórico, sino a su transporte de un cuerpo cálido a un cuerpo frío... la producción de calor por sí sola no es suficiente para dar a luz el poder impulsor: es necesario que también haya frío; sin él, el calor sería inútil. La máxima eficiencia alcanzable de cualquier motor térmico dependerá de las temperaturas a las que se suministre calor y se elimine de él”.
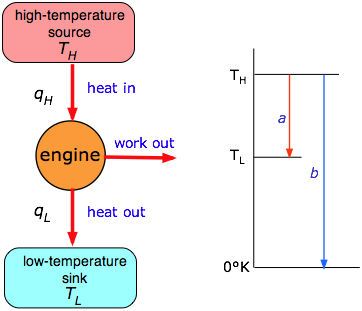
El lado izquierdo de la figura representa un motor de calor generalizado en el que una cantidad de calor qH, extraída de una fuente o “reservorio” a temperatura T H se convierte parcialmente en trabajo w. El resto del calor q L se expulsa a un reservorio a una temperatura inferior T L. En la práctica, T H sería la temperatura del vapor en una máquina de vapor, o la temperatura de la mezcla de combustión en un motor de combustión interna o turbina. El reservorio de baja temperatura es ordinariamente el del entorno local. La eficiencia ε (épsilon) de un motor térmico es la fracción del calor extraído del depósito de alta temperatura que se puede convertir en trabajo:
\[ ε = \dfrac{w}{q_H} \label{3.3}\]
El hallazgo crucial de Carnot (por el que sin duda se habría merecido un premio Nobel si estos hubieran existido en su momento) es que la eficiencia es proporcional a la “distancia” en temperatura que el calor puede “caer” a medida que pasa por el motor:
\[ ε = 1 - \dfrac{T_L}{T_H} \label{3.4}\]
Esto se ilustra gráficamente en la mitad derecha de la figura justo arriba, en la que la eficiencia es simplemente la fracción de la caída “completa” (en temperatura) a cero absoluto (flecha b) que sufre el calor en el motor (flecha a.) Claramente, la única manera de lograr una eficiencia del 100% sería establecer la temperatura del depósito de escape en 0°K, lo que sería imposible. Para la mayoría de los motores térmicos terrestres, T L es solo la temperatura del ambiente, normalmente alrededor de 300 K, por lo que la única forma práctica de mejorar la eficiencia es hacer que T H sea lo más alto posible. Esta es la razón por la que el vapor de alta presión (sobrecalentado) es favorecido en las centrales térmicas comerciales. Las temperaturas más altas (y las mayores eficiencias de operación) se obtienen en motores de turbina de gas. Sin embargo, a medida que aumentan las temperaturas de operación, los costos de lidiar con presiones de vapor más altas y la capacidad de materiales como las palas de turbina para soportar altas temperaturas se convierten en factores significativos, colocando un límite superior de alrededor de 600K sobre T H, imponiendo así un máximo de alrededor del 50 por ciento eficiencia en la generación de energía térmica.
Para las plantas nucleares, en las que las consideraciones de seguridad requieren menores presiones de vapor, la eficiencia es menor. Una consecuencia de esto es que una mayor fracción del calor se agota al ambiente, lo que puede resultar en un mayor daño a los organismos acuáticos cuando el agua de enfriamiento es devuelta a un arroyo o estuario.
Se han hecho varias propuestas para construir un motor térmico que haga uso del diferencial de temperatura entre las aguas superficiales del océano y aguas más frías que, al ser más densas, residen a mayor profundidad. Si la temperatura de escape es de 5°C, ¿cuál es la cantidad máxima de trabajo que podría extraerse de 1000 L de agua superficial a 10°C? (La capacidad calorífica específica del agua es 4.184 J g —1 K —1.)
Solución
La cantidad de calor (q H) que se debe extraer para enfriar el agua en 5 K es (4.184 J g —1 K —1) (10 6 g) (5 K) = 2.09 × 10 7 J. La eficiencia termodinámica ideal viene dada por
\[ 1 -\dfrac{278 \;K}{283\; K} = 0.018\]
La cantidad de trabajo que se podría hacer sería
\[(0.018)(2.09 \times 10^7 \;J) = 3.7 \times 10^6 \;J\]
Comentario: Puede ser solo 1.8% eficiente, ¡pero es gratis!
El pájaro bebedor como motor de calor
Pocos juguetes ilustran tantos principios de la ciencia física como este popular dispositivo que ha existido durante muchos años. A primera vista puede parecer una máquina de movimiento perpetuo, pero en realidad es solo un simple motor térmico. Los “pájaros dippy” modernos (como a veces se les llama) utilizan diclorometano como fluido de trabajo.

Este líquido hierve a 39° C, y por lo tanto tiene una presión de vapor bastante alta a temperatura ambiente. El líquido (al que a menudo se le agrega un tinte para un efecto dramático) se almacena en un reservorio en el fondo del ave. El pico del ave está cubierto de fieltro que, cuando se sumerge momentáneamente en agua, crea un efecto refrescante a medida que el agua se evapora. Esto provoca que parte del vapor CH 2 Cl 2 se condense en la cabeza, reduciendo la presión dentro del dispositivo, provocando que se hierva más líquido y se vuelva a condensar en la cabeza. La redistribución del fluido altera el equilibrio, haciendo que el ave vuelva a sumergir su pico en el agua. Una vez que la cabeza se llena de líquido, vuelve a drenar al fondo, inclinando al ave erguida para repetir el ciclo.
Te dejaremos relacionar esto con el diagrama del motor térmico anterior identificando la fuente de calor y el disipador, y estimar la eficiencia termodinámica del motor.
Bombas de Calor
Si un motor térmico funciona “a la inversa” realizando trabajos en él (es decir, cambiando “work out” a “work in” en la Fig 8), se convierte en un dispositivo para transportar calor contra un gradiente térmico. Los refrigeradores y los aires acondicionados son las bombas de calor más comunes. También se puede utilizar una bomba de calor para calentar el interior de un edificio. En esta aplicación, el reservorio de baja temperatura puede ser un intercambiador de calor enterrado en la tierra o sumergido en un pozo. En esta aplicación las bombas de calor son más eficientes que los hornos o la calefacción eléctrica, pero el costo de capital es bastante alto.
La Segunda Ley: lo que significa
Fue la observación anterior de Carnot la que finalmente condujo a la formulación de la Segunda Ley de la Termodinámica cerca de finales del siglo XIX. Una declaración de esta ley (de Kelvin y Planck) es la siguiente:
Es imposible que un proceso cíclico conectado a un reservorio a una temperatura produzca una cantidad positiva de trabajo en los alrededores.
Para ayudarle a entender esta afirmación y cómo se aplica a los motores térmicos, considere el motor térmico esquemático en la figura en la que un fluido de trabajo (gases de combustión o vapor) se expande contra la fuerza de restricción de un peso que está vinculado mecánicamente al pistón. Desde una perspectiva termodinámica, el fluido de trabajo es el sistema y todo lo demás es entorno. La expansión del fluido ocurre cuando absorbe calor del entorno; el retorno del sistema a su estado inicial requiere que el entorno haga trabajo en el sistema. Ahora relee el enunciado anterior de la Segunda Ley, prestando especial atención a las frases en cursiva que se explican a continuación:
- Un proceso cíclico es aquel en el que el sistema vuelve a su estado inicial. Una simple máquina de vapor se somete a una etapa de expansión (la carrera de potencia), seguida de una compresión (carrera de escape) en la que el pistón, y por lo tanto el motor, vuelve a su estado inicial antes de que se repita el proceso.
- “A una temperatura” significa que las etapas de expansión y compresión operan isotérmicamente. Esto significa que ΔU = 0; el sistema absorbe el calor suficiente para realizar el trabajo requerido para elevar el peso, así que para este paso q = —w.
- “Una cantidad positiva de trabajo en los alrededores” significa que el motor hace más trabajo en el entorno que el entorno lo hace en el motor. Sin esta condición el motor sería inútil.
Obsérvese cuidadosamente que la Segunda Ley se aplica únicamente a un proceso cíclico —la expansión isotérmica de un gas contra una presión distinta de cero siempre funciona en el entorno, pero un motor debe repetir este proceso continuamente; para ello debe ser devuelto a su estado inicial al final de cada ciclo. Al operar isotérmicamente, el trabajo — w que realiza en el entorno en el paso de expansión (carrera de potencia) es anulado por el trabajo + w que el entorno debe hacer en el sistema para completar el ciclo. La Segunda Ley también se puede afirmar de manera alternativa:
Es imposible construir una máquina que funcione en ciclos que conviertan el calor en trabajo sin producir ningún otro cambio.
Así, la Segunda Ley sí permite que un motor convierta el calor en trabajo, pero sólo si se permiten “otros cambios” (transferencia de una porción del calor directamente al entorno). Y dado que el calor sólo puede fluir espontáneamente desde una fuente a una temperatura más alta a un sumidero a una temperatura más baja, se implica la imposibilidad de conversión isotérmica del calor en trabajo.


