16.5: Aplicaciones de la Ecuación de Nernst
- Page ID
- 70745
Asegúrese de comprender a fondo las siguientes ideas esenciales:
- El oxígeno atmosférico es un agente oxidante fuerte, pero en ausencia de un catalizador adecuado esta reacción es normalmente demasiado lenta para ser observable.
- El pE es un índice útil de disponibilidad de electrones, especialmente en aguas naturales y sistemas biológicos en los que generalmente están presentes múltiples sistemas redox.
- Los productos de solubilidad a menudo se pueden medir construyendo una celda en la que uno de los electrodos involucra la sal escasamente soluble, y la ecuación de celda neta corresponde a la reacción de solubilidad.
- Las titulaciones potenciométricas son ampliamente utilizadas para medir concentraciones de especies que se oxidan o reducen fácilmente.
- La medición del pH se realiza con un electrodo que consiste en una fina membrana de vidrio en la que los iones Na + se intercambian con H +.
- Los potenciales de membrana (Donnan) surgen cuando el paso de un ion a través de una membrana semipermeable se facilita o inhibe selectivamente.
- La conducción nerviosa no ocurre por un flujo de carga a través del nervio, sino por una onda de despolarización resultante de la acción concertada de canales activos que gobiernan el paso de iones (principalmente K + y Na +) a través de la membrana que encierra el nervio.
Normalmente pensamos que el potencial de oxidación está controlado por las concentraciones de las formas oxidadas y reducidas de un par redox, como lo da la ecuación de Nernst. Bajo ciertas circunstancias se vuelve más útil pensar en E como una variable independiente que puede ser utilizada para controlar el valor de Q en la ecuación de Nernst. Esto suele ocurrir cuando están presentes dos sistemas redox, siendo uno mucho más concentrado o cinéticamente activo que el otro. Con mucho, el ejemplo más importante de esto es la forma en que el oxígeno atmosférico gobierna la composición de los muchos sistemas redox conectados con la actividad biológica.
Oxígeno y Medio Acuático
La presencia de oxígeno en la atmósfera tiene un profundo efecto sobre las propiedades redox del medio acuático, es decir, en las aguas naturales expuestas directa o indirectamente a la atmósfera, y por extensión, en los organismos que viven en un ambiente aeróbico.Esto se debe, por supuesto, a que es un agente oxidante fuerte y, por lo tanto, un sumidero bajo para electrones de la mayoría de los elementos y todos los compuestos orgánicos. Aquellas partes del ambiente que están protegidas del oxígeno atmosférico son igualmente importantes porque es sólo aquí donde los electrones están suficientemente disponibles para producir las condiciones “reductoras” que son esenciales para procesos que varían desde la fotosíntesis hasta la fijación de nitrógeno.
Estimar el potencial redox de un agua natural que está en equilibrio con la atmósfera a pH 7 y 298 K. ¿Qué fracción de una solución diluida Fe 2 + estará en su forma oxidada Fe 3 + en dicha agua?
Solución
Los E °s relevantes son
- 1.23 v para O 2 (g) + 4H + + 4 e — → 2H 2 O y
- 0.77 V para la pareja Fe 3 + /Fe 2 +.
(a) El potencial (con respecto a la SHE, por supuesto) viene dado por la ecuación de Nernst
que funciona a E = 0.82 voltios. Como predice el principio de Le Chatelier, el pH más alto (menor [H +] comparado con el pH “estándar” de cero) reduce la tendencia aceptora de electrones del oxígeno.
(b) La ecuación de Nernst para la reducción de Fe 3 + es E = .77—.059 log Q, en la que Q es la relación [Fe 2 +]/[Fe 3+]. Con E establecido por la pareja O 2 /H 2 O, esto se convierte
0.82 = 0.77 — 0.059 log Q
que da Q = 10 —0.85 o [Fe 2 +]/[Fe 3 +] = 0.14/1, por lo que la fracción del hierro en su forma oxidada es 1/1.14 = 0.88.
Si podemos tener pH, ¿por qué no pE?
Como recordará de su estudio de química ácido-base, el pH de una solución (definido como —log {H +}) es una medida de disponibilidad (técnicamente, la actividad) de los protones en la solución. Como se explica con más detalle aquí, los protones tienden a “caer” (en energía libre) de los niveles de donantes llenos (ácidos) a niveles de aceptores más bajos (bases). A través de la relación
\[[H^+] \approx K_a \dfrac{C_a}{C_b}\]
que se puede reescribir como
\[\dfrac{C_a}{C_b} \approx \dfrac{[H^+]}{K_a}\]
en el que el pH se trata como una variable independiente que controla la relación de las formas conjugadas de cualquier par ácido-base en la solución:
\[\log \left(\dfrac{C_a}{C_b}\right) \approx pH – pK_a\]
De la misma manera, podemos definir el pE como el logaritmo negativo de la actividad electrónica en la solución:
\[pE = –\log{e^–}\]
de estas partículas (pero no a sus “concentraciones”) cuando estamos considerando su disponibilidad para donantes y aceptores. No entraremos en los detalles de cómo se calcula realmente el pE (por supuesto, está relacionado con el potencial de electrodo estándar ordinario). Para hacerse una idea de su significado, considere la siguiente tabla que muestra los valores de pE° de algunos sistemas redox que son de inmensa importancia en el medio acuático.Sistemas redox importantes para el medio ambiente
- Estos valores de pE se refieren a condiciones ambientales típicas con pH=7 y presión parcial de oxígeno de 0.21 atm. La siguiente escala muestra la energía libre de un mol de electrones con respecto a su nivel en H 2 O.
- Las dos formas conjugadas de cualquier par redox están presentes en concentraciones iguales cuando el pE está al nivel en el que se muestra el par. A pE's por encima o por debajo de este nivel, predominará la forma reducida u oxidada.
- El azúcar glucosa, denotado por la fórmula general para los carbohidratos {CH 2 O}, es la fuente de energía química para la mayoría de los organismos. Nótese que es termodinámicamente estable (y por lo tanto capaz de formarse por la fotosíntesis) solo bajo condiciones altamente reductoras.
- Los organismos obtienen su energía metabólica libre cuando los electrones caen de la glucosa a un aceptor inferior a la derecha.
- La entrega de electrones de glucosa a O 2 (8) es la fuente de energía metabólica libre para todos los organismos aeróbicos, produciendo 125 kJ por mol de electrones transferidos.

Algunos otros puntos sobre esta trama son dignos de mención:
- Los organismos anaerobios deben conformarse con aceptores de electrones por encima del oxígeno. Las bacterias pobres que dependen de reducir los iones de hidrógeno (2) lo tienen peor de todo, ganando solo una pequeña cantidad de energía metabólica para producir una pequeña bocanada de gas hidrógeno.
- La reacción (3) no es mucho más eficiente, pero es el primer eslabón vital en el proceso de fijación natural de nitrógeno que se lleva a cabo en el ambiente protegido rico en electrones de los organismos que viven en los nódulos radiculares de las leguminosas.
- Las consecuencias de (4) son evidentes si alguna vez has notado el olor a huevo podrido de algunos suelos fangosos mal aireados.
- La reacción (6) se conoce como fermentación; tiene lugar en los suelos anarobicos de pantanos y pantanos (de ahí el apodo de “gas de pantano” para el metano) y en el interior de los animales desde las termitas hasta las vacas, y a veces hasta nuestra vergüenza, en nosotros mismos. Observe que aquí la glucosa juega el doble papel de donante y aceptor de electrones; esta es una reacción de desproporción.
- Por último, si alguna vez has tenido mucho que ver con los pañales de los bebés, probablemente hayas notado el olor a amoníaco producido ya que las bacterias anaeróbicas desde dentro entregan electrones a los iones nitrato (7). Es importante tener en cuenta que las reacciones discutidas anteriormente son mediadas por organismos vivos; sin las enzimas necesarias para catalizarlas, sus tasas son esencialmente cero.
Para una gráfica más detallada, consulte Caída a través de la cadena respiratoria.
Aplicaciones de química analítica
Una gran parte de la Química se ocupa, ya sea directa o indirectamente, de determinar las concentraciones de iones en solución. Cualquier método que pueda lograr tales mediciones utilizando técnicas físicas relativamente simples está destinado a ser ampliamente explotado. Los potenciales celulares son bastante fáciles de medir, y aunque la ecuación de Nernst los relaciona con actividades iónicas más que con concentraciones, la diferencia entre ellos se vuelve insignificante en soluciones donde la concentración iónica total es menor de aproximadamente 10 —3 M.
Las concentraciones de iones en equilibrio con una sal escasamente soluble son suficientemente bajas para que su determinación directa pueda ser bastante difícil. Un procedimiento mucho más sencillo y común es establecer una celda en la que una de las reacciones del electrodo involucra la sal insoluble, y cuya reacción celular neta corresponde a la disolución de la sal. Por ejemplo, para determinar la K sp para el cloruro de plata, podríamos usar la celda
\[Ag_{(s)} | Ag^+(?\; M) || Ag^+,Cl^– | AgCl_{(s)} | Ag_{(s)}\]
cuya ecuación neta corresponde a la disolución del cloruro de plata:
|
cátodo:
|
AgCl (s) + e — → Ag (s) + Cl — (aq) | E° = +0.222 v |
|
ánodo:
|
Ag (s) → Ag + (aq) + e — | E° = — (+0.799) v |
|
neto:
|
AgCl (s) → Ag + Cl — | E° = -0.577 v |
El potencial estándar para la reacción neta se refiere a una solución hipotética en la que las actividades de los dos iones son unidad. El potencial celular que realmente observamos corresponde a E en la ecuación de Nernst, que luego se resuelve para Q que da K sp directamente.
Titulaciones potenciométricas
En muchas situaciones, la determinación precisa de una concentración de iones mediante la medición directa de un potencial celular es imposible debido a la presencia de otros iones y a la falta de información sobre los coeficientes de actividad. En tales casos, a menudo es posible determinar el ion indirectamente por titulación con algún otro ion. Por ejemplo, la concentración inicial de un ion como Fe 2 + se puede encontrar valorando con un agente oxidante fuerte como Ce 4 +. La titulación se realiza en un lado de una celda cuya otra mitad es un electrodo de referencia:
Pt (s) | Fe 2 +, Fe 3 + || electrodo de referencia
Inicialmente la celda izquierda contiene solo Fe 2 +. A medida que se agrega el valorante, el ion ferroso se oxida a Fe 3 + en una reacción que es prácticamente completa:
\[Fe^{2+} + Ce^{4+} → Fe^{3+} + Ce^{3+}\]
Se sigue el potencial celular ya que el Fe 2 + se agrega en pequeños incrementos. Una vez que se ha agregado la primera gota de titulante de iones céricos, el potencial de la celda izquierda se controla por la relación de hierro oxidado y reducido de acuerdo con la ecuación de Nernst
\[E = 0.68 - 0.059 \; \log \dfrac{]Fe^{3+}]}{[Fe^{2+}]}\]
lo que provoca que el potencial aumente a medida que se oxida más hierro.
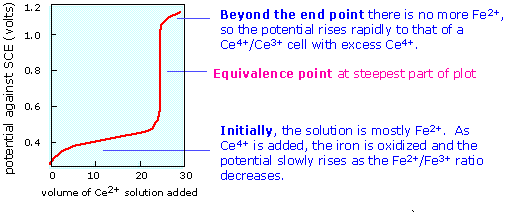
Cuando se alcanza el punto de equivalencia, el Fe 2 + se habrá consumido totalmente (la gran constante de equilibrio asegura que esto será así), y el potencial será entonces controlado por la relación de concentración de Ce 3 + /Ce 4 +. La idea es que ambas especies de una pareja redox deben estar presentes en concentraciones razonables aplomo un electrodo (es decir, para controlar su potencial de acuerdo con la ecuación de Nernst). Si se resuelven los potenciales celulares reales para diversas concentraciones de todas estas especies, la curva de titulación resultante se parece mucho a la conocida curva de titulación ácido-base. El punto final se encuentra no midiendo un voltaje de celda en particular, sino encontrando qué volumen de valorante da la parte más pronunciada de la curva.
Medición del pH
Dado que el pH se define realmente en términos de actividad de iones de hidrógeno y no de su concentración, un electrodo de hidrógeno permite una medida directa de {H +} y por lo tanto de —log {H +}, que es el pH. Todo lo que necesitas es medir el voltaje de una celda
H 2 (g, 1 atm) | Pt | H + (? M) || electrodo de referencia
En teoría esto es bastante simple, pero cuando se empleó por primera vez en la era preelectrónica, requirió de algún aparato de aspecto bastante formidable (como la configuración del electrómetro de láminas vibratorias L&N de la década de 1920 que se muestra aquí) y el uso de gas hidrógeno explosivo. Si bien esta disposición (en la que el electrodo de referencia podría ser un electrodo de hidrógeno estándar) se ha utilizado desde entonces para determinaciones de alta precisión, no sería práctico para mediciones rutinarias de pH de los tipos que se realizan ampliamente, especialmente fuera del laboratorio de investigación.
El electrodo de vidrio para mediciones de pH
En 1914 se descubrió que una fina membrana de vidrio que encierra una solución de HCl puede producir un potencial que varía con la actividad del ión hidrógeno {H +} aproximadamente de la misma manera que el del electrodo de hidrógeno. Los electrodos de vidrio se fabrican en grandes cantidades tanto para mediciones de laboratorio como de campo. Contienen un electrodo de referencia Ag-AgCl incorporado en contacto con la solución de HCl encerrada por la membrana.
El potencial de un electrodo de vidrio viene dado por una forma de la ecuación de Nernst muy similar a la de un electrodo de hidrógeno ordinario, pero por supuesto sin el H 2:
Membrana E = A + (RT/F) ln ({H +} + B)
en el que A y B son constantes que dependen de la membrana de vidrio particular.
La razón por la que una membrana de vidrio se comportaría de esta manera no se entendió hasta alrededor de 1970. Ahora parece que los iones de hidrógeno en la solución externa se difunden a través del vidrio y empujan hacia fuera un número correspondiente de los iones Na + que normalmente están presentes en la mayoría de los vidrios. Estos iones de sodio se difunden hacia cualquier lado de la membrana que tenga la menor concentración, donde permanecen en su mayoría confinados a la superficie del vidrio, que tiene una naturaleza porosa y gelatinosa. Es el exceso de carga producido por estos iones positivos lo que da lugar al potencial dependiente del pH. El primer medidor de pH comercial fue desarrollado por Arnold Beckman (1900-2004) mientras era profesor de Química en CalTech. No pudo interesar a ninguna de las compañías de instrumentación en comercializarla, por lo que fundó su propia compañía y finalmente se convirtió en filántropo multimillonario.
|
Arnold Beckman
|
Un medidor de pH Beckman temprano
|
Un típico medidor de pH moderno
|
Electrodos selectivos de iones
La función de la membrana en el electrodo de vidrio es permitir el paso de iones de hidrógeno y así cambiar su potencial, al tiempo que se evita que otros cationes hagan lo mismo (esta selectividad nunca es perfecta; la mayoría de los electrodos de vidrio responderán a concentraciones moderadas de iones de sodio, y a altas concentraciones de algunos otros.) Por lo tanto, un electrodo de vidrio es una forma de electrodo selectivo de iones. Desde aproximadamente 1970, se han desarrollado varias otras membranas que muestran selectividades similares a ciertos otros iones. Estos son ampliamente utilizados en aplicaciones industriales, bioquímicas y ambientales.
Potenciales de membrana y conducción nerviosa
Puede recordar los fenómenos de ósmosis y presión osmótica que se observan cuando dos soluciones que tienen diferentes concentraciones de soluto están separadas por una película delgada o membrana cuya porosidad permite que pequeños iones y moléculas se difundan a través, pero que retiene partículas más grandes. Si una solución contiene un par de especies iónicas de carga opuesta cuyos tamaños son muy diferentes, los iones más pequeños pueden pasar a través de la membrana semipermeable mientras que los más grandes son retenidos. Esto producirá un desequilibrio de carga entre las dos soluciones, teniendo la solución original el signo de carga del ion más grande. Finalmente, el trabajo eléctrico requerido para lograr una mayor separación de las cargas se vuelve demasiado grande para permitir que se produzca una mayor difusión neta, y el sistema se asienta en un estado de equilibrio en el que se mantiene una diferencia de potencial constante (generalmente alrededor de un voltio o menos). Esta diferencia de potencial se suele llamar potencial de membrana o potencial de Donnan después del químico inglés que describió por primera vez este fenómeno alrededor de 1930.
|
Origen de un potencial de membrana Si los iones más pequeños son capaces de difundirse a través de la membrana pero los iones más grandes no pueden, se desarrollará una diferencia de potencial entre las dos soluciones. Este potencial de membrana se puede observar introduciendo un par de electrodos de platino. |
|
La figura muestra un sistema simple que contiene la sal de potasio de una proteína en un lado de una membrana y cloruro de potasio en el otro. El anión proteinato, al ser demasiado grande para difundirse a través de la membrana, da lugar a la diferencia de potencial. El valor de esta diferencia de potencial puede ser expresado por una relación que es esencialmente la misma que la ecuación de Nernst, aunque su derivación es diferente. El potencial de membrana se puede expresar en términos de la relación de las actividades de iones K + o Cl —:
La membrana que rodea a la mayoría de las células vivas contiene sitios o “canales” a través de los cuales los iones K + son transportados selectivamente de manera que la concentración de K + dentro de la célula es 10-30 veces la del fluido intracelular. Tomando la relación de actividad como aproximadamente 20, la ecuación anterior predice que la diferencia de potencial θ dentro - θ afuera será
lo cual es consistente con los valores observados. El transporte de un ion como K + desde una región de baja concentración hacia el fluido intercelular más concentrado requiere una fuente de energía libre, la cual es suministrada por ATP bajo control enzimático. Los procesos metabólicos que gobiernan esta acción a menudo se denominan “bombas de iones”.
Conducción nerviosa
La transmisión de señales a través del sistema nervioso no ocurre por el movimiento de un portador de carga a través del nervio, sino por ondas de concentraciones diferenciales de iones que viajan a lo largo de la longitud del nervio. Estos gradientes de concentración se reducen mediante canales iónicos basados en proteínas y bombas de iones activadas por ATP (y que consumen energía) específicas de iones K + y Ca 2 +.
A veces pensamos en nuestros nervios como el cableado del cuerpo, pero la “electricidad” que transmiten no es un flujo de electrones, sino una onda de despolarización que viaja rápidamente que implica el transporte de iones a través de la membrana nerviosa. La diferencia de potencial normal entre las partes interna y externa de las células nerviosas es de aproximadamente —70 mv como se estimó anteriormente. La transmisión de un impulso nervioso se inicia por una reducción de esta diferencia de potencial a aproximadamente —20 mv. Esto tiene el efecto de abrir temporalmente el canal Na +; la afluencia de estos iones hace que el potencial de membrana de la porción adyacente del nervio colapse, conduciendo a un efecto que se transmite a lo largo de la longitud del nervio. A medida que pasa este pulso, las bombas K + y Na + restauran el nervio a su condición de reposo.
Resumen
Asegúrese de comprender a fondo las siguientes ideas esenciales que se han presentado anteriormente. Es especialmente importante que conozcas los significados precisos de todos los términos resaltados en el contexto de este tema.
- El oxígeno atmosférico es un agente oxidante fuerte, pero en ausencia de un catalizador adecuado esta reacción es normalmente demasiado lenta para ser observable. En organismos que poseen las enzimas apropiadas, la reacción es suficientemente rápida para controlar la disponibilidad de electrones a otros sistemas redox.
- El pE es un índice útil de disponibilidad de electrones, especialmente en aguas naturales y sistemas biológicos en los que generalmente están presentes múltiples sistemas redox. Aunque los electrones tienden a “caer” (en energía libre) de fuentes a sumideros, el resultado depende muy fuertemente de las tasas de las diversas reacciones. Esto es bastante diferente de las reacciones de intercambio de protones (ácido-base) que son uniformemente rápidas.
- Los productos de solubilidad a menudo se pueden medir construyendo una celda en la que uno de los electrodos involucra la sal escasamente soluble, y la ecuación de celda neta corresponde a la reacción de solubilidad.
- Las titulaciones potenciométricas son ampliamente utilizadas para medir concentraciones de especies que se oxidan o reducen fácilmente. La reacción debe ser rápida y tener una constante de equilibrio muy grande. El punto de equivalencia se detecta por el cambio rápido en el potencial que se produce cuando el control del potencial celular pasa del sistema redox del analito al del valorante.
- La medición del pH se realiza con un electrodo que consiste en una fina membrana de vidrio en la que los iones Na + se intercambian con H +.
- Los potenciales de membrana (Donnan) surgen cuando el paso de un ion a través de una membrana semipermeable se facilita o inhibe selectivamente. El ejemplo clásico es una solución de proteinato de sodio en la que el anión proteico es demasiado grande para pasar a través de la membrana. En los organismos, los canales específicos de iones o “bombas” tienen un efecto similar.
- La conducción nerviosa no ocurre por un flujo de carga a través del nervio, sino por una onda de despolarización resultante de la acción concertada de canales activos que gobiernan el paso de iones (principalmente K + y Na +) a través de la membrana que encierra el nervio.


