16.4: La ecuación de Nernst
- Page ID
- 70764
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Asegúrate de entender a fondo las siguientes ideas esenciales. Es especialmente importante que conozcas los significados precisos de todos los términos resaltados en el contexto de este tema.
- La ecuación de Nernst relaciona las concentraciones efectivas (actividades) de los componentes de una reacción celular con el potencial celular estándar. Para una simple reducción de la forma M n + ne — → M, nos dice que un potencial de media célula cambiará en 59/ n mV por cambio de 10 veces en la actividad del ion.
- Por lo general, las concentraciones iónicas se pueden usar en lugar de actividades cuando la concentración total de iones en la solución no supera aproximadamente 0.001 M.
- En aquellas reacciones en las que participan iones H + u OH —, el potencial celular también dependerá del pH. Las gráficas de E vs pH que muestran las regiones de estabilidad de especies relacionadas son medios muy útiles para resumir la química redox de un elemento.
Los potenciales celulares estándar que discutimos en una sección anterior se refieren a celdas en las que todas las sustancias disueltas están en actividad unitaria, lo que esencialmente significa una “concentración efectiva” de 1 M. De manera similar, cualquier gas que tome parte en una reacción de electrodo se encuentra en una presión efectiva (conocida como fugacidad) de 1 atm. Si estas concentraciones o presiones tienen otros valores, el potencial celular cambiará de una manera que se pueda predecir a partir de los principios que ya conoce.
Los potenciales celulares dependen de las concentraciones
Supongamos, por ejemplo, que reducimos la concentración de\(Zn^{2+}\) en la\(Zn/Cu\) célula de su valor efectivo estándar de 1 M a un valor mucho menor:
\[Zn(s) | Zn^{2+}(aq, 0.001\,M) || Cu^{2+}(aq) | Cu(s)\]
Esto reducirá el valor de\(Q\) para la reacción celular
\[Zn(s) + Cu^{2+} → Zn^{2+} + Cu(s)\]
haciéndolo así más espontáneo, o “conducirlo a la derecha” como predeciría el principio de Le Chatelier, y haciendo que su cambio de energía libre sea\(\Delta G\) más negativo que\(\Delta G°\), por lo que\(E\) sería más positivo que\(E^°\). La relación entre el potencial celular real\(E\) y el potencial estándar\(E^°\) se desarrolla de la siguiente manera. Comenzamos con la ecuación derivada previamente que relaciona el cambio estándar de energía libre (para la conversión completa de productos en reactivos) con el potencial estándar
\[\Delta G° = –nFE° \]
Por analogía podemos escribir la ecuación más general
\[\Delta G = –nFE\]
que expresa el cambio en la energía libre para cualquier grado de reacción, es decir, para cualquier valor del cociente de reacción\(Q\). Ahora los sustituimos por la expresión que relata\(\Delta G\) y\(\Delta G°\) que recordarás del capítulo sobre el equilibrio químico:
\[\Delta G = \Delta G° + RT \ln Q\]
que da
\[–nFE = –nFE° + RT \ln Q \]
que se puede reorganizar a
\[ \color{red} {\underbrace{E=E° -\dfrac{RT}{nF} \ln Q}_{\text{applicable at all temperatures}}} \label{Nernst Long}\]
Esta es la ecuación de Nernst que relaciona el potencial celular con el potencial estándar y con las actividades de las especies electroactivas. Observe que el potencial celular será el mismo que\(E°\) sólo si\(Q\) es unidad. La ecuación de Nernst se escribe más comúnmente en forma logarítmica de base 10 y para 25 °C:
\[ \color{red} {\underbrace{E=E° -\dfrac{0.059}{n} \log_{10} Q}_{\text{Applicable at only 298K}}} \label{Nernst Short}\]
Importancia de la ecuación de Nernst
La ecuación de Nernst nos dice que un potencial de media celda cambiará en 59 milivoltios por cambio de 10 veces en la concentración de una sustancia involucrada en una oxidación o reducción de un electrón; para procesos de dos electrones, la variación será de 28 milivoltios por década de cambio de concentración. Así, para la disolución del cobre metálico
\[Cu_{(s)} \rightarrow Cu^{2+} + 2e^–\]
el potencial
\[E = (– 0.337) – 0.0295 \log_{10} [Cu^{2+}]\]
se vuelve más positiva (la reacción tiene una mayor tendencia a tener lugar) a medida que disminuye la concentración de iones cúpricos. Esto, por supuesto, es exactamente lo que predice el Principio de Le Chatelier; cuanto más diluido sea el producto, mayor será la extensión de la reacción.

Electrodos con aplomo
La ecuación justo arriba para la media celda Cu/Cu 2 + plantea una pregunta interesante: supongamos que sumerges un trozo de cobre en una solución de agua pura. Con Q = [Cu 2 +] = 0, ¡la diferencia de potencial entre el electrodo y la solución debería ser infinita! ¿Estás en peligro de ser electrocutado? No necesitas preocuparte; sin ninguna transferencia de electrones, no hay ningún cargo para zap you con. Por supuesto no pasará mucho tiempo antes de que algunos iones Cu 2 + aparezcan en la solución, y si solo hay unos pocos iones de este tipo por litro, el potencial se reduce a solo unos 20 voltios. Más al punto, sin embargo, el sistema está tan lejos del equilibrio (por ejemplo, no hay suficientes iones para poblar la doble capa eléctrica) que la ecuación de Nernst realmente no da resultados significativos. Se dice que un electrodo de este tipo está desestabilizado. ¿Qué concentración iónica se necesita para apositar un electrodo? Realmente no lo sé, pero sospecharía de cualquier cosa muy por debajo de 10 —6 M.
Los iones de carga opuesta tienden a asociarse en pares de iones poco unidos en soluciones más concentradas, reduciendo así el número de iones que son libres para donar o aceptar electrones en un electrodo. Por esta razón, la ecuación de Nernst no puede predecir con precisión potenciales de media célula para soluciones en las que la concentración iónica total excede aproximadamente 10 —3 M.

¡Cómo el potencial celular realmente depende de la concentración! La ecuación de Nernst predice con precisión los potenciales celulares solo cuando el término de cociente de equilibrio Q se expresa en actividades. Las actividades iónicas se apartan cada vez más de las concentraciones cuando estas últimas superan los 10 —4 a 10 —5 M, dependiendo de los tamaños y cargas de los iones.
Si la ecuación de Nernst se aplica a soluciones más concentradas, los términos en el cociente de reacción Q deben expresarse en “concentraciones efectivas” o actividades de las especies iónicas electroactivas. El coeficiente de actividad\(\gamma\)) relaciona la concentración de un ion con su actividad a en una solución dada a través de la relación
\[a = \gamma c\]
Dado que los potenciales de electrodo miden las actividades directamente, los coeficientes de actividad se pueden determinar mediante la realización de mediciones apropiadas de CEM en células en las que se conoce la concentración del ion de interés. El Es resultante puede entonces ser utilizado para convertir concentraciones en actividades para su uso en otros cálculos que involucran constantes de equilibrio.
Potenciales celulares y pH: diagramas de estabilidad
Como la mayoría de nosotros recordamos de nuestras luchas con el equilibrio de ecuaciones redox en los cursos iniciales de química, muchas reacciones de transferencia de electrones involucran iones de hidrógeno e iones hidróxido. Por lo tanto, los potenciales estándar para estas reacciones se refieren al pH, ya sea 0 o 14, al que el ion apropiado tiene actividad unitaria. Debido a que a menudo están involucrados múltiples números de iones H + u OH —, los potenciales dados por la ecuación de Nernst pueden variar mucho con el pH. Frecuentemente es útil observar la situación de otra manera considerando qué combinaciones de potencial y pH permiten la existencia estable de una especie en particular. Esta información se expresa de manera más útil por medio de un E -vs. -Diagrama de pH, también conocido como diagrama Pourbaix.
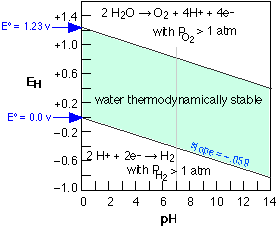
Como se señaló en relación con la región sombreada en la figura siguiente, el agua está sujeta a descomposición por agentes oxidantes fuertes como Cl 2 y por agentes reductores más fuertes que H 2. La reacción de reducción puede escribirse como
\[2H^+ + 2e^– \rightarrow H_{2}(g) \]
o, en soluciones neutras o alcalinas como
\[2H_2O + 2 e^– \rightarrow H_{2}(g) + 2 OH^–\]
Estas dos reacciones son equivalentes y siguen la misma ecuación de Nernst
\[E_{H^+/H_2} = E_{H^+/H_2}^o + \dfrac{RT}{nF} \ln \left( \dfrac{[H^+]^2} {P_{H_2}} \right)\]
que, a 25°C y la presión parcial de la unidad H 2 reduce a
\[E = E° - \dfrac{0.059}{2} × 2 pH = –0.059\; pH\]
Del mismo modo, la oxidación del agua
\[2H_2O \rightarrow O_{2}(g) + 4 H^+ + 2 e^–\]
se rige por la ecuación de Nernst
\[ E_{O_2/H_2O} = E_{O_2/H_2O}^o + \dfrac{RT}{nF} \ln \left( P_{O_2}[H^+]^4 \right)\]
que de manera similar se convierte en E = 1.23 — 0.059 pH, por lo que las parcelas E-vs -pH para ambos procesos tienen pendientes idénticas y producen el diagrama de estabilidad para el agua en la Figura\(\PageIndex{2}\). Este diagrama de Pourbaix tiene especial relevancia para la corrosión electroquímica de los metales. Así, los metales por encima del hidrógeno en la serie de actividad tenderán a sufrir oxidación (corrosión) al reducir los iones H + o el agua.
Debido a que el cloro es ampliamente utilizado como desinfectante para el agua potable, las piscinas y el tratamiento de aguas residuales, vale la pena mirar su diagrama de estabilidad. Nótese que el agente bactericida efectivo no es Cl 2 en sí, sino su producto de oxidación ácido hipocloroso HOCl el cual predomina a valores de pH por debajo de su pK a de 7.3. Tenga en cuenta también que
- Cl 2 es inestable en agua excepto a pH muy bajo; se descompone en HOCl y Cl —.
- El ácido hipocloroso y su anión son oxidantes más fuertes que el O 2 y por lo tanto están sujetos a descomposición en agua. La única especie estable de cloro en el agua es Cl —.
- La descomposición del HOCl ocurre muy lentamente en la oscuridad, pero es catalizada por la luz solar. Por esta razón, el cloro en las piscinas exteriores debe renovarse frecuentemente.
- La descomposición de Cl 2 y HOCl por reacción con material orgánico en sistemas municipales de suministro de agua a veces hace necesario inyectar cloro adicional en lugares periféricos.
Cada línea continua representa una combinación de E y pH en la que las dos especies a cada lado de la misma pueden coexistir; en todos los demás puntos, solo una sola especie es estable. Obsérvese que los equilibrios entre especies separadas por líneas diagonales dependen tanto de E como de pH, mientras que los separados por líneas horizontales o verticales se ven afectados por el pH solo o solo E, respectivamente.
Los diagramas de estabilidad son capaces de condensar una gran cantidad de información en una representación compacta, y son ampliamente empleados en geoquímica e ingeniería de corrosión. El diagrama de Pourbaix para hierro es uno de los ejemplos más comúnmente vistos.
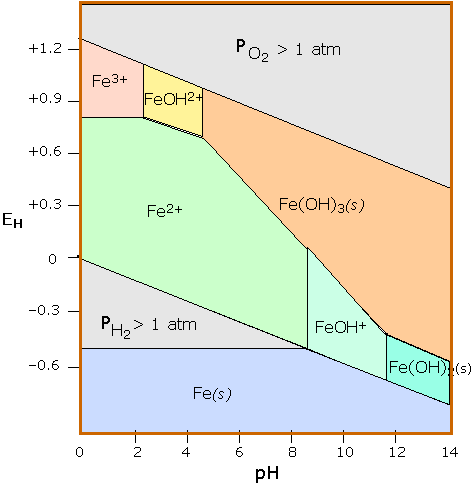
Diagrama Pourbaix para hierro. En este diagrama se representan tres estados de oxidación del hierro (0, +2 y +3). Las regiones de estabilidad para los estados de hierro oxidado se muestran solo dentro de la región de estabilidad de H 2 O. Los equilibrios entre especies separadas por líneas verticales dependen solo del pH.
El estado de oxidación +3 es el único estable en ambientes en los que el nivel de oxidación es controlado por O 2 atmosférico. Esta es la razón por la que la corteza terrestre contiene óxidos de hierro, los cuales se desarrollaron sólo después de la aparición de plantas verdes que son la fuente del O 2. El hierro es atacado por H + para formar H 2 y Fe (II); este último reacciona luego con O 2 para formar los diversos óxidos de Fe (III) coloreados que constituyen “óxido”. No se muestran muchas otras especies tales como óxidos y óxidos hidratados. Un diagrama realmente “completo” para el hierro necesitaría tener al menos dos dimensiones adicionales que muestren las presiones parciales de O 2 y CO 2.
Células de concentración
De tu estudio de termodinámica puedes recordar que el proceso
soluto (concentrado) → soluto (diluido)
se acompaña de una caída en la energía libre, y por lo tanto es capaz de hacer trabajo en el entorno; todo lo que se requiere es alguna forma práctica de plasmar esta obra. Una forma de hacerlo es por medio de una célula de concentración como
Cu (s) | Cuno 3 (.1 M) || CuNo 3 (.01 M) | Cu (s)
cátodo: Cu 2 + (.1 M) + 2 e — → Cu (s)
ánodo: Cu (s) → Cu 2 + (.01 M) + 2 e —
neto: Cu 2 + (.1 M) → Cu 2 + (.01 M)
que representa el transporte de iones cúpricos de una región de mayor concentración a una de menor concentración.
La fuerza impulsora para este proceso es el cambio de energía libre ΔG asociado al gradiente de concentración (C 2 — C 1), a veces conocido como la energía libre de dilución:
\[ΔG_{dilution} = RT \ln(C_2 – C_1)\]
Tenga en cuenta, sin embargo, que los iones Cu 2 + no necesitan moverse físicamente entre los dos compartimentos; el flujo de electrones a través del circuito externo crea un flujo “virtual” ya que los iones de cobre se crean en el lado de baja concentración y se descargan en el electrodo opuesto. Los iones nitrato también deben pasar entre las células para mantener la electroneutralidad. La ecuación de Nernst para esta celda es
\[E = E^° - \left(\dfrac{0.059}{n}\right) \log_{10} Q = 0 - 0.29 \log_{10} 0.1 = +0.285 \,V\]
Obsérvese que\(E^°\) para una celda de concentración siempre es cero, ya que este sería el potencial de una celda en la que las especies electroactivas se encuentran en unidad de actividad en ambos compartimentos.
\(E^°\)para una celda de concentración es siempre cero,


