16.7: Cronología del desarrollo de la batería
- Page ID
- 70756
Si bien las baterías prácticas de desarrollo paralelaron en gran medida la expansión de la tecnología eléctrica a partir de mediados del siglo XIX en adelante, ahora se piensa que un tipo de batería muy primitivo aparentemente estaba en uso hace más de 2000 años. La breve popularidad de los automóviles alimentados eléctricamente en la década de 1920 alentó el desarrollo de baterías de almacenamiento. El uso generalizado de dispositivos eléctricos portátiles “personales” ha mantenido muy viva la búsqueda de mejores baterías.
|
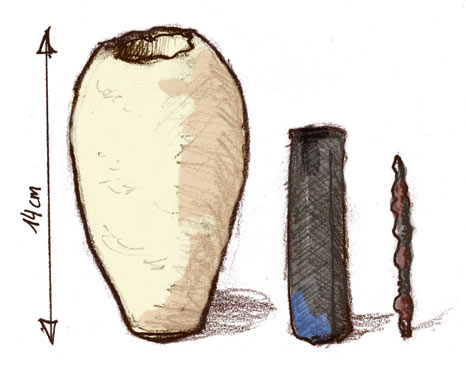
“Batería de Bagdad” - ¿1000 a. C.?
Dibujo de las tres piezas. (CC-BY-SA 2.5; Ironía) |
Jarras de barro que contenían una varilla de hierro rodeada por un cilindro de cobre fueron descubiertos cerca de Bagdad en 1938. Se cree que fueron utilizados por la civilización parta que ocupó la región hace unos 2000 años como fuente de electricidad para chapar oro sobre plata. |
|
Allesandro Volta 1782
|
Su “pila Voltáica”, una pila de discos de zinc y plata separados por un paño húmedo que contenía una sal o una solución ácida débil, fue la primera batería conocida por la civilización occidental. |
| Sir Humphry Davy 1813 | Davy construye una batería de 2000 placas que ocupa 889 pies cuadrados en el sótano de la Royal Society de Gran Bretaña. Sus baterías anteriores proporcionaban energía para la primera demostración pública de iluminación eléctrica (arco de carbono). |
| Michael Faraday, 1830's | Faraday descubrió los fundamentos de las celdas galvánicas y la electrólisis que ponen a la electroquímica sobre una base científica firme. |
|
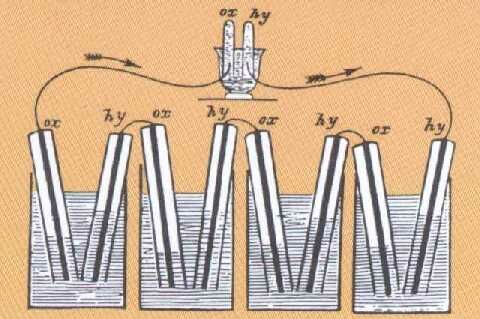
1836 - Célula Daniell (también conocida como Célula de Pie de Cuervo o Gravedad.)
|
John Daniell (químico y meterólogo inglés) desarrolló la primera celda de almacenamiento moderna basada en los principios de Faraday. Este consiste en una gran jarra de vidrio con un electrodo de cobre en forma de estrella en la parte inferior y un electrodo en forma de “pata de gallo” de zinc suspendido cerca de la parte superior. El fondo de la jarra se llenó con una solución concentrada de sulfato de cobre. Encima de esto se vertió ácido sulfúrico diluido, cuya menor densidad lo mantuvo en la parte superior. Esta fue la primera batería práctica en encontrar un amplio uso para alimentar telégrafos y sistemas de señalización ferroviaria y timbres domésticos. |
|
1839 - William Grove (Galés)
|
Grove fue mejor conocido en el siglo XIX por su “batería de ácido nítrico” que entró en amplio uso en la telegrafía temprana.
Ahora, sin embargo, es más famoso por su “batería de gas voltaico” en la que descubrió la “electrólisis inversa”: la recombinación de H 2 y O 2 tras la electrólisis del agua en electrodos de platino. Esta fue la primera demostración de lo que ahora conocemos como la pila de combustible hidrógeno-oxígeno (ver más abajo). |
|
1859 - Gaston Planté (Francés)
|
Inventa la primera celda de almacenamiento de plomo-ácido la cual consistió en dos láminas de plomo separadas por una lámina de caucho, enrolladas en espiral y sumergidas en ácido sulfúrico diluido. |
|
1866 - Georges Leclanché (Francés)
|
Para 1868 se utilizaban veinte mil celdas Leclanché en los sistemas telegráficos. Las celdas originales de Leclanché fueron construidas en macetas porosas que eran pesadas y sujetas a rotura. Dentro de veinte años otros inventores habían modificado el diseño en lo que ahora conocemos como “celdas secas” que se volvieron ampliamente utilizadas en las primeras linternas (1909) y en las radios a batería de la década de 1920. |
|
1881 - Faure y otros
|
Desarrollo de la primera celda práctica de almacenamiento de plomo-ácido. La mayor mejora sobre el diseño de Planté fue la adición de una pasta de PbSO 4 a la placa positiva. |
|
1905 Celda de níquel-hierro
|
Edison, que era tanto químico como inventor integral, pensó que el plomo en las células tipo Planté las hacía demasiado pesadas, y que tener ácido en contacto con cualquier metal era una idea intrínsecamente mala. Después de mucha experimentación, desarrolló una exitosa batería alcalina. La celda Edison utiliza un ánodo de hierro, cátodo de óxido de níquel y electrolito de KOH. Esta celda es extremadamente resistente y todavía se usa en ciertas aplicaciones industriales, pero nunca fue capaz de desplazar la celda de plomo-ácido como Edison había esperado. |
| década de 1950 | Una celda similar, que empleaba un ánodo de níquel en lugar de hierro, fue la primera celda recargable que era lo suficientemente pequeña para ser utilizada en dispositivos portátiles de consumo. Su principal desventaja es que se arruina por la descarga completa. |
| 1949 - Celda seca alcalina - Lew Urry (Eveready Battery Co.) |
Primera celda seca alcalina comercial. Estos sustituyen al KOH por el corrosivo NH 4 Cl usado en las celdas secas más antiguas y duran 5-8 veces más. |
| 1947 - Celda de mercurio (Ruben y Mallory, 1950's) |
Esta fue una de las primeras celdas tipo “botón” que fueron ampliamente utilizadas en cámaras y audífonos. La constancia de la salida de 1.34 v los hizo populares para su uso en instrumentos sensibles y marcapasos cardíacos. La reacción celular neta es Zn (s) + HGo (s) → ZnO (s) + Hg (l) La mayoría de los países han prohibido las ventas de estas celdas con el fin de reducir la contaminación del medio ambiente por mercurio. |
|
Celdas de níquel-cadmio (NiCad)
|
La celda NiCad se convierte rápidamente en una de las baterías recargables más populares para pequeños dispositivos de consumo. Pueden entregar alta corriente y someterse a cientos de ciclos de carga/descarga. Debido a que el cadmio es una toxina ambiental, se está desalentando su uso. |
| 1959 - Pila de combustible - Francis Bacon (Reino Unido) | La primera pila de combustible práctica fue desarrollada por el ingeniero británico Francis Bacon (1904-1992). Esta celda de hidrógeno-oxígeno utilizó un electrolito alcalino y electrodos de níquel de bajo costo. |
|
Finales de los años 60 - Celdas de hidruro de níquel metal
|
El ion hidruro H — sería un material catódico ideal excepto por el hecho de que su producto de oxidación H2 es un gas. El descubrimiento de que ciertos compuestos como LinI 5 y ZrNi 2 pueden actuar como “esponjas de hidrógeno” hizo práctico emplear hidruros metálicos como material catódico. Una peculiaridad de las células Ni-MH es que recargarlas es un proceso exotérmico, por lo que se debe permitir una disipación adecuada del calor. Estas baterías son ampliamente utilizadas en teléfonos celulares, computadoras y herramientas eléctricas portátiles. Las reacciones de los electrodos tienen lugar en un electrolito KOH concentrado: Cátodo (+): NiOOH + H 2 O + e — → Ni (OH) 2 + OH — Ánodo (-): (1/x) MH x + OH — → (1/x) M + H 2 O + e — |
|
1990 - Celdas de litio (Sony Corp.)
|
El litio es un material de ánodo ideal debido a su baja densidad y alto potencial de reducción, lo que hace que las celdas basadas en Li sean las formas más compactas de almacenar energía eléctrica. Las células de litio se utilizan en relojes de pulsera, marcapasos cardíacos y cámaras digitales. Tanto los tipos primarios (no recargables) como los recargables han estado disponibles desde hace algún tiempo. Las aplicaciones más recientes se encuentran en herramientas eléctricas portátiles y, quizás lo más importante, en automóviles híbridos o eléctricos. Las celdas de litio modernas operan transportando iones Li + entre electrodos en los que los iones pueden insertarse o intercalarse. Los cátodos son óxidos de metal de transición de litio como LiCoO 3, mientras que los ánodos son carbono que contienen litio, LiC 6. La especie que sufre oxidación-reducción no es el litio, sino el metal de transición, por ejemplo, Co (III) -Co (IV). |
Baterías de litio como dispositivos incendiarios
Se han registrado numerosos reportes de incendios y explosiones asociadas a baterías de litio. En 2006, Dell Corporation tuvo que retirar 4.1 millones de baterías Sony que se habían enviado con las computadoras portátiles de Dell y que se consideró que estaban en riesgo debido a un defecto de fabricación. Esto ilustra la dificultad de concentrar una gran cantidad de energía química en un paquete pequeño, que es, por supuesto, el objetivo de todos los desarrolladores de baterías ansiosos por satisfacer las demandas comerciales que van desde la electrónica personal de consumo hasta los automóviles eléctricos. Los cátodos de óxido de litio y cobalto con deficiencia de Li + completamente cargados son inherentemente inestables, mantenidos bajo control solo por una fina membrana aislante que, si se rompen accidentalmente, puede conducir a una fuga térmica que involucra oxígeno gaseoso, carbono, solventes orgánicos y (en algunos casos) clorato de litio, todos los componentes necesarios para un fuego feroz.
Gran parte de la investigación se ha dedicado al desarrollo de membranas a prueba de fallas. En un tipo, fabricado por ExxonMobil y dirigido al mercado automotriz, los poros están diseñados para cerrar y así inhibir el paso de iones de litio cuando la temperatura sube por encima de un nivel seguro.
Baterías Biológicas
Por último, debemos mencionar las baterías biológicas que se encuentran en una serie de peces eléctricos. Los “órganos eléctricos” de estos peces son células musculares modificadas conocidas como electrocitos que están dispuestas en pilas largas. Una señal neural del cerebro hace que todos los electrocitos de una pila se polarizan simultáneamente, creando en efecto una batería hecha de células conectadas en serie. La mayoría de los peces eléctricos producen solo una pequeña tensión que utilizan para la navegación, mucho en la forma en que los murciélagos utilizan el sonido para la ubicación del eco de las presas. La famosa anguila eléctrica, sin embargo, es capaz de producir una sacudida de 600 voltios que emplea para aturdir a las presas cercanas.