16.8: Corrosión Electroquímica
- Page ID
- 70736
Asegúrate de entender a fondo las siguientes ideas esenciales. Es especialmente importante que conozcas los significados precisos de todos los términos resaltados en el contexto de este tema.
- La corrosión electroquímica de los metales ocurre cuando los electrones de los átomos en la superficie del metal se transfieren a un aceptor o despolarizador de electrones adecuado. El agua debe estar presente para servir como medio para el transporte de iones.
- Los despolarizadores más comunes son el oxígeno, los ácidos y los cationes de metales menos activos.
- Debido a que los electrones fluyen a través del propio objeto metálico, las regiones anódica y catódica (las dos mitades de la celda electroquímica) pueden estar en ubicaciones ampliamente separadas.
- Las regiones anódicas tienden a desarrollarse en lugares donde el metal está estresado o está protegido del oxígeno.
- El contacto con otro tipo de metal, ya sea directo o indirecto, puede conducir a la corrosión del más activo.
- La corrosión del acero puede ser inhibida por galvanización, es decir, recubriéndolo con zinc, un metal más activo cuya disolución deja una carga negativa sobre el metal que inhibe la posterior disolución del Fe 2+.
- La protección catódica que utiliza una fuente de voltaje externa es ampliamente utilizada para proteger estructuras subterráneas como tanques, tuberías y muelles. La fuente puede ser un ánodo de sacrificio de zinc o aluminio, o una fuente de alimentación accionada por línea o fotovoltaica.
La corrosión puede definirse como el deterioro de los materiales por procesos químicos. De estos, el más importante con diferencia es la corrosión electroquímica de los metales, en la que el proceso de oxidación M → M + e — se ve facilitado por la presencia de un aceptor de electrones adecuado, a veces referido en la ciencia de la corrosión como despolarizador.
En cierto sentido, la corrosión puede verse como el retorno espontáneo de los metales a sus minerales; las enormes cantidades de energía que se consumieron en la minería, refinación y fabricación de metales en objetos útiles se disipa por una variedad de rutas diferentes. Los aspectos económicos de la corrosión son mucho mayores de lo que la mayoría de la gente cree; el costo estimado de la corrosión solo en Estados Unidos fue de 276 mil millones de dólares al año. De esto, se gastaron cerca de 121 mil millones de dólares para controlar la corrosión, dejando la diferencia de 155 mil millones de dólares como pérdida neta para la economía. Los servicios públicos, especialmente los sistemas de agua potable y alcantarillado, sufren el mayor impacto económico, siendo los vehículos motorizados y el transporte un segundo cercano.
Células de corrosión y reacciones
La característica especial de la mayoría de los procesos de corrosión es que las etapas de oxidación y reducción ocurren en ubicaciones separadas en el metal. Esto es posible porque los metales son conductores, por lo que los electrones pueden fluir a través del metal desde las regiones anódicas a las catódicas (Figura\(\PageIndex{1}\)). La presencia de agua es necesaria para transportar iones hacia y desde el metal, pero una fina película de humedad adsorbida puede ser suficiente.
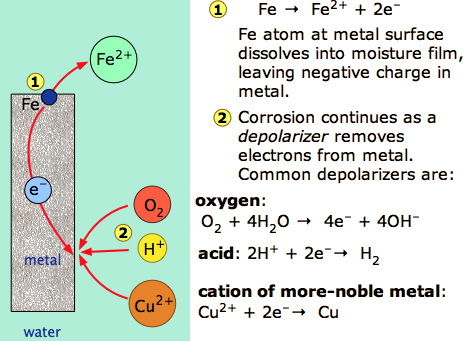
Un sistema de corrosión puede considerarse como una celda electroquímica cortocircuitada en la que el proceso anódico es algo así como
\[\ce{Fe(s) \rightarrow Fe^{2+}(aq) + 2 e^{-}} \label{1.7.1}\]
y las etapas catódicas pueden invocar la reducción del gas oxígeno
\[ \ce{O_2} + \ce{2 H_2O} + \ce{4e^{-}} \rightarrow \ce{4 OH^{-}} \label{1.7.2}\]
o la reducción de protones
\[ \ce{H^{+} + e^{-}} \rightarrow \ce{1/2 H2(g)} \label{1.7.2b} \]
o la reducción de un ion metálico
\[\ce{M^{2+} + 2 e^{–}} \rightarrow \ce{M(s)} \label{1.7.2c}\]
donde\(\ce{M}\) es un metal.
Qué partes del metal sirven como ánodos y cátodos pueden depender de muchos factores, como se puede ver a partir de los patrones de corrosión irregulares que se observan comúnmente. Los átomos en regiones que han sufrido tensiones, como podrían producirse por conformación o mecanizado, suelen tener energías libres más altas y, por lo tanto, tienden a volverse anódicas.
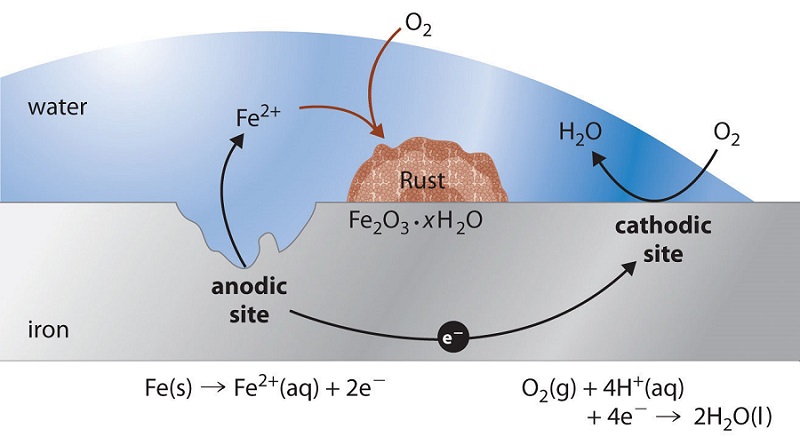
Si una parte de un objeto metálico está protegida de la atmósfera para que no sea suficiente\(\ce{O2}\) para construir o mantener la película de óxido, esta región “protegida” a menudo será el sitio en el que la corrosión es más activa. El hecho de que tales sitios suelen estar ocultos a la vista explica gran parte de la dificultad para detectar y controlar la corrosión.

A diferencia de los sitios anódicos, que tienden a localizarse en regiones específicas de la superficie, la parte catódica del proceso puede ocurrir casi en cualquier lugar. Debido a que los óxidos metálicos suelen ser semiconductores, la mayoría de los recubrimientos de óxido no inhiben el flujo de electrones a la superficie, por lo que casi cualquier región que esté expuesta a\(\ce{O2}\) o a algún otro aceptor de electrones puede actuar como cátodo. La tendencia de las ubicaciones privadas de oxígeno a convertirse en anódicas es la causa de muchos patrones de corrosión comúnmente observados.
Autos oxidados y manchas de baño
Cualquiera que haya sido dueño de un automóvil más viejo ha visto la corrosión en las juntas entre las partes del cuerpo y debajo de las películas de pintura. También habrás notado que una vez que comienza la corrosión, tiende a alimentarse de sí misma. Una razón de esto es que uno de los productos de la reacción de reducción de O 2 es el ion hidróxido. El alto pH producido en estas regiones catódicas tiende a destruir la película protectora de óxido, e incluso puede ablandar o debilitar las películas de pintura, de manera que estos sitios pueden volverse anódicos. El mayor suministro de electrones promueve una acción catódica más intensa, que genera aún más sitios anódicos, y así sucesivamente.

Una causa muy común de corrosión es tener dos metales diferentes en contacto, como podría ocurrir cerca de un sujetador o en una junta de soldadura. La humedad se acumula en el punto de unión, actuando como electrolito y formando una celda en la que los dos metales sirven como electrodos. La humedad y las sales conductoras en las superficies exteriores proporcionan un camino conductor externo, cortocircuitando efectivamente la celda y produciendo una corrosión muy rápida; es por eso que los autos se oxidan tan rápidamente en lugares donde se coloca sal en las carreteras para derretir el hielo.
La corrosión de metales disímiles puede ocurrir incluso si los dos metales no están inicialmente en contacto directo. Por ejemplo, en los hogares donde se usa tubería de cobre para plomería, siempre hay una pequeña cantidad de disuelto\(\ce{Cu^{2+}}\) en el agua. Cuando esta agua se encuentra con tuberías de acero o un desagüe de fregadero de baño cromado, el cobre más noble se depositará sobre el otro metal, produciendo una nueva celda de corrosión de metales en contacto. En el caso de los accesorios cromados para lavabos de baño, esto conduce a la formación de\(\ce{Cr^{3+}}\) sales que precipitan como manchas verdosas.
Control de Corrosión
Dado que tanto las etapas catódica como anódica deben tener lugar para que se produzca la corrosión, la prevención de cualquiera de las dos detendrá la corrosión. La estrategia más obvia es detener ambos procesos recubriendo el objeto con una pintura u otro recubrimiento protector. Incluso si esto se hace, es probable que haya lugares donde el recubrimiento se rompa o no penetre, particularmente si hay agujeros o roscas de tornillo. Un enfoque más sofisticado es aplicar una ligera carga negativa al metal, dificultando así que se produzca la reacción:
\[\ce{M -> M^{2+} + 2 e^{-}}.\]
Método de Protección 1: Recubrimientos Sacrificiales
Una forma de suministrar esta carga negativa es aplicar un recubrimiento de un metal más activo. Por lo tanto, una forma muy común de proteger el acero de la corrosión es recubrirlo con una fina capa de zinc; este proceso se conoce como galvanizado.El recubrimiento de zinc, al ser menos noble que el hierro, tiende a corroerse selectivamente. La disolución de este recubrimiento sacrificial deja atrás electrones que se concentran en el hierro, haciéndolo catódico e inhibiendo así su disolución.
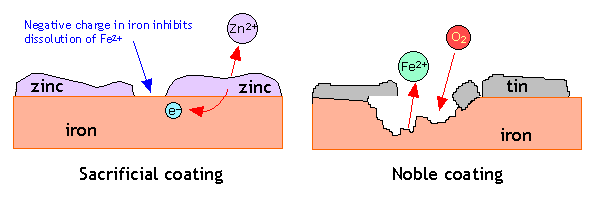
El efecto del chapado de hierro con un metal menos activo proporciona un contraste interesante. La lata estañada común (a la derecha) es un buen ejemplo. Mientras el recubrimiento de estaño permanezca intacto, todo está bien, pero la exposición de incluso una pequeña parte del hierro subyacente a la atmósfera húmeda inicia la corrosión. Los electrones liberados del hierro fluyen hacia el estaño, haciendo que el hierro sea más anódico por lo que ahora el estaño está promoviendo activamente la corrosión del hierro! Probablemente hayas observado cómo las latas de hojalata se desintegran muy rápidamente cuando se dejan al aire libre.
Método de Protección 2: Protección Catódica
Una estrategia más sofisticada es mantener una carga eléctrica negativa continua sobre un metal, de manera que se inhiba su disolución como iones positivos. Dado que toda la superficie es forzada a entrar en la condición catódica, este método se conoce como protección catódica. La fuente de electrones puede ser una fuente de alimentación externa de corriente continua (comúnmente utilizada para proteger oleoductos y otras estructuras enterradas), o puede ser la corrosión de otro metal más activo como una pieza de zinc o aluminio enterrado en el suelo cercano, como se muestra en la ilustración del enterrado tanque de almacenamiento de propano debajo.



