3.8.2: Medio ambiente- Gas
- Page ID
- 76070
Es posible que hayas notado que la gasolina “E85" se vendía por $2.39/galón para vehículos FlexFuel mientras que la gasolina regular se vendía por $2.79 ¿Es ventajoso el uso de E85 si tiene un vehículo FlexFuel capaz de usar E85 (85% de etanol) o gas regular? Tenga en cuenta que muchos estados venden gas regular que es E10 (etanol al 10%) para vehículos estándar (no Flexfuel).
|
85% de etanol en una bomba moderna |
El modelo T se diseñó por primera vez para funcionar con etanol [1] |
Realmente hay (al menos) dos preguntas aquí:
1. ¿Es un buen negocio para el consumidor (es económica la energía del etanol)?
2. ¿Es un buen negocio para el medio ambiente (es favorable el Balance Energético)?
El Balance Energético
El balance energético es la relación de la energía producida por 1 kg del combustible (es decir, etanol), a la energía necesaria para producirlo (cultivo de plantas, fermentación, transporte, riego, etc.). El balance energético para el etanol en EU es de tan solo 1.3 a 1.6 (obtenemos 1.3-1.6 J de salida para 1 J de entrada de energía), mientras que en Brasil es de 8.3 a 10.2. [2] [3]
El balance energético para el petróleo es de aproximadamente 5: Hoy en día, alrededor de 5 barriles de petróleo extraídos por cada 1 barril de petróleo se consumen en el proceso (hace un siglo, cuando el petróleo era más abundante la proporción era de 50:1). [4]
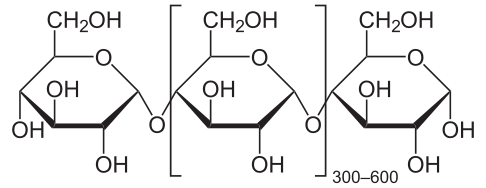
La razón del pobre balance energético para el etanol combustible en EU es que utilizamos maíz. Extraemos la maicena, y luego la hidrolizamos a altas temperaturas (superiores a 90 o C y fermentamos los azúcares resultantes para dar el etanol (sacarificación y fermentación simultáneas, SSF). Se están desarrollando procesos más eficientes energéticamente. [5] El almidón es un polímero de glucosa compuesto por amilosa (que se muestra a continuación) y amilopectina, un polímero similar con más ramificación. Las reacciones químicas que ocurren son primero, hidrólisis de almidones a maltosa (C 12 H 22 O 11):
-
- [C 6 H 10 O 5] n + n/2 H 2 O → n/2 C 12 H 22 O 11 (1)
 |
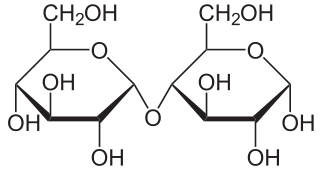 |
| Amilosa | Maltosa |
El complejo de azúcar maltosa se hidroliza adicionalmente (a veces en el mismo paso) a glucosa (C 6 H 12 O 6):
-
- C 12 H 22 O 11 + H 2 O → 2 C 6 H 12 O 6 (2)
Finalmente, durante la fermentación de etanol, la glucosa se descompone en etanol (C 2 H 5 OH) y dióxido de carbono.
-
- C 6 H 12 O 6 → 2 C 2 H 5 OH + 2 CO 2 + calor (3)
Switchgrass requiere un procesamiento similar, pero tiene el potencial de un mayor balance energético. En Brasil, la caña de azúcar se utiliza en la producción de etanol, eliminando la reacción de alto costo energético (1), debido a que la caña de azúcar produce sacarosa, un azúcar similar a la maltosa. En todos los casos, es necesario un gran gasto energético para separar el etanol del agua en la que tienen lugar las reacciones, y otras impurezas.
 |
← Switchgrass |
 Maíz |
Pero incluso en Brasil, el aumento de los costos del azúcar provocó un repunte en la dependencia del petróleo, y los vehículos con capacidad E100 disminuyeron drásticamente a fines de la década de 1980 [6]. Sin embargo, la existencia de bombas de etanol en un gran porcentaje de estaciones de servicio ha ayudado a sostener el uso de otras mezclas. Claramente, la economía y la historia del uso del combustible deben estudiarse cuidadosamente al invertir en el desarrollo futuro del combustible.
La ventaja de costos
Entonces, ¿cuál es una mejor oferta: llenar tu tanque de 10 galones con E85 que cuesta $2.69/galón o con gasolina que cuesta $2.99/galón? [7].
Los cambios energéticos que acompañan a las reacciones químicas casi siempre se expresan mediante ecuaciones termoquímicas. Por ejemplo, durante la combustión el etanol reacciona con el oxígeno para producir dióxido de carbono, vapor de agua y calor de acuerdo con la ecuación termoquímica:
-
- C 2 H 5 OH + 3 O 2 → 2 CO 2 + 3 H 2 O (l) (4) ΔH m = -1367 kJ [8]
La cantidad Δ H m es el cambio de entalpía para la ecuación de reacción tal como está escrito. En este contexto el símbolo Δ (delta) significa cambio en” mientras que H es el símbolo de la cantidad que se está cambiando, es decir, la entalpía. Trataremos la entalpía con cierto detalle en el Cap. 15. Por el momento podemos pensarlo como una propiedad de la materia que aumenta cuando la materia absorbe energía y disminuye cuando la materia libera energía. Aquí el Δ H m (subíndice delta H m) nos indica si la energía térmica se libera o se absorbe cuando se produce la reacción y también nos permite encontrar la cantidad real de energía involucrada. Por convención, si Δ H m es positivo, el calor es absorbido por la reacción; es decir, es endotérmico. Más comúnmente, Δ H m es negativo como en la Ec. (3), lo que indica que la energía térmica es liberada en lugar de absorbida por la reacción, y que la reacción es exotérmica. Esta convención sobre si Δ H m es positiva o negativa mira el cambio de calor en términos de la materia realmente involucrada en la reacción y no en su entorno. En la reacción en la Ec. (4), se han formado enlaces más fuertes, lo que lleva a una disminución de la energía potencial, y es esta disminución la que se indica por un valor negativo de Δ H m.
Es importante notar que la cantidad de calor liberado o absorbido por una reacción es proporcional a la cantidad de cada sustancia consumida o producida por la reacción. Así, la Eq. (4) nos dice que se emiten 1367 kJ de energía térmica por cada mol de C 2 H 5 OH que se consume. Alternativamente, nos dice que se liberan 1367 kJ por cada 3 moles de H 2 O producidos, o cada 2 moles de dióxido de carbono producidos, o cada 3 moles de oxígeno consumido. Visto de esta manera, Δ H m es un factor de conversión que nos permite calcular el calor absorbido cuando se consume o produce una cantidad dada de sustancia. Si q es la cantidad de calor absorbido y n es la cantidad de sustancia involucrada, entonces
\(\Delta H_{\text{m}}=\frac{q}{n}\)(5) La ecuación (4) representa el calor estándar de combustión, el cual está relacionado con el “mayor valor calorífico” de un combustible. [9] Debido a que el agua líquida se produce en la Ecuación (4) y se da el calor (1367 kJ/mol) para una reacción teórica que ocurre a 25 o C, es solo una aproximación del calor producido en una combustión real, donde la reacción tiene lugar a una temperatura alta y produce vapor de agua. Una mejor estimación puede ser el Valor Calefactor Inferior (LHV) que se ajusta agregando el calor de vaporización del agua, y el calor requerido para elevar la temperatura de los reactivos a la temperatura de combustión y los productos a 150 o C (un estándar elegido arbitrariamente). [10] [11] Usaremos el LHV para etanol, -1330 kJ/mol, [12] y abreviaremos etanol (C 2 H 5 OH) como EtOH para calcular el calor en 1 galón de etanol:
\(V_{\text{EtOH}}~\xrightarrow{M}~m_{\text{EtOH}}\text{ }\xrightarrow{M}\text{ }n_{\text{EtOH}}~\xrightarrow{\Delta H_{m}}~q\)
para que
\ (q=\ texto {1 galón EtOH} ~\ horas~\ frac {\ texto {3.79 L}} {\ texto {1 galón}} ~\ horas~\ frac {\ texto {1000 mL}} {\ texto {1 L}} ~\ horas~\ frac {\ texto {0.789 g}} {\ texto {mL}} ~\ horas~\ frac {\ texto {1 mol EtOH}} {\ texto {46.07 g EtOH}} ~\ horas~\ frac {-\ texto {1330 kJ}} {\ texto {mol EtOH}}\)
\(=-86~330\text{ kJ}=-\text{86}\text{.33 MJ (estimate)}\)
Podemos calcular el valor energético para el octano, que representa bastante bien la gasolina, de manera similar. La ecuación termoquímica para la combustión de octano (C 8 H 18) es:
C 8 H 18 + 25/2 O 2 → 8 CO 2 + 9 H 2 O (l) (6) ΔH ~ -5430 kJ/mol [13]
Nuevamente, utilizaremos el LHV para octano (-5064 kJ/mol [14]) en nuestro cálculo:
\ (q=\ texto {1 galón de octano}
~\ veces~\ frac {\ texto {3.79 L}} {\ texto {1 galón}}
~\ horas~\ frac {\ texto {1000 mL}} {\ texto {1 L}}
~\ horas~\ frac {\ texto {0.737 g}} {\ texto {mL}}
~\ horas~\ frac {\ texto {1 mol octano}} {\ texto {114.23 g octano}}
~\ veces~\ frac {\ texto {-5 064 kJ}} {\ texto {mol octano}}\)
\(=-123~800\text{ kJ}=-\text{123}\text{.80 MJ (estimate)}\)
Entonces 1 galón de gasolina tiene (123,800/86,330) o 1.4 veces más valor calorífico, pero cuesta solo $2.79/$2.39 o 1.2 veces más. Es la mejor compra. Si el Balance Energético solo puede ser de aproximadamente 1.3 en EU, en realidad es una pérdida neta quemar etanol, al menos al precio actual y disponibilidad del petróleo. A medida que disminuye el Balance Energético y la disponibilidad de petróleo, es mejor que desarrollemos medios de producción de etanol más eficientes energéticamente.
En efecto, con base en las pruebas EPA para todos los modelos E85 2006, la economía promedio de combustible para los vehículos E85 fue 25.56% menor que la gasolina sin plomo. [15] [16]
El valor calorífico más bajo (LHV)
Es importante darse cuenta que el valor de Δ H m dado en ecuaciones termoquímicas como (4) o (6) depende del estado físico tanto de los reactivos como de los productos. Así, si se obtuviera agua como gas en lugar de líquido en la reacción en la Ec. (4), el valor de Δ H m sería diferente de -1367 kJ. También es necesario especificar tanto la temperatura como la presión ya que el valor de Δ H m depende muy ligeramente de estas variables. Si estos no se especifican [como en la Ec. (3)] generalmente se refieren a 25°C y a la presión atmosférica normal.
Dos características más de las ecuaciones termoquímicas surgen de la ley de conservación de energía. La primera es que escribir una ecuación en la dirección inversa cambia el signo del cambio de entalpía. Por ejemplo,
H 2 O (l) → H 2 O (g) Δ H m = 44 kJ (7 a) nos dice que cuando se vaporiza un mol de agua líquida, se absorbe 44 kJ de calor. Esto corresponde a que el calor se absorbe de tu piel cuando se evapora la transpiración, y te enfrías. La condensación de 1 mol de vapor de agua, por otro lado, desprende exactamente la misma cantidad de calor. H 2 O (g) → H 2 O (l) Δ H m = —44 kJ (7 b) Para ver por qué esto debe ser cierto, supongamos que Δ H m [Eq. (7a)] = 44 kJ mientras Δ H m [Eq. (7b)] = —50.0 kJ. Si tomáramos 1 mol de agua líquida y permitiéramos que se evaporara, se absorberían 44 kJ. Entonces podríamos condensar el vapor de agua, y se desprenderían 50.0 kJ. Podríamos volver a tener 1 mol de agua líquida a 25°C pero también tendríamos 6 kJ de calor que se habían creado de la nada! Esto violaría la ley de conservación de la energía. La única manera en que el problema puede evitar es que Δ H m de la reacción inversa sea igual en magnitud pero opuesto en signo de Δ H m de la reacción hacia adelante. Es decir,
Δ H m adelante = —Δ H m atrás
Dado que la Reacción (4) produce 3 mol de H 2 O (l), produciría 3 mol x 44 kJ/mol = 132 kJ menos energía si el agua se produjera como vapor, debido a que no se incluiría el calor liberado en la condensación al líquido. El cambio de entalpía sería entonces -1367 + 132 kJ o -1235 kJ. Esto sigue siendo diferente del LHV debido al calor requerido para cambiar la temperatura de los reactivos y productos de la temperatura estándar (25 o C) a la temperatura de combustión.
Hechos sobre FlexFuel
En 2007, solo 3.3% de los autos estadounidenses eran FlexFuel y solo 1% de las estaciones de servicio proporcionaron FlexFuel, pero el porcentaje ha ido aumentando rápidamente. La producción mundial de etanol para combustible de transporte se triplicó entre 2000 y 2007 de 17 mil millones a más de 52 mil millones de litros, con 89% producido en Brasil y Estados Unidos. [17] El diferencial de precios muestra grandes cambios (fue de aproximadamente 30% en 2007). [18] El Programa Nacional de Alcohol en Brasil, líder mundial en el uso de combustible de etanol, obligó a disminuir la dependencia del petróleo después de la primera crisis petrolera en 1973, y en 1979 varios fabricantes de automóviles proporcionaron automóviles que funcionaban con etanol puro (E100). Después de llegar a más de 4 millones de automóviles y camiones ligeros que funcionan con etanol puro a finales de los 80, [3] el uso de vehículos E100 solo disminuyó drásticamente luego de que los aumentos en los precios del azúcar produjeron escasez de combustible de etanol. El énfasis ha estado en los vehículos E85 (85% de etanol) en Estados Unidos, porque los motores no arrancarán de manera confiable en E100 por debajo de aproximadamente 60 o F. Incluso E85 no se puede usar por debajo de aproximadamente 30 o F, y en los estados del norte E70 es entregado por bombas E85 sin cambiar la etiqueta. [19]
Referencias
- es.wikipedia.org/wiki/Flex_Fuel
- es.wikipedia.org/wiki/Ethanol_fuel #Comparison %20de%20Brasil%20y%20The%20U.S.
- es.wikipedia.org/wiki/Ethanol_Fuel_Energy_Balance
- es.wikipedia.org/wiki/Net_Energy_Gain
- ddr.nal.usda.gov/bitstream/10... ND43897867.pdf
- es.wikipedia.org/wiki/Flex_Fuel
- http://www.ched-ccce.org/confchem/2010/Spring2010/P7-Cummings.html
- webbook.nist.gov/cgi/cbook.cg... ERMO-condensado
- es.wikipedia.org/wiki/Higher_Heating_Value
- es.wikipedia.org/wiki/Lower_Heating_Value
- es.wikipedia.org/wiki/Heat_of_combustion
- es.wikipedia.org/wiki/Lower_Heating_Value
- http://webbook.nist.gov/cgi/cbook.cg...ermo-Condensed
- es.wikipedia.org/wiki/Lower_Heating_Value
- es.wikipedia.org/wiki/Flex_Fuel
- Goettemoeller, Jeffrey; Adrian Goettemoeller (2007). Etanol Sustentable: Biocombustibles, Biorrefinerías, Biomasa Celulósica, Vehículos Flex-Fuel y Agricultura Sustentable para la Prairie Oak Publishing, Maryville, Missouri. pp. 56—61. ISBN 978-0-9786293-0-4.
- es.wikipedia.org/wiki/Ethanol_Fuel
- es.wikipedia.org/wiki/Flex_Fuel
- es.wikipedia.org/wiki/Ethanol_Fuel





