3.8: Ecuaciones Termoquímicas
- Page ID
- 76062
Los cambios de energía que acompañan a las reacciones químicas casi siempre se expresan mediante ecuaciones termoquímicas, como
\[\text{C} H_{4} (g) + 2 \text{O}_{2} (g) \rightarrow \text{C} \text{O}_{2} (g) + 2 \text{H}_{2} \text{O} (l) \text{ (25°C, 1 atm pressure)} \\ \Delta H_{m} = –890 \text{kJ} \label{1} \]
que se muestra en el nivel atómico inferior. Para tener una idea de cómo se ve esta reacción a nivel macroscópico, echa un vistazo a las llamas del extremo derecho.
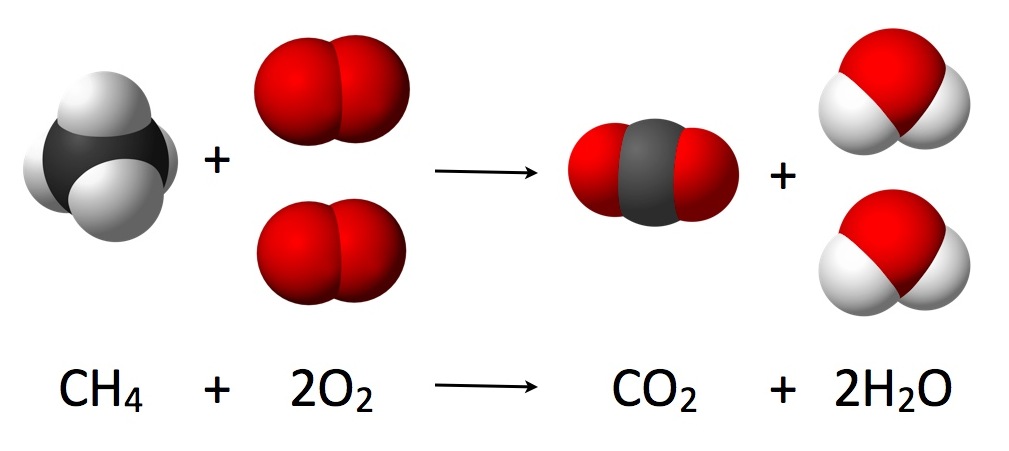


Aquí el Δ H m (subíndice delta H m) nos indica si la energía térmica es liberada o absorbida cuando la reacción ocurre tal como está escrito, y también nos permite encontrar la cantidad real de energía involucrada. Por convención, si Δ H m es positivo, el calor es absorbido por la reacción; es decir, es endotérmico. Más comúnmente, Δ H m es negativo como en la Ec. \(\ref{1}\), lo que indica que la energía térmica es liberada en lugar de absorbida por la reacción, y que la reacción es exotérmica. Esta convención sobre si Δ H m es positiva o negativa mira el cambio de calor en términos de la materia realmente involucrada en la reacción y no en su entorno. En la reacción en la Ec. \(\ref{1}\), los átomos de C, H y O han perdido colectivamente energía y es esta pérdida la que se indica por un valor negativo de Δ H m.
Es importante notar que Δ H m es la energía para la reacción tal como está escrito. En el caso de la Ecuación\(\ref{1}\), eso representa la formación de 1 mol de dióxido de carbono y 2 mol de agua. La cantidad de calor liberado o absorbido por una reacción es proporcional a la cantidad de cada sustancia consumida o producida por la reacción. Así Ec. \(\ref{1}\)nos dice que 890.4 kJ de energía térmica se desprende por cada mol de CH 4 que se consume. Alternativamente, nos dice que 890.4 kJ se libera por cada 2 moles de H 2 O producidos. Visto de esta manera, Δ H m es un factor de conversión que nos permite calcular el calor absorbido o liberado cuando se consume o produce una cantidad dada de sustancia. Si q es la cantidad de calor absorbido o liberado y n es la cantidad de sustancia involucrada, entonces
\[\large \Delta H_{\text{m}}=\frac{q}{n} \nonumber \]
Cuánta energía térmica se obtiene cuando 1 kg de gas etano, C 2 H 6, se quema en oxígeno según la ecuación:
\[2 \text{C}_{2} \text{H}_{6} (g) + 7 \text{O}_{2} (g) \rightarrow 4 \text{C} \text{O}_{2} (g) + 6 \text{H}_{2} \text{O} (l) \nonumber \]
con\(\Delta H_{m} = –3120 \text{ kJ}\).
Solución
La masa de C 2 H 6 se convierte fácilmente a la cantidad de C 2 H 6 a partir de la cual la energía térmica q se calcula fácilmente por medio de la Ec. (2). El valor de Δ H m es —3120 kJ por cada 2 mol C 2 H 6. La hoja de ruta es
\[\large m_{\text{C}_{\text{2}}\text{H}_{\text{6}}}\text{ }\xrightarrow{M}\text{ }n_{\text{C}_{\text{2}}\text{H}_{\text{6}}}\text{ }\xrightarrow{\Delta H_{m}}\text{ }q \nonumber \]
para que\[\begin{align*} q &= 1 \times 10^3 \text{ g }\ce{C2H6} \times \frac{\text{1 mol }\ce{C2H6}}{\text{30.07 g }\ce{C2H6}} \times \frac{-3120\text{ kJ}}{\text{2 mol }\ce{C2H6}} \\ &= -\text{51 879 kJ} = -\text{51.88 MJ} \end{align*} \nonumber \]
Por convención, un valor negativo de q corresponde a una liberación de energía térmica por parte de la materia involucrada en la reacción.
La cantidad Δ H m se denomina cambio de entalpía para la reacción. En este contexto el símbolo Δ (delta) significa cambio en” mientras que H es el símbolo de la cantidad que se está cambiando, es decir, la entalpía. Trataremos la entalpía con cierto detalle en el Cap. 15. Por el momento podemos pensarlo como una propiedad de la materia que aumenta cuando la materia absorbe energía y disminuye cuando la materia libera energía.
Es importante darse cuenta que el valor de Δ H m dado en ecuaciones termoquímicas como\(\ref{1}\) o\(\ref{3}\) depende del estado físico tanto de los reactivos como de los productos. Así, si el agua se obtuvo como un gas en lugar de un líquido en la reacción en la Ec. \(\ref{1}\), el valor de Δ H m sería diferente de -890.4 kJ. También es necesario especificar tanto la temperatura como la presión ya que el valor de Δ H m depende muy ligeramente de estas variables. Si estos no se especifican suelen referirse a 25°C y a presión atmosférica normal.
Dos características más de las ecuaciones termoquímicas surgen de la ley de conservación de energía. La primera es que escribir una ecuación en la dirección inversa cambia el signo del cambio de entalpía. Por ejemplo,
\[ \text{H}_{2} \text{O} (l) \rightarrow \text{H}_{2} \text{O} (g) \\ \Delta \text{H}_{m} = 44 \text{ kJ} \nonumber \]

En la imagen de arriba, las llamas ingresan energía al agua, dándole la energía necesaria para la transición a la fase gaseosa. Dado que las llamas proporcionan la energía para la transición de fase, esta es una reacción endotérmica (la energía se absorbe).
nos dice que cuando un mol de agua líquida se vaporiza, se absorben 44 kJ de calor. Esto corresponde a que el calor se absorbe de tu piel cuando se evapora la transpiración, y te enfrías. La condensación de 1 mol de vapor de agua, por otro lado, desprende exactamente la misma cantidad de calor. \[ \text{H}_{2} \text{O} (g) \rightarrow \text{H}_{2} \text{O} (l) \\ \Delta \text{H}_{m} = –44 \text{kJ} \nonumber \]

Es contradictorio, pero la ocurrencia veraniega común vista arriba es en realidad exotérmica. Dado que la reacción no es altamente exotérmica (como la combustión de CH 4), nos resulta difícil asociarla con una liberación de energía. La termodinámica nos permite comprender mejor a nivel micro los cambios energéticos como este.
Para ver por qué esto debe ser cierto, supongamos que Δ H m [Eq. (4a)] = 44 kJ mientras Δ H m [Eq. (4b)] = —50.0 kJ. Si tomáramos 1 mol de agua líquida y dejáramos que se evapore, se absorberían 44 kJ. Entonces podríamos condensar el vapor de agua, y se desprenderían 50.0 kJ. Podríamos volver a tener 1 mol de agua líquida a 25°C pero también tendríamos 6 kJ de calor que se habían creado de la nada! Esto violaría la ley de conservación de la energía. La única manera en que el problema puede evitar es que Δ H m de la reacción inversa sea igual en magnitud pero opuesto en signo de Δ H m de la reacción hacia adelante. Es decir,
\[ \Delta \text{H}_{m} \text{forward} = –\Delta \text{H}_{m} \text{reverse} \nonumber \]


