6.2: Unión Iónica
- Page ID
- 75825
La unión iónica implica la transferencia de un electrón de un átomo (que se convierte en un catión cargado positivamente) a otro (que se convierte en un anión cargado negativamente). Los dos iones se atraen fuertemente para formar una red cristalina.
Dado que la unión iónica requiere que los átomos involucrados tengan una atracción desigual por sus electrones de valencia, un compuesto iónico debe involucrar átomos de dos elementos bastante diferentes. La atracción por los electrones depende de la distancia de los electrones desde el núcleo (que a su vez depende de la cantidad de blindaje por los electrones internos). Los compuestos iónicos generalmente se forman entre los metales hacia la izquierda y la parte inferior de la tabla periódica, y los no metales hacia la derecha y la parte superior de la tabla periódica.
El ejemplo más simple de un compuesto iónico binario lo proporciona la combinación de los elementos número 1 (H) y número 3 (Li) en hidruro de litio, LiH. A nivel microscópico la fórmula LiH contiene cuatro electrones. En átomos separados de Li y H estos electrones están dispuestos como se muestra en la parte a de la siguiente figura. El átomo H tiene la configuración electrónica 1 s 1, y Li es 1 s 2 2 s 1. Sin embargo, cuando los dos átomos se acercan lo suficiente, se produce el llamativo reordenamiento de las nubes de electrones mostradas en la parte b. Aquí la codificación de color muestra claramente que la densidad de electrones que se asoció con el orbital de 2 s en el átomo de Li individual se ha transferido a un orbital de 1 s que rodea al átomo H. Como resultado, se forman dos nuevas especies microscópicas. El electrón extra transforma el átomo H en un ion o anión negativo, escrito H — y llamado el ion hidruro. Los dos electrones que quedan en el átomo de Li no son suficientes para equilibrar la carga de +3 en el núcleo Li, por lo que la eliminación de un electrón produce un ion o catión positivo, escrito Li + y llamado el ion litio. El proceso de transferencia de electrones se puede resumir en diagramas de Lewis de la siguiente manera:
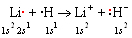
Las cargas opuestas de Li + y H —se atraen fuertemente entre sí, y los iones forman un par iónico (ver imagen abajo) en el que los dos núcleos están separados por una distancia de 160pm (1.60 Å).
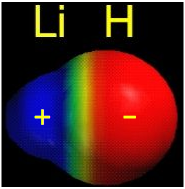
La imagen de arriba muestra un par de iones de hidruro de litio. Observe cómo el Litio tiene una carga positiva fuerte (catión) y el Hidrógeno tiene una carga negativa fuerte (anión).
Múltiples pares de iones (como se ve en la imagen de arriba) se conectan para formar una red cristalina, que se muestra a continuación. Todos los sólidos iónicos forman una red cristalina y la forma de la celosía determina las propiedades y el aspecto del sólido.



