6.3: La energía y la formación de iones
- Page ID
- 75790
La formación de un par iónico por transferencia de un electrón de un átomo de Li a un átomo de H da como resultado una disminución general de la energía total de los dos núcleos y cuatro electrones involucrados. Cómo y por qué ocurre esto se ve mejor si rompemos la formación de pares iónicos en tres pasos más simples y consideramos el cambio de energía involucrado en cada uno. Los tres pasos son
- Eliminación del electrón de 2 s de un átomo de Li para formar un ion Li +.
- Adición de ese mismo electrón a un átomo de H para formar un ion H —.
- La unión de los dos iones para formar un par de iones.
La energía requerida en el paso 1 para eliminar completamente un electrón de un átomo aislado se denomina energía de ionización. La energía de ionización del litio es 520 kJ mol —1. En otras palabras, se necesitan 520 kJ de energía para eliminar un mol de electrones de 2 s de un mol de átomos de litio aislados para formar un mol de iones de litio aislados. Alternativamente podemos decir que se necesitan 520 kJ para ionizar un mol de átomos de litio. Ver Figura\(\PageIndex{1}\) para una representación visual del “costo” energético de la ionización.
Si bien se necesita energía para lograr el paso 1, encontramos que la energía se libera en la etapa 2 cuando un átomo de hidrógeno acepta un electrón y se convierte en un ion hidruro. La razón de esto se puede ver en la formación del diagrama de densidad de puntos de par iónico LiH. El segundo electrón adquirido por el átomo de hidrógeno puede emparejarse con el electrón ya en el orbital de 1 s sin contradecir el principio de exclusión de Pauli. Como resultado, el nuevo electrón puede moverse lo suficientemente cerca del núcleo de hidrógeno como para sujetarse con bastante firmeza, disminuyendo su energía significativamente. Aunque los electrones emparejados se repelen un poco entre sí, esto no es suficiente para compensar la atracción del núcleo para ambos.
Dado que la energía del electrón se reduce, la ley de conservación de la energía requiere que se libere la misma cantidad de energía cuando un átomo de hidrógeno se transforma en un ion hidruro. La energía liberada cuando un electrón es adquirido por un átomo se denomina afinidad electrónica. La afinidad electrónica del hidrógeno es 73 kJ mol —1, lo que indica que 73 kJ de energía se libera cuando 1 mol de átomos de hidrógeno aislados acepta cada uno un electrón y se convierte en un ion hidruro.
Dado que se requieren 520 kJ mol —1 para eliminar un electrón de un átomo de litio, mientras que 73 kJ mol —1 se libera cuando el electrón se dona a un átomo de hidrógeno, se deduce que la transferencia de un electrón de un átomo de litio a un átomo de hidrógeno requiere (520 — 73) kJ mol —1 = 447 kJ mol —1. Este cambio neto de energía se puede ver mejor en la Figura\(\PageIndex{1}\).
A temperatura ambiente, los procesos que requieren una cantidad tan grande de energía son extremadamente improbables. Efectivamente la transferencia del electrón sería imposible si no fuera por el paso 3, el acercamiento cercano de los dos iones. Cuando las partículas con carga de oposición se acercan entre sí, su energía potencial disminuye y liberan energía. La energía liberada cuando los iones litio y los iones hidruro se unen a 160pm bajo la influencia de su atracción mutua es de 690 kJ mol —1, más que suficiente para compensar los 447 kJ mol —1 necesarios para transferir el electrón. Así, existe una liberación neta de (690 — 447) kJ mol —1 = 243 kJ mol —1 del proceso general. La transferencia del electrón del litio al hidrógeno y la formación de un par de iones Li + H — da como resultado una disminución general de la energía, como se ve en la Figura\(\PageIndex{1}\) a continuación.
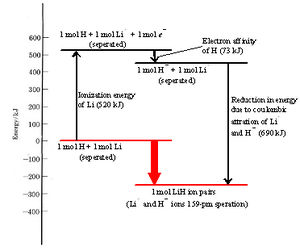
En la figura anterior, se ilustran diagramáticamente el cambio energético en cada paso y el cambio general. Como en el caso de la estructura atómica, donde los electrones ocupan orbitales que tienen la menor energía permisible, una colección de átomos tiende a reorganizar sus electrones constituyentes para minimizar su energía total. La formación de un par de iones hidruro de litio es energéticamente “cuesta abajo” y, por lo tanto, se favorece.
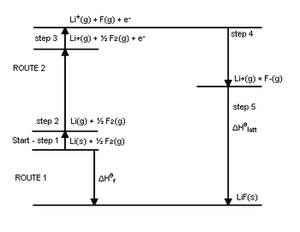
Una imagen más completa de las energías involucradas es proporcionada por el diagrama “Ciclo Nacido-Haber” de LiF 2 a continuación. Destaca que el EA y el IP se aplican a átomos individuales en fase gaseosa, y que otras energías pueden ser más importantes para determinar la exotermicidad de formación de compuestos iónicos. La mayor energía liberada no es la EA, sino la energía de celosía. Otros costos de energía implican la formación de átomos individuales en la fase gaseosa por vaporización de Li (s) (ΔH vap) para dar Li (g), y la energía de disociación de F 2 (ΔH disociación) para dar 2F. La suma de todas las energías es la energía de formación del compuesto iónico, según la Ley de Hess'. Básicamente, el Ciclo de Haber Born muestra todos los detalles de la formación de LiF 2, mientras que el diagrama que vimos anteriormente toma una vista de panorama general.
Referencias
- Ciclo Haber [es.wikipedia.org]


