6.1: Preludio a la unión química
- Page ID
- 75695
Hemos cubierto las ideas básicas de la estructura atómica, pero vale la pena darnos cuenta que de todos los elementos solo los gases nobles se encuentran de forma natural en una forma tal que sus átomos ocurren como individuos, ampliamente separados de todos los demás átomos. Bajo las condiciones que prevalecen en la superficie de la tierra, casi todos los átomos están unidos por enlaces químicos a otros átomos. El oxígeno, por ejemplo, es el elemento más común en la tierra. Se encuentra en combinación con metales en rocas, con hidrógeno en agua, con carbono e hidrógeno en organismos vivos, o como la molécula diatómica O 2 en la atmósfera, pero los átomos de oxígeno individuales son bastante raros. La mayoría de los demás elementos se comportan de manera similar. Así, si queremos entender la química de la materia cotidiana, necesitamos entender la naturaleza de los enlaces químicos que mantienen unidos a los átomos.
Las teorías de la unión química involucran invariablemente electrones. Cuando un átomo se acerca a otro, los electrones de valencia, que se encuentran en las regiones más externas de los átomos, interactúan mucho antes de que los núcleos puedan acercarse. Los electrones son los componentes menos masivos de un átomo, por lo que pueden reubicarse para producir fuerzas electrostáticas que mantienen unidos a los átomos. Según la ley de Coulomb, tales fuerzas electrostáticas o coulómbicas son bastante grandes cuando las cargas están separadas por distancias de unos pocos cientos de picómetros, del tamaño de un átomo. Las fuerzas coulómbicas, entonces, son bastante capaces de explicar las fortalezas de los enlaces por los cuales se mantienen unidos los átomos.
Una importante evidencia relativa a los electrones y la unión química fue anotada por G. N. Lewis poco después del descubrimiento de que el número atómico indicaba cuántos electrones estaban presentes en cada tipo de átomo. La mayoría de las fórmulas químicas corresponden a un número par de electrones sumados sobre todos los átomos constituyentes. Así H 2 O tiene 2 electrones de las 2 H's y 8 de O para un total de 10, NCl 3 tiene 7 + (3 × 17) = 58 electrones, y así sucesivamente. Esto es un poco sorprendente cuando se considera que la mitad de los elementos tienen números atómicos impares de manera que sus átomos tienen un número impar de electrones. Lewis sugirió que cuando los átomos están unidos entre sí, los electrones ocurren en pares, lo que explica el predominio de números pares de electrones en las fórmulas químicas. Estos pares suelen dejar átomos unidos con ocho electrones en la capa más externa, conocida como la regla del octeto. El orbital que se muestra a continuación da un ejemplo visual de la regla del octeto, ya que tiene un octeto completo, o 8 electrones de valencia.
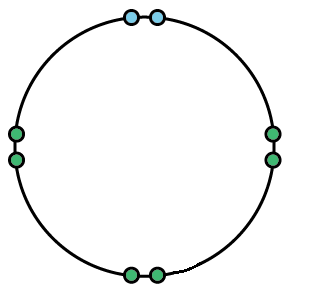
Imagen s
Hay dos formas importantes en las que las conchas de valencia de diferentes átomos pueden interactuar para producir pares de electrones y enlaces químicos. Cuando dos átomos tienen grados de atracción bastante diferentes por sus electrones más externos, uno o más electrones pueden transferir su lealtad de un átomo a otro, emparejándose con electrones ya presentes en el segundo átomo. El átomo al que se transfieren los electrones adquirirá exceso de carga negativa, convirtiéndose en un ion negativo, mientras que el átomo que pierde electrones se convertirá en un ion positivo. Estos iones cargados opuestamente se mantendrán unidos por las fuerzas culómbicas de atracción entre ellos, formando un enlace iónico. Dado que los electrones se desplazan de manera que un átomo neutro se carga positivamente y el otro se carga negativamente, las sustancias formadas a partir de enlaces iónicos suelen estar en pares y luego se denominan compuestos iónicos binarios. Los compuestos iónicos binarios no son demasiado comunes, pero la existencia de iones poliatómicos extiende en gran medida el número de sustancias iónicas. Los iones cargados opuestamente se mantienen en redes cristalinas por fuertes fuerzas culómbicas, un ejemplo de lo cual se muestra a continuación.

Esta estructura reticular cristalina significa que las propiedades físicas de los compuestos iónicos incluyen dureza, fragilidad y tener altos puntos de fusión y ebullición. La mayoría de ellos se disuelven en agua, y en solución cada ion exhibe sus propias propiedades químicas. Los compuestos iónicos obedecen a la regla del octeto, lo que explica por qué los iones están generalmente en configuraciones de electrones de gas nobles. Un ejemplo cotidiano de un compuesto iónico, la sal, se puede ver a continuación.

Por otro lado, cuando dos átomos tienen el mismo grado de atracción por sus electrones de valencia, es posible que compartan pares de electrones en la región entre sus núcleos. Tales pares compartidos de electrones atraen ambos núcleos, manteniéndolos unidos con un enlace covalente. Compartir uno o más pares de electrones entre dos átomos atrae a los núcleos juntos y generalmente da como resultado un octeto alrededor de cada átomo. Este proceso de compartir electrones se demuestra a continuación, donde dos átomos de hidrógeno comparten sus únicos electrones entre sí, formando así un enlace covalente.
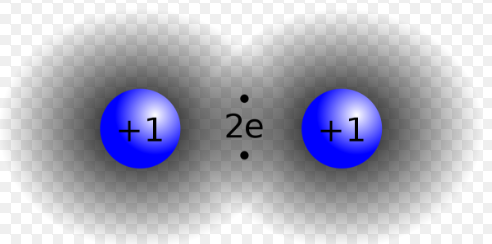
Figura 6.0.4 El enlace mostrado anteriormente es covalente debido a que los 2 electrones son compartidos entre átomos.
La unión covalente a menudo produce moléculas individuales, como CO 2 o CH 3 CH 2 OH, que no tienen carga eléctrica neta y poca atracción entre sí. Por lo tanto, las sustancias covalentes suelen tener bajos puntos de fusión y ebullición y son líquidos o gases a temperatura ambiente. Ocasionalmente, como en el caso del SiO 2, se requiere una red extendida de enlaces covalentes para satisfacer la regla del octeto. Tales moléculas gigantes dan como resultado compuestos sólidos con altos puntos de fusión. Un sólido covalente común (si es caro), conocido por su dureza, es el diamante, que se muestra a continuación.

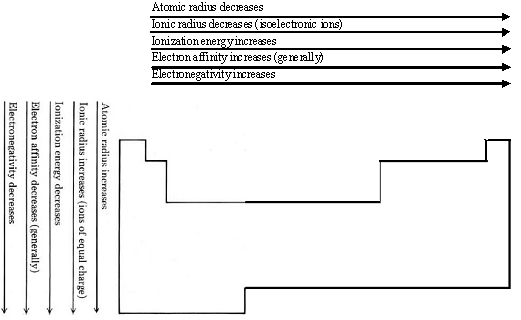
Varias propiedades atómicas, como la energía de ionización, la afinidad electrónica, los radios de van der Waals, los radios atómicos covalentes y los radios iónicos, son importantes para determinar si ciertos elementos formarán compuestos covalentes o iónicos y qué propiedades compuestos tendrán. En las siguientes secciones consideraremos la formación de enlaces covalentes e iónicos y las propiedades de algunas sustancias que contienen cada tipo de enlace. La siguiente figura muestra una vista previa de cómo cada propiedad atómica importante para entender la unión varía según la posición de un átomo en la tabla periódica. La figura también incluye una propiedad atómica, la electronegatividad, que se cubrirá cuando exploremos más a fondo aspectos del enlace covalente.